
Лекция по теме «Гальванические элементы»
Учебные вопросы
Понятие гальванического элемента
Потенциалы различных электродов
Электрохимическая поляризация
1. Понятие гальванического элемента
Гальванические элементы состоят из двух электродов, имеющих различный электродный потенциал, электролита, который дает возможность перемещаться ионам от одного электрода к другому, и металлического проводника электронов в результате потока которых может быть получена электрическая энергия постоянного тока.
ЭДС гальванического элемента равна разности равновесных потенциалов положительного электрода (катода) и отрицательного электрода (анода). Если потенциал одного из электродов принять равным нулю, то относительный потенциал второго электрода будет равен ЭДС элемента. Таким образом, можно определить относительный потенциал любого электрода.
Потенциалы различных электродов
Стандартный
водородный электрод.
Равным нулю принят потенциал стандартного
водородного электрода (Е02Н+/Н2
0,0В).
Стандартный
водородный электрод
состоит из платиновой пластины, покрытой
платиновой чернью (мелко раздробленной
платиной), контактирующей с газообразным
водородом под давлением 1атм и раствором
серной кислоты, в котором активность
ионов водорода Н+
равна единице (рис. 1).
В водородном электроде происходит реакция, аналогичная реакциям, протекающим на поверхности металлических электродов. Платина здесь играет только роль инертного проводника, а ее поверхностный слой адсорбирует (концентрирует) водород. Адсорбированный водород, взаимодействуя с молекулами воды, переходит в раствор в виде ионов, оставляя на платине электроны.
При этом платина заряжается отрицательно, а раствор – положительно, Возникает скачок потенциала между платиной и раствором. Наряду с переходом ионов в раствор идет обратный процесс восстановления ионов Н+ с образованием молекул водорода.
Равновесие на водородном электроде можно представить в виде
2Н+
+ 2![]()
![]() Н2
Н2
Схематически водородный электрод обозначают 2Н+/Н2, где вертикальная черта обозначает поверхность раздела фаз.

Рис. 1. Ячейка для измерения электродного потенциала металла:
а - аккумулятор; б – стандартный водородный
электрод; в–металлический электрод.
Потенциалы металлических электродов. При погружении металла в раствор, содержащий ионы этого металла, устанавливается равновесие:
Ме
![]() Меn+
+ n
Меn+
+ n![]()
При равновесии скорость растворения металла равна скорости разряда его ионов. Потенциал, устанавливающийся на электроде при равновесии, называется равновесным потенциалом. Электродный потенциал металла определяют либо экспериментально компенсационным методом, либо вычисляют. Для его измерения составляется гальванический элемент, одним из электродов которого является измеряемый, а вторым – стандартный водородный электрод:
(катод)
Pt, H2/2H+II
Men+/Me
(анод)
р![]() =
1 атм,aH+
=
1 атм,aH+![]() = 1 моль/л
= 1 моль/л
и
измеряется его электродвижущая сила
(ЭДС) в условиях обратимой работы
элемента (при отсутствии тока в цепи)
(рис. 1). Она равна разности равновесных
потенциалов катода и анода ЭДС = (│Ек- Еа│). Так как потенциал стандартного
водородного электрода равен нулю
(Е02Н![]() /Н
/Н![]() =0),
то ЭДС элемента будет равна потенциалу
измеряемого электрода.
=0),
то ЭДС элемента будет равна потенциалу
измеряемого электрода.
Для вычисления электродного потенциала применяют уравнение Нернста:
![]()
![]() +
+
![]() ln
ln![]() (1) ,
(1) ,
учитывая,
что активность твердой фазы постоянна
и равна
![]() = 1 моль/л, получаем:
= 1 моль/л, получаем:
![]()
![]() +
+
![]() ln
ln![]() (2),
(2),
где Е0 - стандартный электродный потенциал, В;
R - универсальная газовая постоянная, равная 8,314
Вт-с/моль ∙ К;
Т - температура, К;
n - число электронов, участвующих в электродном про-
цессе;
F - число Фарадея, равное 96500 Кл/моль;
![]() -активность
ионов металла,
моль/л.
-активность
ионов металла,
моль/л.
Переходя от натуральных логарифмов к десятичным и подставляя в уравнение Нернста Т = 298 К и соответствующие значения R и F уравнение приобретает более простой вид:
![]()
![]() +
+
![]()
![]() (3)
(3)
Для
разбавленных растворов, в которых
активности мало отличаются от концентраций
(аМе![]()
![]() [Men+]),
в уравнении Нернста активность можно
заменить концентрацией:
[Men+]),
в уравнении Нернста активность можно
заменить концентрацией:
![]()
![]() +
+
![]()
![]() [
[![]() ]
(4)
]
(4)
Значение
стандартного электродного потенциала
металлического электрода
![]() можно определить экспериментально,
описанным выше, компенсационным методом
при
можно определить экспериментально,
описанным выше, компенсационным методом
при
![]() =
1 моль/л..
=
1 моль/л..
Стандартным потенциалом металлического электрода называют потенциал этого электрода в растворе собственных ионов с их активностью, равной 1 моль/л, определенный относительно стандартного водородного электрода.
Стандартные потенциалы металлических электродов в водных растворах (ряд стандартных электродных потенциалов) приведены в таблице 1.
Ряд стандартных электродных потенциалов (ряд напряжений металлов). Стандартные электродные потенциалы металлов являются мерой окислительно-восстановительной способности металла и его ионов. Металлы в виде простых веществ – восстановители, ионы металлов – окислители.
Знак электродного потенциала характеризует активность металла относительно водорода. Металлы имеют электродные потенциалы со знаком "минус", если их активность выше активности водорода и "плюс", если они менее активны, чем водород.
Чем отрицательнее значение электродного потенциала металла, тем более сильной восстановительной способностью он обладает. Например, литий, калий, натрий относятся к сильным восстановителям. И наоборот, чем более положителен потенциал металлического электрода, тем большей окислительной способностью обладают его ионы.
Активные
металлы начала ряда, а также щелочные
и щелочно -земельные вытесняют водород
из воды. Например, 2K
+ 2H2O
![]() 2KOH
+ H2
2KOH
+ H2
![]() .
.
Металлы, расположенные между магнием и кадмием, обычно не вытесняют водород из воды. На поверхности этих металлов образуются оксидные пленки, обладающие защитным действием.
Все
металлы, стоящие в ряду стандартных
электродных потенциалов до водорода,
вытесняют его из растворов кислот с
концентрацией (активностью) ионов
водорода 1 моль/л. Например, Zn
+ HCl
![]() ZnCl2
+ H2
ZnCl2
+ H2
![]() .
.
Если электродный потенциал металла имеет положительный знак, то металл является окислителем по отношению к водороду и не вытесняет его из растворов кислот с концентрацией ионов водорода 1 моль/л.
Металлы
способны вытеснять друг друга из
растворов солей. Направление реакции
определяется при этом их взаимным
положением в ряду напряжений. Рассматривая
конкретные случаи таких реакций, следует
помнить, что активные металлы вытесняют
водород не только из воды, но и из любого
водного раствора. Поэтому взаимное
вытеснение металлов из растворов их
солей практически происходит лишь в
случае металлов, расположенных в ряду
после магния. Например, Zn
+ CuSO4
![]() ZnSO4
+Cu.
ZnSO4
+Cu.
Потенциалы газовых электродов. Газовые электроды могут быть обратимыми относительно анионов (кислородный) или относительно катионов (водородный). Газовые электроды состоят из металлического проводника, контактирующего одновременно с газом и раствором, содержащим ионы этого газа. Металлический проводник служит для подвода и отвода электронов и, кроме того, является катализатором электродной реакции (ускоряет установление равновесия на электроде). Металлический проводник не должен посылать в раствор собственные ионы, т.е. быть инертным, а также обладать хорошей адсорбционной способностью, так как в электродном процессе участвуют адсорбированный газ и его ионы в растворе. Всем этим требованиям удовлетворяют платина, покрытая электролитическим способом платиновой чернью, и металлы платиновой группы, поэтому они чаще всего используются при создании газовых электродов.
Так как в равновесных электродных реакциях газовых электродов участвуют газообразные компоненты, то потенциалы этих электродов зависят от парциальных давлений газов.
Равновесие
на водородном электроде выражается
уравнением 2Н+
+ 2
![]()
![]() Н2
. Уравнение Нернста для расчета потенциала
водородного электрода имеет следущий
вид:
Н2
. Уравнение Нернста для расчета потенциала
водородного электрода имеет следущий
вид:
Е2Н![]() Н
Н![]() =
=
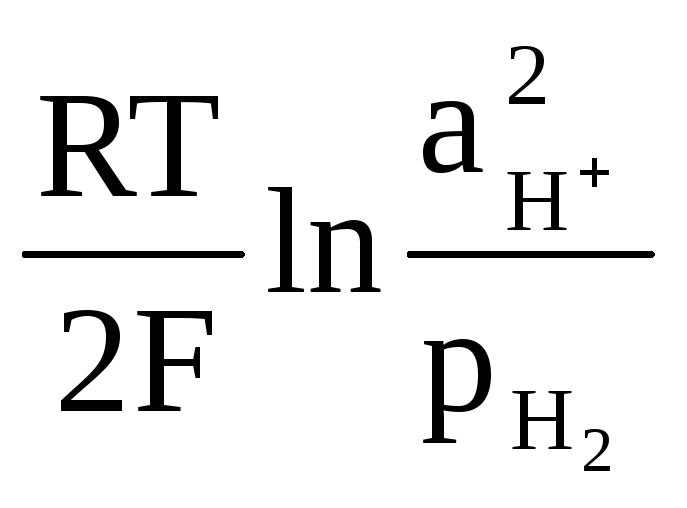 (5)
(5)
или для 298 К
Е2Н![]() Н
Н![]() =
=
 ,
(6)
,
(6)
где
аН![]() - активность ионов Н+
в электролите; рН
- активность ионов Н+
в электролите; рН![]() - парциальное давление водорода.
- парциальное давление водорода.
Учитывая,
что
![]() = - рН, получаем при 298 К
= - рН, получаем при 298 К
Е2Н![]() Н
Н![]() =
=
![]() (
7)
(
7)
при
рН![]() =
1 и 298 К уравнение (4.18) приобретает вид:
=
1 и 298 К уравнение (4.18) приобретает вид:
Е2Н![]() Н
Н![]() =
- 0,059 рН (8)
=
- 0,059 рН (8)
Кислородный электрод состоит из платиновой пластины, контактирующей с кислородом и раствором, содержащим ионы, которые образуются при восстановлении кислорода (ионы ОН-):
О2, Pt │ОН-
Если на кислородном электроде протекает реакция по уравнению:
2
Н2О
+ О2
+
4
![]()
![]() 4 ОН-
4 ОН-
то выражение равновесного потенциала для 298 К имеет вид:
Е2Н![]() О
+О
О
+О![]() /
4ОН
/
4ОН![]() = Е02Н
= Е02Н![]() О
+О
О
+О![]() /
4ОН- +
/
4ОН- +
 (4.20)
(4.20)
Так
как активность воды в ходе реакции
меняется мало, то ее считают величиной
постоянной и значение
![]() вводят в Е
02Н
вводят в Е
02Н![]() О
+О
О
+О![]() /
4ОН
/
4ОН![]() :
:
Е2Н![]() О
+О
О
+О![]() /
4ОН
/
4ОН![]() = Ео2Н
= Ео2Н![]() О
+О
О
+О![]() /
4ОН
/
4ОН![]() + 0,0147
+ 0,0147
 , (9)
, (9)
где Ео2Н![]() О
+О
О
+О![]() /
4ОН
/
4ОН![]() - стандартный потенциал кислородного
электрода, равный 0,401 В (при аОН-= 1 моль/л).
- стандартный потенциал кислородного
электрода, равный 0,401 В (при аОН-= 1 моль/л).
Подставляя
в уравнение (4.21) значение а ОН-
= КН![]() О/
аН+
, где КН
О/
аН+
, где КН![]() О
- ионное произведение воды, и
О
- ионное произведение воды, и
![]() = -рН, получаем
= -рН, получаем
Е2Н![]() О
+О
О
+О![]() /
4ОН
/
4ОН![]() = 1,23 + 0,0147
= 1,23 + 0,0147
![]() -
0,059 рН (10)
-
0,059 рН (10)
Учитывая,
что
![]() =
- рОН,
=
- рОН,
![]() О
О![]() =
1атм, аН
=
1атм, аН![]() О
= 1моль/л и Т=298 К уравнение ( 4.20)
приобретает вид:
О
= 1моль/л и Т=298 К уравнение ( 4.20)
приобретает вид:
Е2Н![]() О
+О
О
+О![]() /
4ОН
/
4ОН![]() = Ео2Н
= Ео2Н![]() О
+О
О
+О![]() /
4ОН
/
4ОН![]() +
0,059
+
0,059
![]() (11)
(11)
Зависимости потенциалов водородного и кислородного электродов от рН раствора приведены в таблице.
Таблица. Газовые электроды
|
Уравнение |
Электрод и его обозначения | |||
|
водородный |
кислородный | |||
|
2Н+/Н2 |
2H2O/H2,2OH-,Pt |
Pt,O2,4H+/2H2O |
Pt,O2,2H2O/4OH- | |
|
pH < 7 |
pH
|
pH < 7 |
pH
| |
|
электродного процесса |
2Н+
+2 |
2
Н2О
+2 |
О2+
4Н+ +
4 |
2Н2О
+О2
+ 4 |
|
Ео, В |
0,000 |
-0,828 |
1,229 |
0,401 |
|
уравнение Нернста |
|
|
|
|
|
Для расчета электродного потенциала:
а) при Т=298К
б) при Т=298К и
|
|
|
-0,059рН + 0,0147
|
= 1,229-0,059рН |
Потенциалы окислительно-восстановительных электродов. Любая электродная реакция представляет собой окислительно-восстановительную реакцию. К окислительно-восстановительным электродам относят только те электроды, в реакциях которых не принимают непосредственного участия металлы и газы. Такие электроды состоят из металлического проводника, контактирующего с раствором, содержащим окислители и восстановители. К металлу в окислительно-восстановительных электродах предъявляются те же требования, что и к металлическому проводнику в газовых электродах.
В общем виде равновесие на электроде записывается уравнением:
Ox
+ n![]()
![]() Red
Red
Схема электрода соответственно может быть записана в форме
Pt│Ox, Red,
где Ox – окисленная форма вещества; Red – восстановленная форма вещества.
Уравнение Нернста для расчета потенциала окислительно-востановительного электрода имеет вид:
![]() (12)
(12)
В более сложных окислительно-восстановительных процессах участвуют ионы ОН- или Н+. В этих случаях, как и потенциалы кислородного и водородного электродов, окислительно-восстановительные потенциалы зависят от рН. Например, для реакции:
MnO4-
+ 8 H+
+
5
![]()
![]()
![]() Mn2+
+
4 H2O
Mn2+
+
4 H2O
в которой ионы MnO4- являются окисленной формой вещества, а ионы Mn2+- восстановленной формой вещества, потенциал определяется уравнением:
 (13)
(13)
Под
знаком логарифма в уравнении (12)
отсутствует активность воды, которая
при электродных реакциях остается
практически постоянной и вводится в
значение Ео.
Подставляя числовые значения величин
R
и F
в уравнение (…) и учитывая, что
![]() ,
получаем для 298 К:
,
получаем для 298 К:
 (14)
(14)
Как видно, окислительно-восстановительный потенциал мало зависит от активностей ионов MnO4- и Mn2+ и существенно меняется с изменением рН раствора. Значения стандартных потенциалов некоторых окислительно-восстановительных систем приведены в справочных таблицах.
Потенциал окислительно-восстановительных электродов служит мерой окислительной и восстановительной способности систем.
Чем выше значение стандартного потенциала окислительно-восстановительного электрода, тем более сильным окислителем будет его окисленная форма.
Чем ниже значение стандартного потенциала окислительно-восстановительного электрода, тем более сильным восстановителем будет его восстановленная форма.
В соответствии с уравнением Нернста окислительно-восстановительная способность систем также зависит от активности окисленной и восстановленной форм вещества, а для реакций с участием ионов Н+ и ОН- и от рН среды.
Для
определения направления
окислительно-восстановительных процессов
необходимо рассчитать электродвижущую
силу ∆Е
как разность потенциалов
окислительно-восстановительных
электродов ∆Е
= (![]() ),
участвующих в данном процессе. Реакция
будет протекать в направлении, в котором
∆Е
положительна. Электрод, имеющий большую
величину электродного потенциала
является катодом, т.е. электродом–окислителем
(
),
участвующих в данном процессе. Реакция
будет протекать в направлении, в котором
∆Е
положительна. Электрод, имеющий большую
величину электродного потенциала
является катодом, т.е. электродом–окислителем
(![]() ).
Электрод-восстановитель имеет меньшую
величину электродного потенциала и
играет роль анода. Например, реакция
).
Электрод-восстановитель имеет меньшую
величину электродного потенциала и
играет роль анода. Например, реакция
Sn2+
+ 2 Fe3+
![]() Sn4+
+ 2 Fe2+
Sn4+
+ 2 Fe2+
при
![]() = 1 моль/л осуществляется в прямом
направлении, так как ∆Е
положительна при условии, что электрод
Fe3+/Fe2+
является катодом, т.е. электродом-окислителем.
= 1 моль/л осуществляется в прямом
направлении, так как ∆Е
положительна при условии, что электрод
Fe3+/Fe2+
является катодом, т.е. электродом-окислителем.
![]()
![]() (табл. 2).
(табл. 2).
![]()




