
- •Предмет химической кинетики и основные понятия
- •2. Скорость химических реакций
- •2.1. Гомогенные химические реакции
- •3. Зависимость скорости гомогенной химической реакции от концентрации реагирующих веществ
- •Графический метод определения констант дифференциального кинетического уравнения
- •4. Зависимость концентрации реагирующих веществ от времени для реакции первого порядка. Интегральное кинетическое уравнение
- •5. Скорость гетерогенной химической реакции
- •Литература
Графический метод определения констант дифференциального кинетического уравнения
Определим константы дифференциального кинетического уравнения для следующей реакции:
аА + bB → продукты
Зависимость скорости от концентраций выражается уравнением (3)
|
|
(3) |
Прологарифмируем это выражение:
|
|
(4) |
Так как величины k, nиmдля рассматриваемой реакции (приT =const) являются постоянными и не зависят от концентрации реагентов, то для их нахождения достаточно определить зависимость скорости реакции от концентрации одного из реагентов при фиксированной концентрации другого реагента.
Пусть в трех опытах концентрация вещества А будет постоянной и равной [A]0, тогда в уравнении (4) сумма (lnk+nln[A]0) будет тоже величиной постоянной, обозначим ее
![]() .
.
Тогда уравнение (4) можно переписать как
![]() .
(5)
.
(5)
Зависимость (5) представляет собой в
координатах ln[B]
-![]() уравнение прямой линии, тангенс угла
наклона которой численно равен порядку
реакции по веществуВ.
уравнение прямой линии, тангенс угла
наклона которой численно равен порядку
реакции по веществуВ.
По экспериментальным данным строят
график зависимости
![]() отln[B]
(рис. 3) и находят порядок реакции по
веществуB:
отln[B]
(рис. 3) и находят порядок реакции по
веществуB:
![]() или
или
 .
.

Рис.3. Определение порядка реакции по веществу В
В последующих опытах определяют скорость реакции при различных исходных концентрациях вещества Аи постоянной концентрации [B]0. Находят порядок реакции по веществуА:
![]() или
или
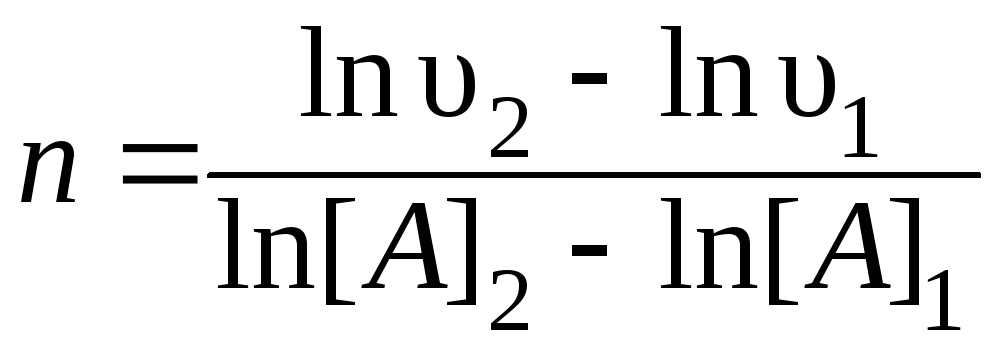 .
.
Из уравнения (3) с учетом найденных порядков реакции по веществам АиВ, рассчитывают константу скоростиk:
 ,
,
где
![]() ,
[A]i,
[B]i
- экспериментальные данные, относящиеся
к одному опыту.
,
[A]i,
[B]i
- экспериментальные данные, относящиеся
к одному опыту.
4. Зависимость концентрации реагирующих веществ от времени для реакции первого порядка. Интегральное кинетическое уравнение
На практике чаще всего интересует не само значение скорости химической реакции, а то, сколько вещества израсходовано или образовалось к определенному моменту времени после начала реакции.
Рассмотрим эту задачу на примере реакции первого порядка
А продукты
Скорость такой реакции выражается следующим уравнением
|
|
(6) |
В дифференциальном виде:
|
|
(7) |
Приравняв правые части уравнений (6) и (7), получим
![]() .
.
Перепишем это уравнение в следующем виде
-![]()
и возьмем определенный интеграл от обеих частей уравнения от исходного состояния ([A]0,t0 = 0) до текущего момента ([A]t,t):
 .
.
Решение этого уравнения приводит к следующей зависимости:
|
|
(8) |
или
|
|
(9) |
По уравнению (9), зная исходную концентрацию вещества [A]0и константу скорости реакцииk, можно рассчитать концентрацию [A]tчерез любое времяtпосле начала реакции.
Если же известны исходная концентрация [A]0и концентрация реагирующего вещества [A]tчерез какое-то времяtпосле начала реакции, то можно рассчитать константу скорости этой реакции:
|
|
(10) |
Соотношения (8) - (10) являются интегральными кинетическими уравнениямиреакции первого порядка.
Часто для характеристики скорости
реакции пользуются временем полупревращения
t1/2(для реакций
первого порядка чаще говорят «период
полураспада»).t1/2- это время, за которое прореагирует
половина исходного вещества:![]() .
Тогда, исходя из уравнения (10), получим
следующие зависимости:
.
Тогда, исходя из уравнения (10), получим
следующие зависимости:
|
|
(11) |
|
|
(12) |

 .
. ;
;