
6. Относительная электроотрицательность.
В большинстве случаев связи в молекулах имеют промежуточный характер между двумя предельными случаями – ковалентным или ионным типами связи. Например, в молекуле HF связь не является ни чисто ковалентной, ни чисто ионной. Но насколько же неравномерно происходит обобществление электронов в молекуле HF, и какой атом в молекуле HF притягивает к себе в большей степени обобществлённые электроны Н или F? Чтобы ответить на второй вопрос и иметь возможность дать качественный ответ на первый вопрос, Полинг в 1932 г ввёл понятие электроотрицательности (ЭО) элемента (обозначается греческой χ) и относительной электроотрицательности химической связи (ОЭО). Электроотрицательность является мерой способности атома притягивать к себе валентные обобществлённые электроны. ОЭО равна разности электроотрицательностей элементов, участвующих в образовании химической связи. Условно принято считать, что при относительной электроотрицательности больше 1.7.
7. Пространственная структура молекул
Ковалентная химическая связь характеризуется направленностью, что обусловлено определёнными ориентациями атомных орбиталей в пространстве. Атомные орбитали, участвующие в образовании химических связей могут быть s, p, d и f. Как уже отмечалось выше только s-орбитали имеют форму сферы, остальные гантелеобразные. Различают следующие типы связей: сигма – связь (обозначается символом σ), пи-связь (обозначается символом π ) дельта – связи (обозначается символом δ).
Сигма- связь.
Связь, образованная перекрыванием АО по линии, соединяющей ядра взаимодействующих атомов, называется σ-связью. Эта связь может образовываться при перекрывании s-орбиталей, s и p-орбиталей, p и p-орбиталей, s и d –орбиталей, d и d –орбиталей и.т.д.

Рис.4 Перекрывание атомных орбиталей при образовании σ-сязей
Сигма связь является простой ординарной связью. Кроме простых σ –связей существуют кратные (двойные и тройные) связи, которые образуются при наложении σ, π- и δ- связей. Двойная связь образуется за счёт обобществления двух общих электронных пар, тройная связь – за счёт обобществления трёх электронных пар. Связь, образованная перекрыванием атомных p - или d - орбиталей по обе стороны линии (на самом деле плоскости), которая соединяет ядра атомов, называется π- связью. Пи-связь может образовываться при перекрывании p-p- орбиталей, p -d-орбиталей, d- d -орбиталей, f-p-орбиталей, f-d-орбиталей и f-f-орбиталей. Двойная связь состоит из одной σ-связи и одной π- связи; тройная связь состоит из одной σ-связи и двух π- связей.

Рис.5 Перекрывание атомных орбиталей при образовании π-связей
Связь, образованная перекрыванием d-орбиталей всеми четырьмя лепестками, называется δ-связью.

Рис. 6 Направление перекрывания атомных d-орбиталей
при образовании δ-связей
Понятие гибридизации было введено Полингом для объяснения возникновения эквивалентных связей в соединениях типа BeCl2, AlCl3, CH4, C2H4 и др.
Рассмотрим, каким образом образуются химические связи элементами 11А, 111А и 1VА групп.
Строение внешнего электронного уровня, а именно его электроны участвуют в образовании химических связей и определяют валентность элемента и его степень окисления, элементов 11А группы следующее:

Видно, что валентные электроны находятся на внешнем n-уровне (здесь n-главное квантовое число равное 2,3, 4…) и они спарены, С точки зрения метода ВС элементы 11А группы в основном состоянии проявляют нулевую валентность. Однако мы знаем, что элементы этой группы проявляют валентность, равную двум, причём образуемые при этом две химические связи эквивалентны. Для объяснения этого факта, считают, что при незначительном возбуждении один из спаренных электронов с ns –атомной орбитали переходит на одну из трёх вакантную р-атомную орбиталь с образованием следующего электронного строения внешнего энергетического уровня:

Так как химические связи в соединениях МеХ2 эквивалентны, то считают, что происходит гибридизация одной s-AO и одной р-АО с образованием двух sp- гибридных атомных орбиталей:
![]()
Схема образования 2-х sp-гибридных орбиталей
Примеры соединений элементов 11А группы: BeH2, MgCl2, CaF2, BaI2 и др. Молекулы линейны, валентные углы равны 1800. Металлы 1А и11А групп относятся к s-элементам.
Рассмотрим образование химических связей в элементах 111А группе, строение внешнего электронного уровня которых в основном состоянии следующее:

Здесь n-главное квантовое число или номер периода элемента 111А группы (n = 2,3,4,…). Поскольку в основном состоянии на внешнем электронном уровне у элементов этой группы размещён только один неспаренный электрон, то формально они должны быть одновалентными. Однако в природе в соединениях этих элементов они проявляют валентность равную трём. Аналогично соединениям 11А группы в соединениях этой группы в возбужденном состоянии один из s–электронов переходит на р-орбиталь, электронное строение валентного уровня при этом следующее:
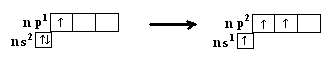
Следует отметить, что в соответствии с правилом Гунда возбуждённый электрон имеет ту же ориентацию, что и электрон, находящийся на этом уровне в основном состоянии. В возбужденном электронном состоянии элемент образует три эквивалентные sp2-атомные орбитали (в образовании этих гибридизованных орбиталей участвуют одна s-АО и две
р-АО, отсюда и название sp2- гибридизация):

Схема образования 3-х sp2-гибридных орбиталей
При взаимодействии, например, с водородом или галогенами элементы 111А группы будут образовывать соединения, молекулы которых имеют плоское строение с валентными углами 1200:

Заметим, что в обеих молекулах образуются сигма-связи, но в молекуле гидрида бора сигма связи образованы перекрыванием s-AO атомов водорода и sp2 –гибридизованными атомными орбиталями бора, а в BCl3 сигма связи образованы π-орбиталями атомов хлора и sp2 –гибридизованными атомными орбиталями бора.
В элементах 1V А строение внешнего электронного имеет вид
 ,
,
а в возбуженном состоянии:
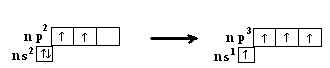 ,
,
в гибридизации участвуют одна s-АО и три р-АО, образуя четыре sp3-гибридные АО:

Рассмотрим несколько примеров, поясняющих разделы 1-5.
Пример 1. Напишите электронное строение элементов третьего периода, определите их возможные валентности, степени окисления. Объясните причины возрастания потенциалов ионизации и сродства к электрону при переходе от одного элемента к другому в периоде слева направо. Как изменяются кажущиеся атомные радиусы элементов в периоде.
Решение
Для элементов третьего периода главное квантовое число n = 3. Следовательно, у каждого элемента этого периода имеется по три энергетичесих уровней (n = 1, 2 и 3); первый энергетический уровень имеет электронное строение аналогичное ядру гелия, второй энергетический уровень – аналогичное электронному строению ядра неона, т.е. для всех элементов третьего периода два внутренних энергетических уровня имеют следующее строение: 1s22s22p6. Третий энергетический уровень появляется у натрия и начинается с заполнения 3s полуровня. Кроме того, у всех элементов третьего периода имеется вакантный 3d-подуровень.
Na: 1s22s22p63s1; Mg: 1s22s22p63s2; Al: 1s22s22p63s2 3p1; Si: 1s22s22p63s2 3p2; P: 1s22s22p63s2 3p3; S: 1s22s22p63s2 3p4; Cl: 1s22s22p63s2 3p5; Ar: 1s22s22p63s2 3p6.
В каждом периоде при перемещении слева направо происходит последовательное уменьшение атомных радиусов. Такое сжатие происходит потому, что хотя при этом на s- и p-орбитали постепенно увеличивается число электронов, они недостаточно полно экранируют друг друга от последовательно увеличивающегося заряда ядра. Таким образом, возрастание заряда ядра в конечном счёте приводит к увеличению эффекта электростатического взаимодействия между положительно заряженным ядром и электронами, что и вызывает уменьшение эффективного атомного радиуса. Значения эффективных атомных радиусов в пикометрах следующие (пм – пикометр = 10-12м =10-2 Ǻ): Na (154 = 1,54 Ǻ), Mg (130), Al (125), Si (134), P (110), S (104), Cl (99), Ar (66). Вследствие уменьшения эффективных радиусов в периоде при перемещении слева направо происходит последовательное увеличение потенциалов ионизации и сродства к электрону.
Валентность первых трёх элементов данного периода определяется количеством электронов на третьем электронном уровне, в данном случае на 3s3p.
Валентность натрия равна единице, так
как на внешнем электронном уровне у
него имеется лишь один 3s1
электрон, при этом натрий может только
отдавать свой единственный электрон. Магний,
имеющий на валентном электронном уровне
3s23p0
два спаренных электрона формально
должен иметь нулевую валентность, но у
него есть вакантная 3p0-подуровень,
на который может переходить один из 3s2
электронов, при этом магний проявляет
валентность равную двум, т.е. он может
относительно легко отдавать эти два
электрона. Алюминий на внешнем валентном
уровне имеет три электрона 3s2
3p1,
при возбуждении
один из 3s2
электронов переходит на 3p-подуровень,
при этом электронное строение валентного
электронного уровня становится 3s13p2
или
![]() ,
при этом согласно правилу Гунда все три
электрона будут иметь одинаковые спины:
+1/2 или -1/2. Эффективный атомный радиус
алюминия достаточно мал и он легко при
взаимодействии с атомами других
элементов, у которых большие величины
сродства к электрону и потенциала
ионизации, будет отдавать эти электроны,
проявляя при этом валентность равную
трём. Заметим, что во всех своих соединениях
данные элементы проявляют степень
окисления +3.
,
при этом согласно правилу Гунда все три
электрона будут иметь одинаковые спины:
+1/2 или -1/2. Эффективный атомный радиус
алюминия достаточно мал и он легко при
взаимодействии с атомами других
элементов, у которых большие величины
сродства к электрону и потенциала
ионизации, будет отдавать эти электроны,
проявляя при этом валентность равную
трём. Заметим, что во всех своих соединениях
данные элементы проявляют степень
окисления +3.
Строение валентного электронного слоя атома кремния в основном
состоянии
следующие
![]() ,
но кремний в своих соединениях проявляет
валентность равную четырем. Следовательно,
валентные электроны атома кремния легко
возбуждаются, образуя при этом следующие
электронное строение валентного уровня;
,
но кремний в своих соединениях проявляет
валентность равную четырем. Следовательно,
валентные электроны атома кремния легко
возбуждаются, образуя при этом следующие
электронное строение валентного уровня;
![]() .
.
Обратите внимание на то, что спины электронов при этом имеют одинаковый знак (правило Гунда).
На внешнем электронном уровне атома фосфора находятся 5 электронов, электронное строения внешнего валентного электронного уровня атома фосфора в основном состоянии следующее:
![]() ,
,
но у элементов 5 – го периода имеется вакантный 3d-подуровень с пятью d- орбаталями, поэтому в возбуждённом состоянии строение валентного уровня атома фосфора будет иметь следующий вид:

Фосфор в основном электронном состоянии в зависимости от величины сродства к электрону или потенциала ионизации атома другого элемента, с которым фосфор вступает в реакцию, может проявлять валентность 3(степени окисления +3 или -3). В возбуждённом электронном состоянии фосфор проявляет валентность 5.
Сера – элемент 6-й группы 3-го периода в основном состоянии имеет следующее строение внешнего электронного уровня:

и два различных возбуждённых состояний:
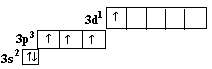 и
и

В своих соединениях сера может проявлять валентности 2, 4 и 6, что и наблюдается в природе (сульфиды и сероводород соли сернистой и серной кислот).
Хлор является элементом седьмой группы третьего периода. Следовательно, на его внешнем электронном уровне находятся семь электронов. Электронное строение этого слоя в основном состоянии следующее:
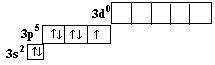
Кроме того, для внешнего электронного слоя атома хлора возможны ещё три следующих возбуждённых состояний:
 ,
,
 и
и
 .
.
В соответствие с выше сказанным, для соединений хлора характерны следующие степени окисления: -1 (хлориды - HCl, NaCl), +1 (соли хлорноватистой кислоты, гипохлориты - NaOCl), +3 (хлориты –KClO2), +5 ( хлораты – КСlO3) и +7 (перхлораты - КClO4).
Третий период заканчивается инертным газом аргоном. Внешний электронный слой аргона, так же как и внутренние энергетические оболочки, заполнена полностью, у него очень невелик эффективный атомный радиус, очень высокий первый потенциал ионизации и очень низкое сродство к электрону, Для аргона неизвестны соединения и его валентность равна нулю.
Пример 2
Какие значения может принимать главное квантовое число n? При каких значениях n энергия связи электрона с ядром наибольшая и наименьшая? При каких значениях n электрон обладает наибольшей и наименьшей энергией?
Решение
Главное квантовое число n может принимать целочисленные значения от 1 до ∞. Энергия электрона с ростом значения n возрастает, минимальное значение имеет электрон с квантовым числом n = 1. Энергия взаимодействия электрона с положительно заряженным ядром уменьшается с ростом значения n по следующим двум причинам:
с ростом n увеличивается расстояние между электроном и ядром, а согласно закона Кулона сила взаимодействия двух точечных зарядов обратно пропорциональна квадрату расстояния между ними.
увеличение количества электронных слоев (с ростом n) экранирование положительно заряженного ядра возрастает.
Пример 3
Воспользовавшись правилом Клечковского, предскажите энергетический уровень, на который поступает электрон, добавляемый к электронным структурам следующих элементов Ca, Zn, Si, Ti . Изобразите схемами электронные структуры.
Решение:
Элемент Са с порядковым номером 20 находится в четвертом периоде во второй группе главной подгруппы. У данного элемента имеется двадцать электронов, восемнадцать из которых имеют конфигурацию инертного элемента третьей группы аргона:
1s22s22p63s23p63d 0 Начиная с калия и заканчивая кальцием, идет заполнение идёт заполнение4s-орбитали, но не3d, так как в этом случае энергия электрона минимальна. Действительно, так как энергия электронов E зависит от суммы n+l и Е = min при n+l =min¸а при равных значениях n+l энергия электрона минимальна при минимальном значении n, то для К равно как и для Са есть два варианта размещения девятнадцатого и двадцатого электронов:
заполнение 3d – орбитали. В таком случае n =3,а l =2 и Е = n+l =5
эаполнение4s-орбитали. n =4,а l =0 и Е = n+l =4
Видно, что для второго варианта энергия электрона меньше и происходит заполнение электронами 4s-орбитали.
Элемент цинл (Zn) имеет порядковый номер 30, расположен в 4-м периоде во второй группе побочной подгруппы. Относится к d -металлам. 30 электронов цинка имеют следующую электронную конфигурацию:
1s22s22p63s23p63d104s2.
Начиная со скандия и заканчивая цинком происходит заполнение d-, а не 4р – орбитали. Рассмотрим два варианта заполнения верхних орбиталей у родоначальника d-ряда скандия. Двадцать первый электрон у атома скандия может расположится либо
на 3 d- орбиталь (n =3, ℓ =2) и тогда Е1 =5, либо
на 4р-орбиталь (n = 4, ℓ = 1) и тогда Е2 =5, но для первого варианта n1< n2 и заполнение идет по первому варианту, так как согласно второго правила Клечковского Е1 < Е2.
Кремний Si является элементом 3-его периода 4-ой группы с порядковым номером 14. Эти 14 электронов размещены на трёх энергетических уровнях следующим образом: на энергетическом уровне с n = 1, ℓ = 0 находятся два s-электрона, на втором уровне с n = 2, ℓ = 0 и 1 находятся восемь электронров (2s2 и 2p6), оставшиеся четыре электрона расположены на третьем энергетическом уровне (n = 3, ℓ = 0, 1 и 2) 3s2 и 3p 2. В этом периоде до инертного элемента аргона происходит последовательное заполнение 3p-орбитали.
Титан (Ti) в периодической системе Д.И. Менделеева расположен в четвертом периоде четвёртой побочной группы за d-элементом скандием. К нему при помещении 22 –го электрона применяется второе правило Клечковского (см. рассуждения о цинке) и электрон помещается на 3d-орбиталь.
Пример 4
Определите валентное состояние и степень окисления кислорода в следующих соединениях: Na2O, Na2O2, CaO, BaO2 , К2O, CsO2.
Решение.
Во всех соединениях кислород двухвалентен; степень окисления в оксидах Na2O, CaO, К2O и CsO2 равна -2, а в пероксидах Na2O2 CsO2 и BaO2 равна -1. Это следует из следующего: все соединения являются оксидами и пероксидами металлов. Степень окисления металлов всегда имеет знак +, причем для шелочных металлов равна +1, а для щелочноземельных (Са и Ва) равна +2. Соединение должно быть электронейтральным, т.е. количество + должно равняться количеству (-). Отсюда и определяется степень окисления кислорода.
Пример 5
Как объяснить, почему при обычных условиях атом хлора в свободном состоянии не существует, а ион Cl- существует в свободном состоянии в растворе?
Решение
Ион хлора в растворе существует благодаря его сольватиции полярными молекулами растворителя. Вокруг каждого иона хлора образуется сольватная оболочка, которая термодинамически стабилизирует ион. При образовании ковалентной σ-связи между двумя атомами хлора происходит уменьшение энергии (сумма энергий двух атомных р-орбиталей меньше энергии одной МО, которая при этом образуется), поэтому существование атомов хлора при ну энергетически невыгодно.
Пример 6
Определите валентность элементов в следующих соединениях: KClO4, K2Cr2O7, KCrO4, Na2SO3, Na2SO4, KNO3.
Решение
В задаче приведены кислородсодержащие соли. Решение для всех солей однотипное. Кислород в большинстве соединений проявляет валентность -2, металлы во всех солях одновалентные (щелочные металла, их валентность равна +1). Молекула в целом должна быть электронейтральна. Тогда в соединении KClO4 валентность Cl
(-2) х 4 – (+1) = +7.
Валентность Cr в K2Cr2O7 вычисляется следующим образом:
[ (-2х7) – (2х +1) ] /2 = +6,
Валентность азота в KNO3 вычисляется по уравнению:
-2х3 +1 = +5
Аналогично определяют валентности Cr и S в KCrO4, Na2SO3, Na2SO4.
