
- •ОРГАНИЧЕСКАЯ
- •Рекомендуемая литература
- •Перечень пособий, методических указаний к проведению учебных занятий и самостоятельной работы студентов
- •Дополнительная литература
- •СТРУКТУРА КУРСА
- •Цель курса
- •ОРГАНИЧЕСКАЯ ХИМИЯ
- •Органическая химия – это химия соединений углерода
- •Основные этапы развития химии
- •ОСНОВЫ ТЕОРИИ СТРОЕНИЯ
- •Бутлеров Александр Михайлович (1828-1886)
- •Структурная теория А.М.Бутлерова
- •Структурная теория А.М.Бутлерова
- •Основные положения теории строения органических соединений (1861)
- •Структурные формулы
- •Объемные модели молекул
- •Объемные модели молекул
- •Функциональная группа
- •Формулы для описания органических веществ
- •Изомерия
- •Изомерия
- •Изомерия
- •Изомерия
- •Изомерия
- •Изомерия
- •Изомерия
- •Изомерия
- •Пространственная изомерия
- •Изомерия
- •Геометрическая изомерия
- •Изомерия
- •Изомерия
- •Изомерия
- •Изомерия
- •Оптическая изомерия
- •Оптическая изомерия
- •Оптическая изомерия
- •Гомология
- •Классификация органических соединений
- •Классификация органических соединений
- •По расположению атомов углерода в молекуле органические соединения делятся на:
- •Классификация органических соединений
- •Классификация органических соединений
- •Классификация органических соединений
- •Классификация органических соединений
- •Классификация органических соединений
- •Классификация органических соединений
- •Классификация органических соединений
- •Классификация органических соединений
- •Основы номенклатуры
- •Основы номенклатуры
- •Основы номенклатуры
- •Основы номенклатуры органических соединений
- •Основы номенклатуры органических
- •ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ОРГАНИЧЕСКОЙ ХИМИИ
- •Электронная структура атома углерода в органических соединениях
- •Электронная структура атома углерода в органических соединениях
- •Гибридизация атомных орбиталей
- •Гибридизация
- •Гибридизация
- •Типы связей
- •Ковалентная связь
- •Ковалентная связь
- •Ковалентная связь
- •Ковалентная связь может образовываться двумя способами: 1. каждая частица, участвующая в образовании связи,
- •Типы химической связи
- •Различные виды перекрывания орбиталей
- •Различные виды перекрывания орбиталей
- •Различные виды перекрывания орбиталей
- •Различные виды перекрывания орбиталей
- •Различные виды перекрывания орбиталей
- •Различные виды перекрывания орбиталей
- •Различные виды перекрывания орбиталей
- •Свойства ковалентных связей
- •Энергия связи – средняя энергия, которая необходима для гомолитического разрыва связи (энергия диссоциации).
- •Длина связи и энергия
- •Направленность ковалентной связи
- •Полярность
- •Полярность
- •Поляризуемость
- •Реакционная способность органических соединений
- •Реакционная способность органических соединений
- •Реакционная способность органических соединений
- •Реакционная способность органических соединений
- •Реакционная способность органических соединений
- •Реакционная способность органических соединений
- •Реакционная способность органических соединений
- •Реакционная способность органических соединений
- •Классификация органических реакций
- •Классификация органических реакций
- •Классификация органических реакций
- •Классификация органических реакций
- •Классификация органических реакций
- •Классификация органических реакций
- •Классификация органических реакций
- •Классификация органических реакций
- •Классификация органических реакций
- •Классификация органических реакций
- •Классификация органических реакций
- •Реагирующие органические частицы
- •Реагирующие органические частицы
- •Реагирующие органические частицы
- •Взаимное влияние атомов в молекуле
- •Взаимное влияние атомов в молекуле
- •Взаимное влияние атомов в молекуле
- •Взаимное влияние атомов в молекуле
- •Взаимное влияние атомов в молекуле
- •Взаимное влияние атомов в молекуле
- •Взаимное влияние атомов в молекуле
- •Взаимное влияние атомов в молекуле
- •Взаимное влияние атомов в молекуле
- •Взаимное влияние атомов в молекуле
- •Взаимное влияние атомов в молекуле
- •Взаимное влияние атомов в молекуле

Реакционная способность органических соединений
Элементарный акт реакции это процесс, в котором происходит разрыв одной и образование другой химической связи.
Реакционный центр это атом, у которого происходит разрыв или образование связей.
Механизм реакции это схема, в которой изображены элементарные акты реакции, показаны реакционные центры, исходные и конечные продукты.
Под этим термином подразумевается детальное описание превращения исходных соединений в продукты с 
возможно более подробным описанием состава, строения и  других характеристик промежуточных продуктов и переходных состояний.
других характеристик промежуточных продуктов и переходных состояний. 
81

Реакционная способность органических соединений
Присоединение О-нуклеофилов
|
|
O |
|
|
25 OC |
OR2 |
|
|
|
|
|
|||
R |
C +2HOR2 |
|
|
R |
C |
OR2 |
|
|
|
|
||||
|
|
R1 |
|
|
|
|
|
R1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
Кеталь |
|
|
|
|
|
||
|
Механизм |
|
|
+ .. |
|
|
|
|
|
|
|
|||
|
|
O |
H |
|
|
|
|
|
+ -H+ |
|
|
H+ |
||
|
|
+ |
|
OH |
+ .. |
|
|
OH |
H |
|
OH |
|
||
|
|
|
|
|
|
|
|
|||||||
R C |
|
|
|
|
|
|
|
|
|
|
2 |
|
||
|
|
R C |
|
HO R2 |
|
R C O |
R C OR |
|
||||||
|
OH2 |
R1 |
-H2O |
R1 |
|
.. |
|
R1 |
R2 |
-H+ |
R1 |
|
||
|
|
+ |
|
|
H O+ R2 |
OR2 |
||||||||
|
+ |
|
|
|
|
|
|
|
|
|
|
полукеталь |
|
|
R |
C |
OR |
|
R |
C |
OR |
HO |
R2 |
R C OR |
|
R C OR2 |
|||
|
|
2 |
|
|
|
2+ |
.. |
|
|
|||||
|
R1 |
|
|
|
R1 |
|
|
|
2 |
|
R1 |
|
||
|
|
|
|
|
|
|
R1 |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
кеталь |
||
82
Реакционная способность органических соединений
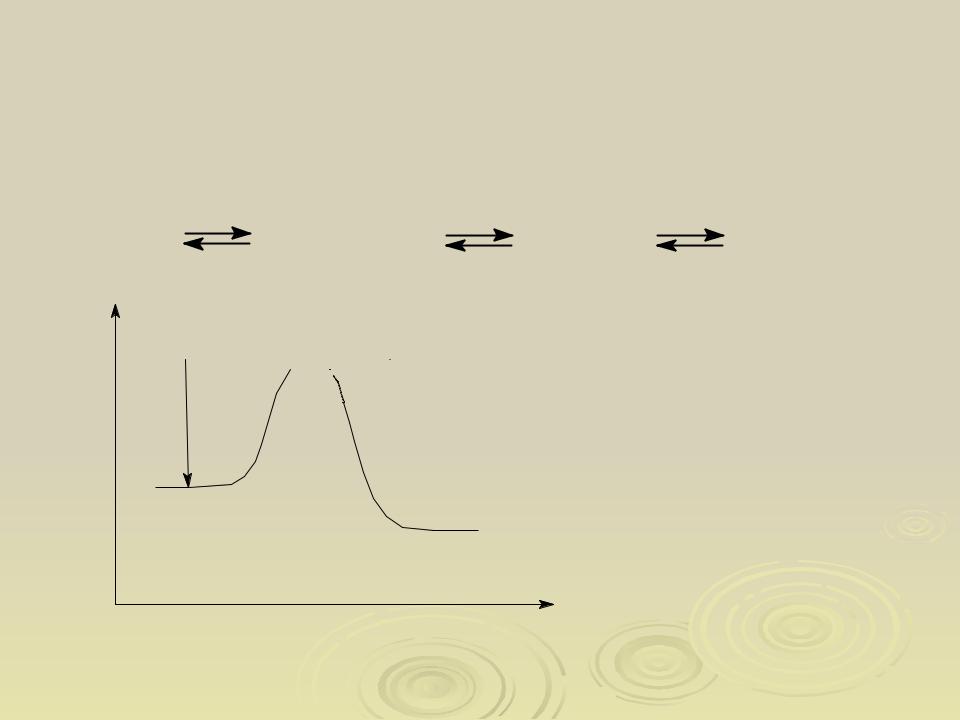
Энергия активации - это минимальная энергия, которой должна обладать молекула (атом, ион, радикал), чтобы преодолеть энергетический барьер реакции.
исходные |
активированные |
переходное |
продукты |
молекулы |
молекулы |
состояние |
реакции |
Энергия
переходное



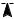






















 состояние
состояние
Ea
исходные вещества
продукты
реакции
Координата реакции
Координата |
|
реакции это |
|
траектория, |
|
которую |
|
описывает |
|
система в |
|
многомерном |
|
координатном |
|
пространстве с |
|
минимальным |
|
барьером |
|
активации в |
|
направлении |
|
максимального |
|
возрастания |
|
модуля градиента |
83 |
энергии системы |
|

Реакционная способность органических соединений |
||
Энергетическая диаграмма нитрования бензола |
||
|
п ерехо дн о е со сто ян ие |
|
|
NO2 |
|
|
+ |
H |
-K1 |
-K |
-К2 |
|
||
|
|
NO2 |
+ NO2+ |
|
+ H+ |
|
|
|
|
|
Координата реакции |
84
Реакционная способность органических соединений
E |
экзотермичесая реакция |
E |
эндотермичесая реакция |
H > 0
H < 0
кр |
кр |
85

Реакционная способность органических соединений
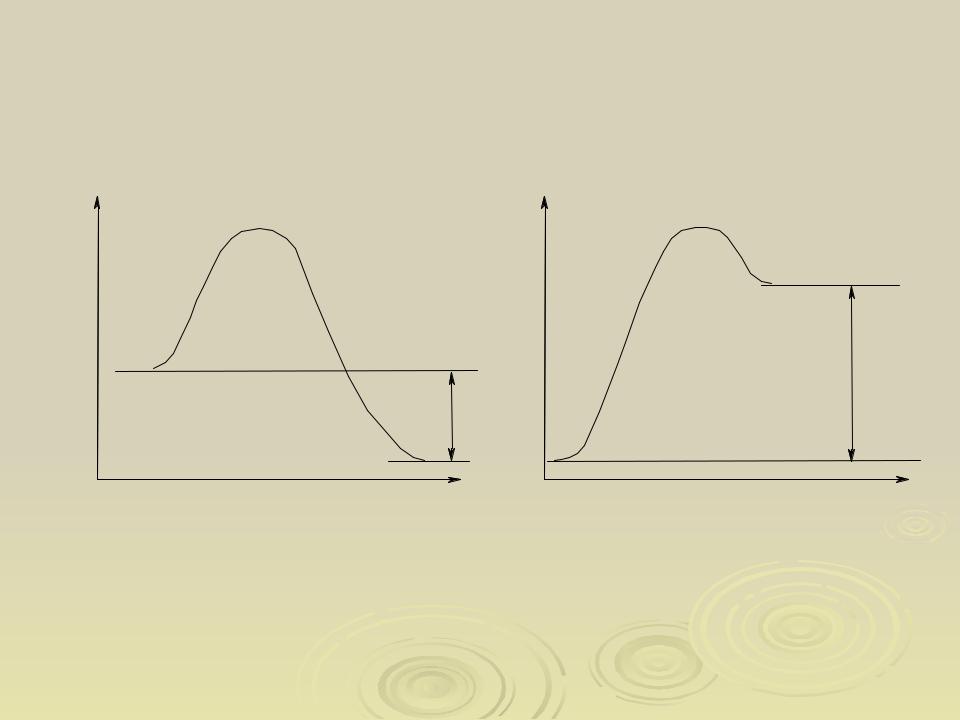
Протолитическая концепция кислот и оснований (Бренстед, Лоури,1923г.)
Кислоты это соединения, способные отщеплять (генерировать) протон. Основания - соединения, способные присоединять протон.
Процесс ионизации кислоты R H в растворителе Sol:
|
|
|
|
|
|
|
|
|
|
R + |
+ |
|
R |
|
H |
+ |
|
Sol |
|
|
|
|
|
HSol |
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
||||||
кислота |
протоно- |
сопряжен- |
сольвати- |
|||||||||
|
|
|
акцептор- |
ное осно- |
рованный |
|||||||
|
|
|
ный раст- |
вание |
протон |
|||||||
|
|
|
воритель |
|
|
|
(кислота) |
|||||
|
|
|
(основание) |
|
|
|
|
|||||
86

Реакционная способность органических соединений
Протолитическая концепция кислот и оснований (Бренстед, Лоури,1923г.)
Процесс ионизации основания в растворителе Sol:
:B + H Sol |
|
B H + Sol |
|
основание |
|
сопряженная |
|
|
кислота |
|
|
|
|
|
|
Кислоты характеризуются |
|
|
|
константой кислотности (K) или |
|
||
показателем кислотности (pKa): |
|
|
|
H+ |
R: |
pKa |
= lg Ka |
Ka = |
R H |
||
|
|
|
|
87
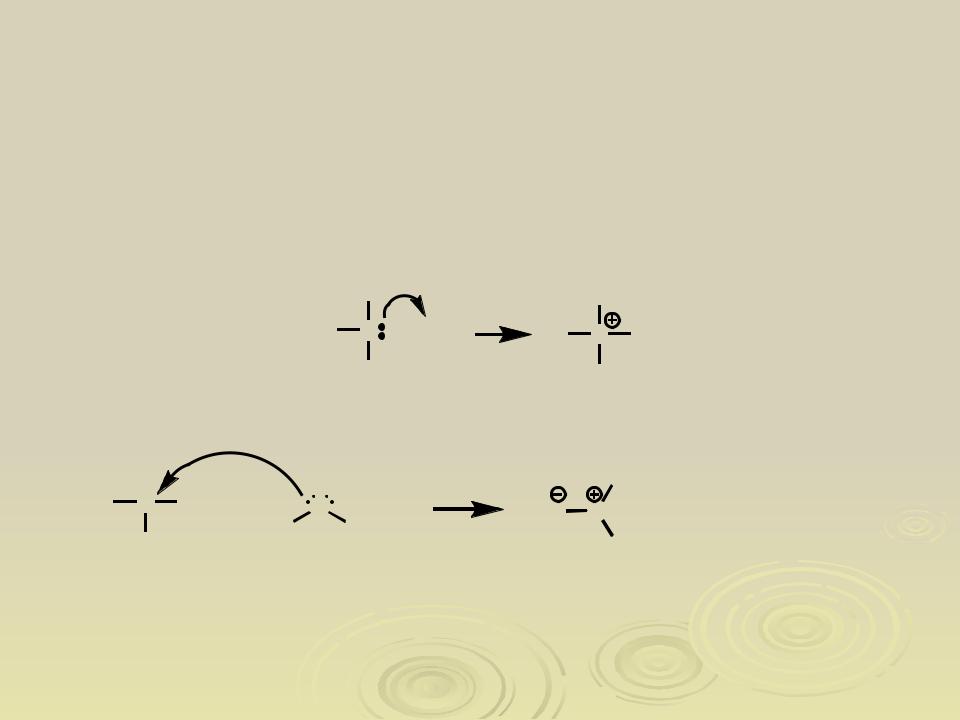
Реакционная способность органических соединений
Кислоты и основания Льюиса
Кислота Льюиса – молекула (атом), способная принять пару электронов Основание Льюиса – молекула (атом), способная отдать пару электронов Протон – кислота Льюиса
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
H |
|||||||||
аммиак - основание |
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
N H+ |
|
H |
|
|
N |
|
|
|
H |
|||||||||||||||
|
|
|||||||||||||||||||||||||
Льюиса |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
H |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ион аммония |
||||||||||||
F |
|
B |
|
F |
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
F3B |
O |
||||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
H3C |
CH3 |
|
||||||||||||||||||||||
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
F |
|
|
|
|
|
|
|
|
|
|
|
CH3 |
||||||||||||
|
|
|
основание |
|
|
|
|
|
|
|
|
|
|
|||||||||||||
кислота |
|
эфират трехфтористого бора |
||||||||||||||||||||||||
Льюиса |
|
Люиса |
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
88

Классификация органических реакций
Субстратом называют основное органическое вещество, участвующее в реакции, реагентом – вещество, с которым оно взаимодействует.
Обычно под реагентом подразумевается наиболее простое по строению вещество.
Часто органическую реакцию записывают не в виде уравнения, а в виде схемы. Это связано с тем, что в ходе реакции образуется не
только основное вещество, но и несколько побочных. В схеме |
|
указываются исходные вещества, главный продукт и условия ее |
|
проведения. Вместо знака равенства используют стрелку ( |
), |
указывающую направление превращения веществ. Над стрелкой  указывают условия проведения реакции (катализатор, давление,
указывают условия проведения реакции (катализатор, давление,  температуру, иногда реагенты), а под стрелкой со знаком минус – побочные вещества, выделяющиеся при реакции.
температуру, иногда реагенты), а под стрелкой со знаком минус – побочные вещества, выделяющиеся при реакции. 

89

Классификация органических реакций
За основу классификации принимают способ разрыва старых химических связей и образования новых. В этом случае органические реакции классифицируют по
характеру химических превращений или по механизму их протекания.
90
