
- •ОСОБЕННОСТИ СТРОЕНИЯ, РЕАКЦИОННОЙ СПОСОБНОСТИ И МЕТОДЫ СИНТЕЗА АЗОТСОДЕРЖАЩИХ СОЕДИНЕНИЙ
- •НИТРОСОЕДИНЕНИЯ
- •НИТРОСОЕДИНЕНИЯ
- •НИТРОСОЕДИНЕНИЯ
- •НИТРОСОЕДИНЕНИЯ
- •НИТРОСОЕДИНЕНИЯ
- •НИТРОСОЕДИНЕНИЯ
- •НИТРОСОЕДИНЕНИЯ
- •НИТРОСОЕДИНЕНИЯ
- •НИТРОСОЕДИНЕНИЯ
- •НИТРОСОЕДИНЕНИЯ
- •НИТРОСОЕДИНЕНИЯ
- •НИТРОСОЕДИНЕНИЯ
- •НИТРОСОЕДИНЕНИЯ
- •НИТРОСОЕДИНЕНИЯ
- •НИТРОСОЕДИНЕНИЯ
- •НИТРОСОЕДИНЕНИЯ
- •НИТРОСОЕДИНЕНИЯ
- •НИТРОСОЕДИНЕНИЯ
- •НИТРОСОЕДИНЕНИЯ
- •НИТРОСОЕДИНЕНИЯ
- •НИТРОСОЕДИНЕНИЯ
- •АМИНЫ
- •АМИНЫ
- •АМИНЫ
- •АМИНЫ
- •АМИНЫ
- •АМИНЫ
- •АМИНЫ
- •АМИНЫ
- •АМИНЫ
- •АМИНЫ
- •АМИНЫ
- •АМИНЫ
- •АМИНЫ
- •АМИНЫ
- •АМИНЫ
- •АМИНЫ
- •АМИНЫ
- •АМИНЫ
- •АМИНЫ
- •АМИНЫ
- •АМИНЫ
- •АМИНЫ
- •АМИНЫ
- •АМИНЫ
- •АМИНЫ
- •АМИНЫ
- •АМИНЫ
- •АМИНЫ
- •АМИНЫ
- •АМИНЫ
- •АМИНЫ
- •АМИНЫ
- •АМИНЫ
- •АМИНЫ
- •АМИНЫ
- •АМИНЫ
- •АМИНЫ
- •АМИНЫ
- •ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ
- •ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ
- •ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ
- •ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ
- •ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ
- •ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ
- •ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ
- •ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ
- •ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ
- •ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ
- •ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ
- •ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ
- •ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ
- •ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ
- •ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ
- •ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ
- •ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ
- •ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ
- •ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ
- •ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ
- •ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ
- •ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ
- •ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ
- •ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ
- •ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ
- •ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ
- •ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ
- •ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ
- •ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ
- •ДИАЗОСОЕДИНЕНИЯ. СОЛИ ДИАЗОНИЯ
НИТРОСОЕДИНЕНИЯ
Способы получения Замещение галогена на нитрогруппу в галогеналканах
Удобным лабораторным методом получения первичных нитроалканов является реакция нуклеофильного замещения галогена нитрит-ионом
R–X |
+ NaNO2 → R–NO2 + NaX |
||||
CH3CH2CH2Br + |
NaNO2 |
ДМФА |
CH3CH2CH2NO2 |
+ NaBr |
|
|
|||||
SN2 |
|||||
1-Бромпропан |
|
1-Нитропропан |
|
||
|
|
|
|||
ClCH2COOH |
NaOH |
ClCH3COONa |
NaNO2 |
O2NCH2COONa |
H3O + |
|
|
SN2 |
|
||||
Хлоруксусная |
|
|
|
|
|
|
кислота |
|
|
|
|
|
|
O2N |
CH2 |
COO H |
100 oC |
CH3NO2 |
|
|
- CO2 |
|
|
||||
|
|
|
Нитрометан |
|
||
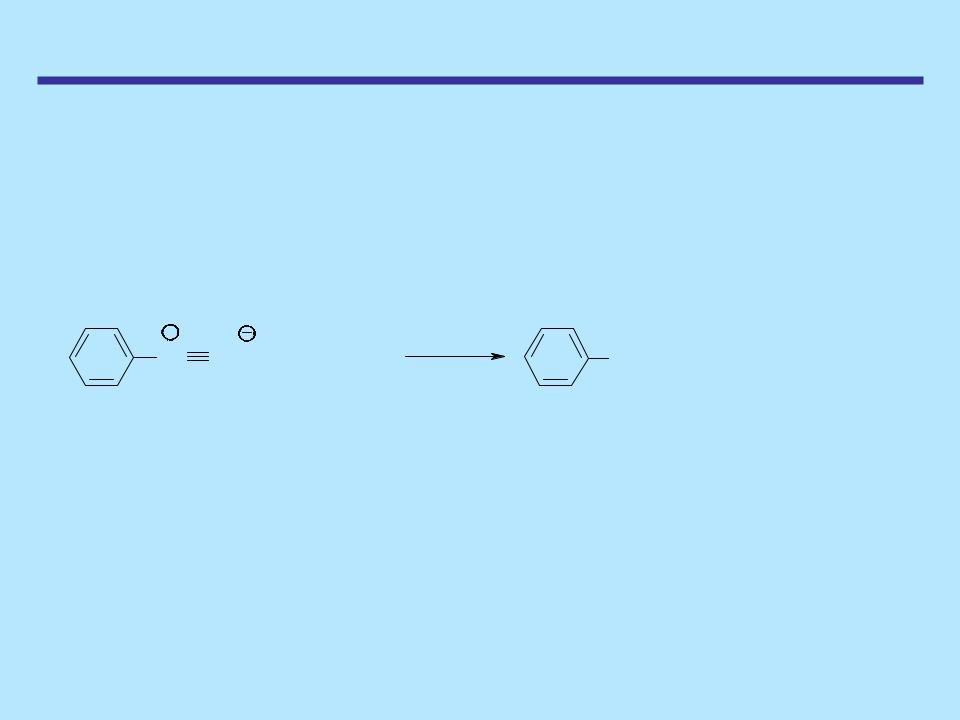
НИТРОСОЕДИНЕНИЯ
Способы получения Синтез с использованием солей диазония
Нитроарены можно получить реакцией соли диазония с нитритом натрия и солью одновалентной меди Cu+ (реакция Зандмейера)
+ |
CuNO2 |
NO2 |
+ NaCl + N2 |
N N Cl + NaNO2 |
|

АМИНЫ
Амины – производные аммиака NH3. В соответствии с
числом алкильных или арильных групп, связанных с азотом, различают
первичные R–NH2, ArNH2; вторичные R1–NH–R2, R–NH–Ar; третичные амины
R1 N Ar , R1 N R2
R3 R3

АМИНЫ
.В зависимости от природы углеводородных заместителей
амины бывают алифатические, ароматические и алкилароматические
Ñ Í |
|
NH |
|
|
|
Ñ2Í 5NHCH3 |
Í 3C |
N |
|
CH(CH ) |
|
|
|
NH2 |
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
2 |
5 |
2 |
|
|
|
|
|
|
|
|
|
|
|
Í |
3C |
3 |
2 |
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Этилам ин |
|
|
|
|
Ì |
|
етилэтилам ин |
Изо п ро п илдим етилам ин |
Цикло п ен тилам ин |
|||||||||||||||||||||||||||
(п ервичн ы й ам ин |
) |
|
(âò î ðè÷í û é àì èí |
) |
(ò ðåò è÷í û é àì èí ) |
(п ервичн ы й ам ин ) |
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
NH2 |
|
|
|
|
NH |
|
|
CH3 |
|
|
|
|
|
|
|
|
NH2 |
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Анилин |
|
|
|
|
|
|
|
|
-Нафтиламин |
|
|
|
|
|
||||||||||||||||||||||
|
Фенил(п-толил)амин |
|
|
|
|
|
|
|||||||||||||||||||||||||||||
(первичный амин ) |
|
|
(вторичный амин ) |
|
(первичный амин ) |
|
|
|
|
|
||||||||||||||||||||||||||
H2N |
|
|
|
|
|
|
|
|
NH2 |
|
|
|
|
|
|
NHСН3 |
|
|
|
|
|
|
|
|
|
|
N(СН3)2 |
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
п-Фенилендиамин |
|
|
N-Метиланилин |
|
|
-Диметил- -нафтиламин |
||||||||||||||||||||||||||||||
( двупервичный диамин) |
|
(вторичный амин ) |
|
|
|
|
|
(третичный амин ) |
|
|
|
|
||||||||||||||||||||||||
АМИНЫ
Строение и физические свойства
В молекуле аммиака атом азота находится в sp3-гибридном состоянии. Три гибридные орбитали перекрываются с s-орбиталями атомов водорода, образуя -связи, четвертая содержит неподеленную пару
электронов
.. 2e
H
H
107 o H
Поскольку амины – производные аммиака, в которых один или более атомов водорода замещены на алкильные группы, то можно предположить, что они имеют аналогичное строение
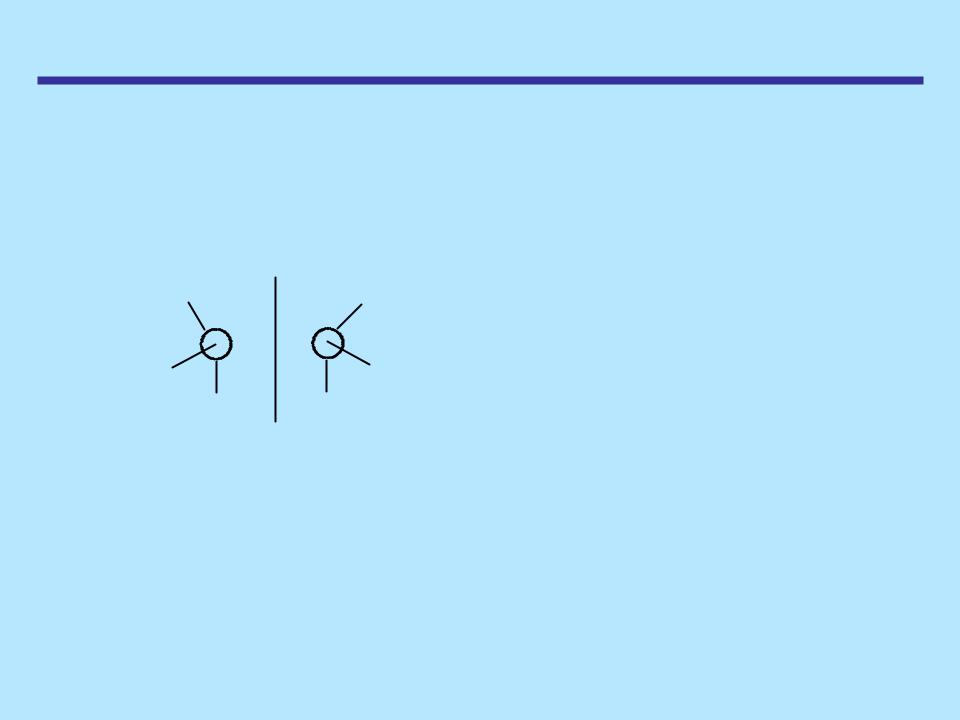
АМИНЫ
Строение и физические свойства
Если аммиак связан с тремя разными группами, то молекула не может быть совмещена с другой, являющейся ее зеркальным изображением, следовательно, она хиральна
CH3 |
CH3 |
С2Н5 |
С2Н5 |
н-C3H7 |
н-C3H7 |
- два энантиомера, каждый проявляет оптическую активность
Однако эти энантиомеры никогда не были обнаружены. Энергетический барьер для превращения одной пирамидальной конфигурации в другую составляет всего 25 кДж/моль

АМИНЫ
Строение и физические свойства
Простейшие алифатические амины – метиламин, диметиламин и триметиламин – газы, хорошо растворимые в воде и обладающие аммиачным запахом. Остальные низшие амины – жидкости с запахом аммиака. Более сложные амины – жидкости с неприятным запахом рыбы. Высшие амины – твердые, не растворимые в воде вещества, лишенные запаха.
При равном числе атомов углерода наиболее высокая температура кипения у первичных аминов, несколько ниже у вторичных и третичных. Ароматические амины – жидкости или твердые тела с характерным
неприятным запахом, сильно токсичны. В воде растворяются мало, накопление аминогрупп ведет к увеличению растворимости

АМИНЫ
Химические свойства
Многие химические свойства аминов обусловлены стремлением аминов обобществить неподеленную пару электронов азота с протоном, благодаря чему они являются основаниями, либо с электронодефицитным атомом другой молекулы, что определяет их способность выступать в качестве нуклеофильных реагентов

АМИНЫ
Основность
Образование солей аммония при действии водных растворов минеральных кислот свидетельствует о том, что амины – более сильные основания, чем Н2О
|
+ |
+ |
|
RNH2 |
+ H3O |
RNH3 |
+ H2O |
более сильное |
|
более слабое |
|
основание |
|
|
основание |

АМИНЫ
Основность
Амины вытесняются из солей аммония при действии гидроксид- иона, т.е. амины более слабые основания, чем гидроксид-ион
+ |
|
|
RNH3 |
+ OH |
RNH2 + H2O |
|
более сильное |
более слабое |
|
основание |
основание |
Основность убывает в ряду ОН > RNH2 > H2O
