
- •Простые эфиры
- •Простые эфиры
- •Простые эфиры
- •Простые эфиры
- •Простые эфиры
- •Простые эфиры
- •Простые эфиры
- •Простые эфиры
- •Простые эфиры
- •Простые эфиры
- •Простые эфиры
- •Простые эфиры
- •Простые эфиры
- •Простые эфиры
- •Простые эфиры
- •Простые эфиры
- •Простые эфиры
- •Циклические простые эфиры
- •Циклические простые эфиры
- •Циклические простые эфиры
- •Циклические простые эфиры
- •Циклические простые эфиры
- •Циклические простые эфиры
- •Циклические простые эфиры
- •Циклические простые эфиры
- •Циклические простые эфиры
- •Циклические простые эфиры
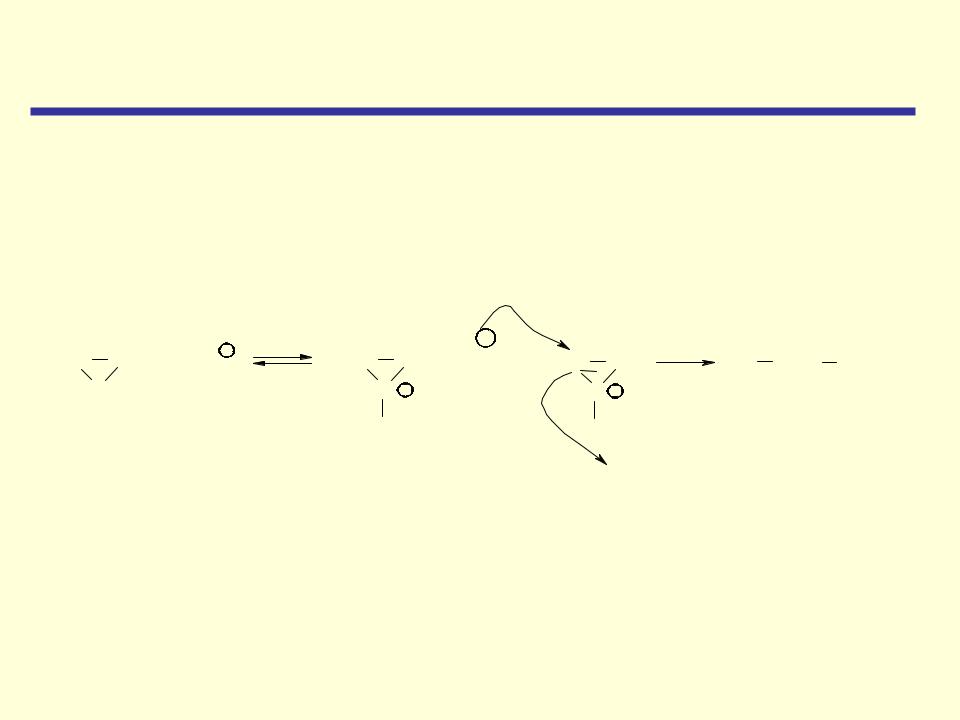
Циклические простые эфиры
Реакции, катализируемые кислотами
Оксираны в присутствии кислот превращаются в ионы оксония, которые вступают в реакции замещения с большим количеством нуклеофильных реагентов
..
H2C CH2 + H + |
H2C CH2 ; Nu |
H2C CH2 |
Nu CH2 CH2OH |
O |
O + |
O + |
|
|
Н |
Н |
|
Механизм этой реакции не отличается от ранее рассмотренных реакций нуклеофильного замещения (SN2) за исключением того, что уходящая
группа (кислород окисного кольца) является частью молекулы
21
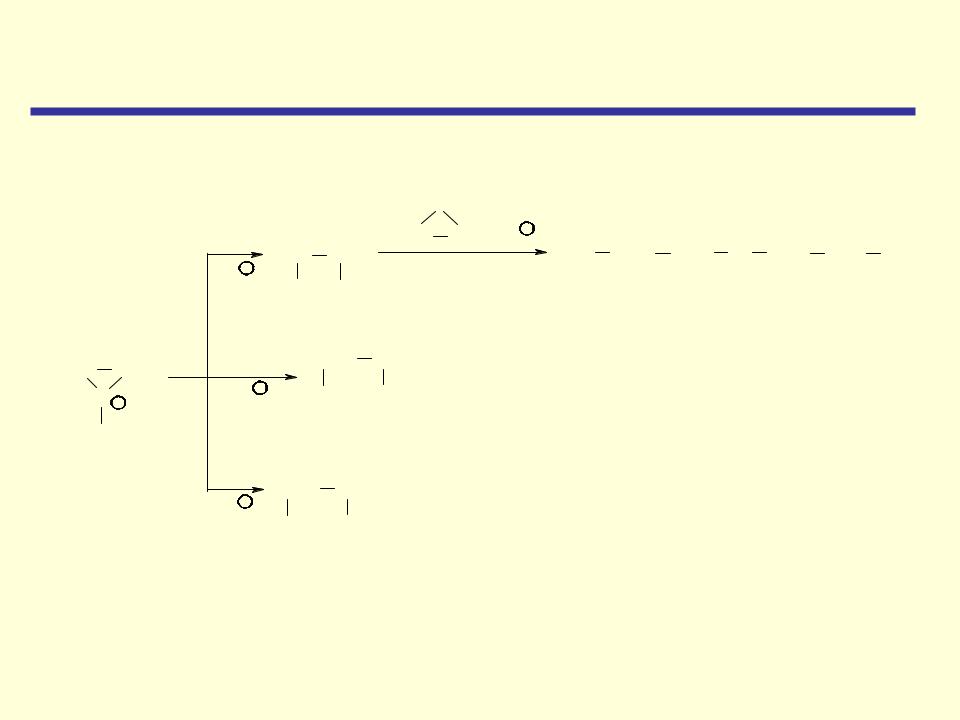
Циклические простые эфиры |
|
||||||||||||
Реакции, катализируемые кислотами |
|
|
|
|
|
||||||||
|
|
|
.. |
|
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
H2C |
CH2, H |
+ |
|
|
|
|
|
|
|
|
H2O |
H C |
CH |
HO CH |
CH2 |
O |
CH |
CH |
OH |
|||
|
|
-Í |
+ |
2 |
2 |
|
|
2 |
|
|
2 |
2 |
|
|
|
OH OH |
|
|
Диэтилен глико ль |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
Этилен глико ль |
|
|
|
|
|
|
|
||
|
SN2 |
|
.. |
|
CH2 |
CH2 |
|
|
|
|
|
|
|
H2C |
CH OH |
|
|
|
|
|
|
|
|||||
CH2 |
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
O + |
|
-Í + |
|
OCH |
OH |
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
етилцелло зо льв) |
|
|
|
|
|
|
Í |
|
|
|
2-Ì åòî êñè-1-ýòàí î ë (Ì |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HCl |
CH2 |
CH2 |
|
|
|
|
|
|
|
|
|
|
|
-Í |
+ |
|
|
|
|
|
|
|
|
||
|
|
Cl |
OH |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
Этилен хло ргидрин |
|
|
|
|
|
|
|
|||
22
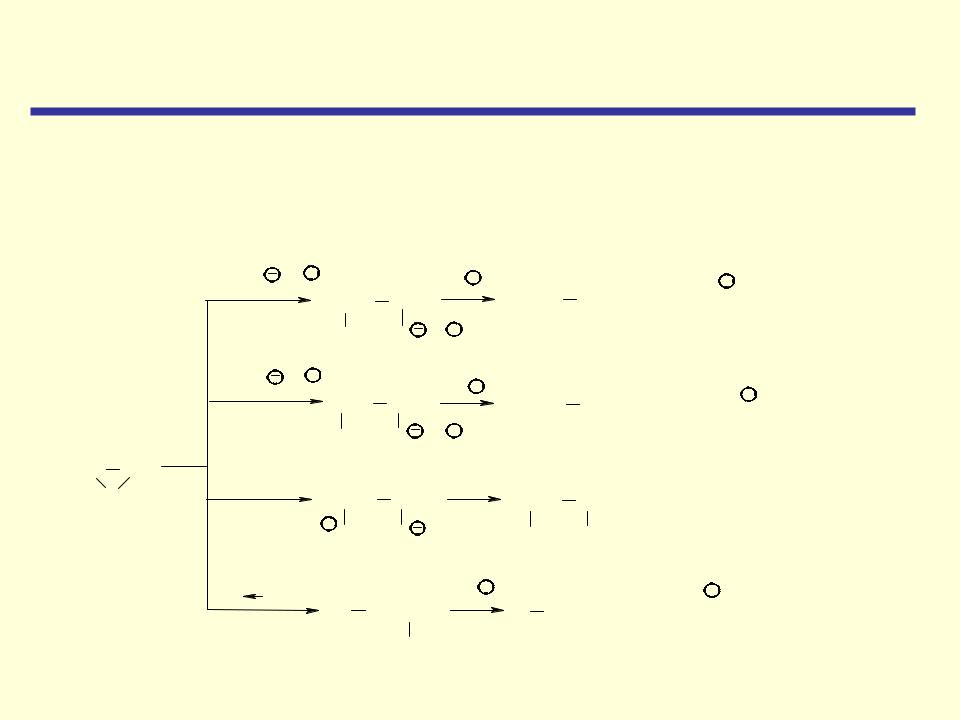
Циклические простые эфиры
Реакции раскрытия кольца непротонированной эпокиси
Более сильный нуклеофильный характер реагента компенсирует более низкую реакционную способность непротонированной эпокиси.
C6H5O |
Na |
+ |
|
|
|
|
|
Н |
+ |
|
|
|
|
+ |
||
|
CH2 |
CH2 |
|
|
C6H5O |
CH2CH2OH + |
Na |
|||||||||
|
|
|
|
|
|
|
|
|||||||||
|
|
C6H5O |
|
О |
Na+ |
|
|
|
2-Фенокси-1-этанол |
|
||||||
C2H5O |
Na+ |
CH2 |
CH2 |
Н + |
|
C2H5O |
|
CH2CH2OH + |
+ |
|||||||
|
|
|
|
|
|
|
|
|
Na |
|||||||
SN2 |
.. |
С2Н5О |
|
О |
Na + |
|
|
|
2-Этокси-1-этанол |
|
||||||
H2C CH2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
NH3 |
|
CH2 |
CH2 |
|
|
|
|
CH2 |
CH2 |
|
|||||
|
|
|
|
+ NH3 |
O |
|
|
|
|
|
NH2 |
OH |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
2-Амино-1-этанол |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
+ |
|
R |
MgX |
|
|
|
|
|
|
Н |
|
|
|
|||||
R |
CH |
CH |
|
|
R CH |
CH OH + MgX |
||||||||||
|
|
|
|
2 |
|
|
|
|||||||||
|
|
|
|
|
|
2 |
|
|
|
|
|
|
2 |
2 |
|
|
|
|
|
|
|
|
OMgX |
|
|
|
|
|
|
|
|||
23

Циклические простые эфиры
Четырехчленный циклический эфир – окись триметилэтилена (СН2)3О расщепляется труднее, чем
окись этилена. Тетрагидрофуран и 1, 4- диоксан представляет собой устойчивое соединение, которое часто используется в качестве растворителя
24

Циклические простые эфиры
Способы получения
1. Превращение галогенгидринов под действием оснований
Алкены реагируют с галогенами в присутствии воды с образованием галогенгидринов, при обработке которых щелочью образуется эпоксид.
|
Cl2, H2O |
|
|
Cl |
NaOH |
|
|
|
|
CH3CH = CH2 |
CH3 |
CH |
CH2 |
CH3 |
CH |
CH2 + NaCl + H2O |
|||
|
|
||||||||
|
|
|
O. |
|
|
|
|
O |
|
|
|
|
H |
|
|
Метилоксиран |
|||
|
|
|
|
|
|
|
|
||
25

Циклические простые эфиры
Способы получения
2. Окисление алкенов гидропероксидами (реакция Прилежаева)
Гидропероксиды карбоновых кислот (надкислоты) количественно превращают алкены в эпоксиды
|
|
|
|
|
|
O |
|
|
|
CH2 |
|
CH2 + C6H5COOH |
CH2 |
|
CH2 |
+ C6H5 |
|
C |
О |
|
|
|
|
||
|
|
|
|
|
|
|||||||
|
|
OH |
||||||||||
|
|
|
||||||||||
|
|
|
|
|
|
|
O |
|||||
|
|
|
|
|
|
|
||||||
|
|
|
Надбензойная кислота |
|||||||||
|
|
|
|
|
|
|||||||
26
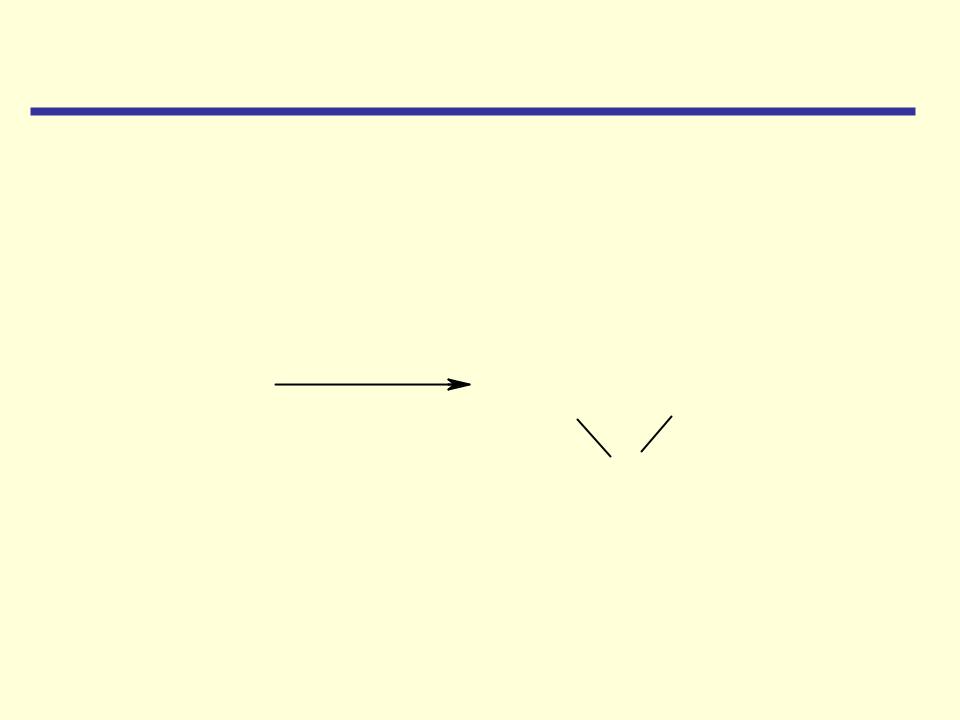
Циклические простые эфиры
Способы получения
3. Получение окиси этилена
|
O , Ag, 250 o |
|
CH2=CH2 |
2 |
|
CH2 |
- CH2 |
O
27
