
- •Простые эфиры
- •Простые эфиры
- •Простые эфиры
- •Простые эфиры
- •Простые эфиры
- •Простые эфиры
- •Простые эфиры
- •Простые эфиры
- •Простые эфиры
- •Простые эфиры
- •Простые эфиры
- •Простые эфиры
- •Простые эфиры
- •Простые эфиры
- •Простые эфиры
- •Простые эфиры
- •Простые эфиры
- •Циклические простые эфиры
- •Циклические простые эфиры
- •Циклические простые эфиры
- •Циклические простые эфиры
- •Циклические простые эфиры
- •Циклические простые эфиры
- •Циклические простые эфиры
- •Циклические простые эфиры
- •Циклические простые эфиры
- •Циклические простые эфиры
Простые эфиры
R–O–R R–O–Ar
H3C |
O |
|
CH3 |
CH2 |
CH2 |
||
H3C |
CH |
2 |
CH3 |
O |
|
||
 O
O
CH3

 O
O
 O
O
 O
O
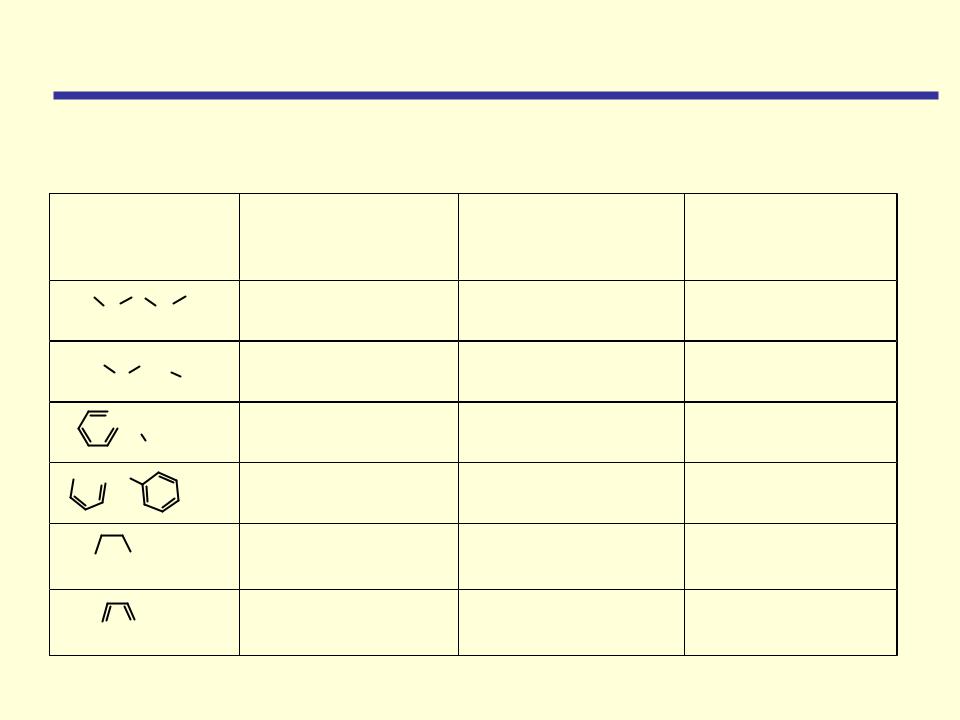
По строению углеводородных радикалов
Симметричный,
диалкиловый
Несимметричный,
диалкиловый
Несимметричный,
алкилариловый
Симметричный,
диариловый
Циклический,
алкиловый
Циклический,
ароматический
Тривиальная |
Номенклатура |
номенклатура |
IUPAC |
Диэтиловый эфир |
2-Этоксиэтан |
Метилэтиловый |
Метоксиэтан |
эфир |
|
Метилфениловый |
Метоксибензол |
эфир |
|
Дифениловый |
Феноксибензол |
эфир |
|
Тетрагидрофуран |
Тетрагидрофуран |
Фуран |
Оксациклопента- |
|
диен |
1

Простые эфиры
Низшие простые эфиры называют по радикально-функциональной
номенклатуре
СН3
С2Н5 |
|
О |
|
С2Н5, |
С6Н5 |
|
О |
|
С6Н5, |
СН3СН2 |
|
О |
|
СН=СН2, |
СН3 |
|
СН |
|
О |
|
СН3 |
|
|
|
|
|
|
|
|
|
|||||||||||||
Диэтиловый эфир |
Дифениловый эфир |
Винилэтиловый эфир |
Метилизопропиловый эфир |
||||||||||||||||||
Простые эфиры сложного строения рассматривают как алканы или арены, в которых атом водорода замещен алкоксидной группой – алкоксиалканы или алкоксиарены
СН3 |
|
СН |
|
СН2СН2СН3 |
|
|
ОС2Н5 |
|
|
|
|
ОСН3 |
||
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
ОСН3 |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
||||||
3-Метоксипентан |
Этоксициклогексан |
2-Метоксинафталин |
||||||||||||
Для некоторых ароматических эфиров часто применяют и тривиальные названия
|
ОСН3 |
ОС2Н5 |
|
|
|
|
|
|
Метоксибензол |
Этоксибензол |
2 |
(анизол) |
(фенетол) |

Простые эфиры
Физические свойства.
|
Т пл., ОС |
Т кип., ОС |
CH3OCH3 |
-138,5 |
-23,2 |
CH3CH2OH |
-117,3 |
64,7 |
CH3CH2OCH2CH3 |
-116,3 |
34,6 |
CH3CH2CH2CH2OH |
-89,5 |
117,7 |
3

Простые эфиры
Физические свойства
Простые эфиры являются бесцветными жидкостями (кроме диметилового эфира, который в нормальных условиях является газообразным) и имеют своеобразный запах.
Простые эфиры имеют более низкие температуры кипения, чем спирты, так как в эфирах отсутствуют межмолекулярные водородные связи. По той же причине простые эфиры (кроме диметилового эфира) плохо растворимы в воде.
Простые эфиры менее полярны, чем спирты, их дипольный момент составляет (4,0-4,3)∙10-30 Кл∙м.
4
Простые эфиры
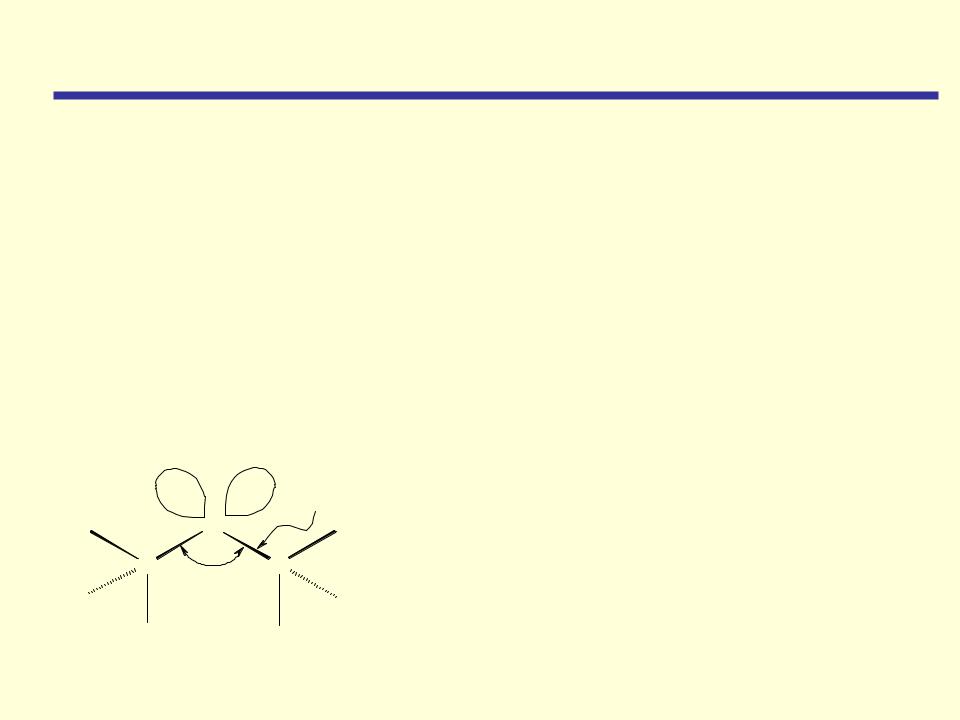
Химические свойства
Простые эфиры отличаются низкой реакционной способностью. Они устойчивы к действию сильных оснований, восстановителей и разбавленных кислот. В частности, эфиры не вступают в реакции с NaOH/Н2О, CH3MgI, Na, LiAlH4. Химическая инертность простых эфиров
обусловливает их широкое применение в качестве растворителей в химических реакциях.
Строение молекулы эфиров
.. |
.. |
|
Слабые основания |
|
Слабые нуклеофилы |
||
0,142 нм |
|
||
H |
O |
H |
1)Реакции у атома кислорода |
C |
111О C |
|
|
|
2)Реакции у -углеродного атома |
||
H |
|
H |
3)Реакции расщепления связи С-О |
H H
5

Простые эфиры
Основность
Простые эфиры являются довольно слабыми основаниями и плохими нуклеофилами. Простые эфиры взаимодействуют с концентрированной серной кислотой, превращаясь при низкой температуре в кристаллические оксониевые соли
.. |
|
.. |
|
|
|
+ |
|
C2H5OC2H5 + H2SO4 |
C2H5OC2H5 OSO2OH |
||
.. |
êî í ö. |
.. |
|
|
Í |
|
|
.. |
|
Гидро сульф ат диэтило ксо н ия |
|
|
.. |
|
|
.. |
|
+ |
|
|
.. |
|
|
C2H5OC2H5 |
+ HCl |
C2H5OC2H5 |
Cl |
|
ñóõî é |
Í |
|
|
|
|
|
Диэтило ксо н ийхло рид
6

Простые эфиры
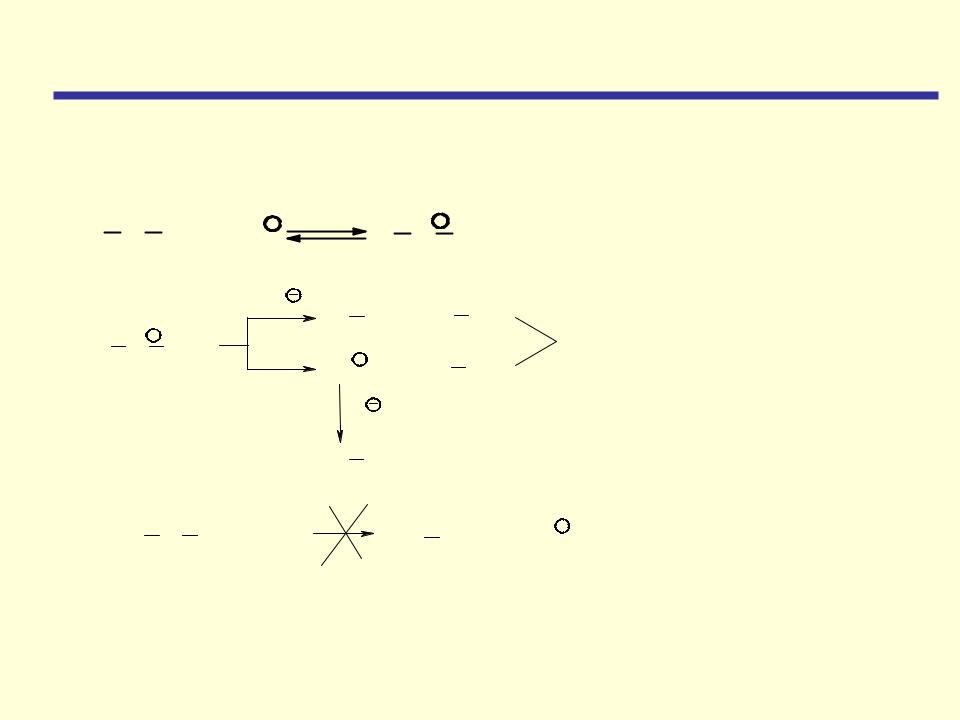
Расщепление галогеноводородными кислотами
Разрыв связи углерод-кислород происходит только в жестких условиях
– при нагревании с концентрированными галогеноводородными кислотами НХ:
HI > НВг > НСl
реакционная способность уменьшается
Условия реакции: Конц. HBr, HI; 120-150 OC
Реакция представляет собой нуклеофильное замещение в протониро- ванном эфире, более реакционноспособном, чем нейтральная молекула эфира (сравните с реакцией замещения в спиртах).
7
Простые эфиры
Расщепление галогеноводородными кислотами
.. |
|
|
|
H |
+ |
|
|
R |
|
+ H + |
.. |
R |
|
||
R O |
1 |
R O |
|
1 |
|||
.. |
|
|
|
|
|
H |
|
|
|
X |
.. |
+ |
R |
1 |
SN2 |
R O |
|
|
||
Протонирован- |
SN1 |
|||
ный эфир |
|
|||
R O R1 + X  Непротонирован-
Непротонирован-
ный эфир
R |
X + |
R1 |
OH |
Слабое основание, |
+ |
|
|
|
хорошая уходящая |
R1 |
+ |
R |
OH |
группа |
X |
|
|
|
|
R1 |
X |
|
|
|
|
R |
X |
+ |
R1O _ |
|
|
|
Сильное основание, |
|
|
|
|
плохая уходящая |
|
|
|
|
|
группа |
8

Простые эфиры
Расщепление галогеноводородными кислотами
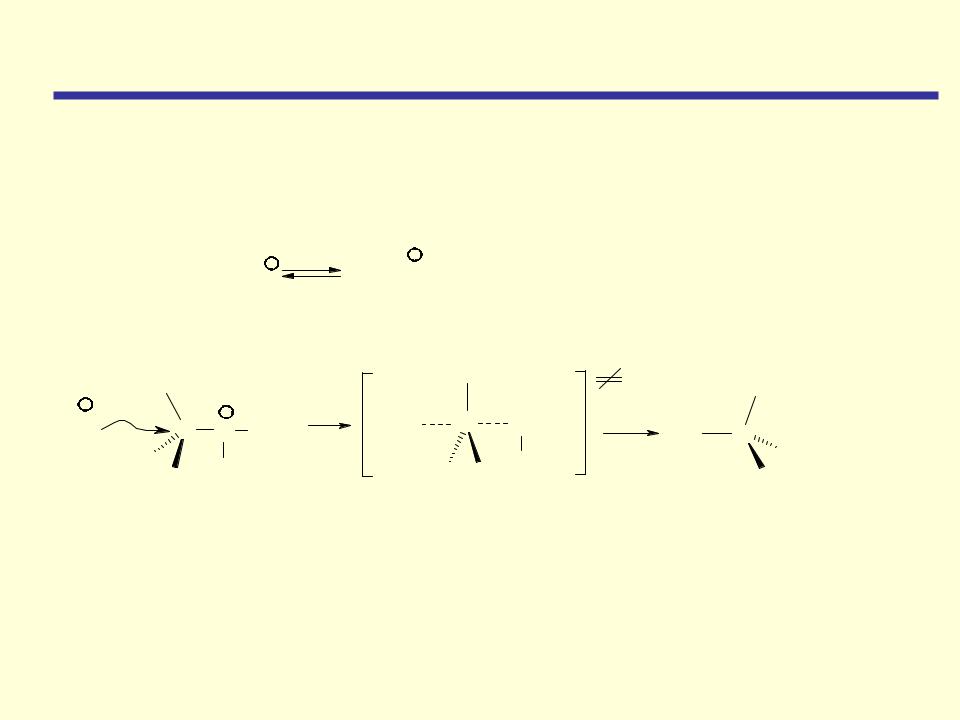
Реакция протекает по механизму SN1 или SN2 в зависимости от строения
алкильных групп. Реакции расщепления эфиров, содержащих первичные и вторичные алкильные группы, протекают по механизму SN2. Простые
эфиры, содержащие третичную алкильную группу, расщепляются преимущественно по механизму SN1.
Расщепление эфира может протекать и одновременно по двум механизмам - SN1 и SN2, что приводит к смеси двух алкилгалогенидов и
двух спиртов.
Расщепление арилалкиловых эфиров Ar-O-Alk всегда протекает только по связи ArO-Alk с образованием алкилгалогенида и фенола.
9
Простые эфиры
Расщепление галогеноводородными кислотами
Реакции бимолекулярного нуклеофильного замещения
C |
H |
.. |
|
H |
|
+ H + |
C |
H |
+ |
|
H |
|
|
|
|
|
|
OC |
5 |
OC |
5 |
|
|
|
|
||||||||||
6 |
5 |
|
2 |
|
|
|
6 |
|
5 .. |
2 |
|
|
|
|
|
||
Фенетол |
|
|
|
|
|
Н |
|
|
|
|
|
|
|
||||
|
|
ÑH3 |
|
|
|
|
|
|
|
|
CH3 |
|
|
|
ÑÍ 3 |
||
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|||||
.. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
O |
C H |
|
Br |
|
|
C OC2H5 |
|
|
+ Í Î C H |
|||
.Br |
|
|
|
|
|
|
|
Br |
C |
||||||||
.. . |
|
|
|
|
|
|
6 5 |
|
|
|
|
|
|
|
6 5 |
||
|
|
H |
H |
|
H |
|
|
|
|
H |
H |
H |
|
|
H |
||
|
|
|
|
|
|
|
|
|
|
|
|
H |
|||||
|
|
|
|
|
|
|
|
П ерехо дн о е со сто ян ие |
|
|
|
||||||
10
