
- •Введение
- •1 Получение карбонильных соединений каталитическим дегидрированием спиртов
- •3.1 Теоретические основы процесса дегидрирования спиртов
- •2 Экспериментальная часть
- •2.1 Характеристика сырья и материалов
- •2.2 Проведение контактирования
- •3 Методики анализов
- •3.1 Определение спиртов методом ацетилирования
- •3.2 Потенциометрический метод титрования. Определение карбонильных соединений на основе реакции оксимирования
- •3.2.1 Теоретические основы метода
- •3.2.2 Ход анализа
- •3.3 Определение сложных эфиров методом омыления
- •4 Материальный баланс процесса дегидрирования н-бутилового спирта
- •5 Расчёт безразмерных характеристик процесса дегидрирования н‑бутилового спирта. Результаты и их обсуждение
- •1 − Трехгорлая колба (реактор); 2 − штатив; 3 − водяная баня;
- •4 − Мешалка; 5 − термометр; 6 − электродвигатель;
- •7 − Обратный холодильник;
- •3.2.4 Расчёт количества зубчиков для подачи н-бутилового спирта на микродозаторе Галкина
3 Методики анализов
Катализат анализируется:
на содержание непрореагировавшего спирта ацетилированием в безводном пиридине;
на содержание карбонильных соединений методом потенциометрического титрования;
на содержание сложных эфиров методом омыления.
3.1 Определение спиртов методом ацетилирования
Метод основан на ацетилировании спиртов избытком уксусного ангидрида в присутствии безводного пиридина [1], омылении избытка ангидрида водой в соответствующую кислоту и титровании последней щелочью:
CH3-CH(CH3)-CH2OH
+ CH3CO-O-OCCH3

 CH3COOCH2CH(CH3)2
+ CH3COOH
(6)
CH3COOCH2CH(CH3)2
+ CH3COOH
(6)
CH3CO-O-OCCH3 + H2O → CH3COONa + H2O (7)
Ацетилирующая смесь готовится смешением 10 мл свежеперегнанного уксусного ангидрида, 30 мл безводного пиридина и 0,9 мл хлорной кислоты в бюксе. Хлорную кислоту приливают осторожно по каплям. Смесь готовят перед применением в работе.
В колбе с пришлифованной пробкой вместимостью 100 мл взвешивают на аналитических весах анализируемое вещество массой 0,5-0,6 г с погрешностью до 0,0002 г. К пробе пипеткой приливают 5 мл ацетилирующей смеси. Колбу плотно закрывают пробкой и содержимое энергично встряхивают на качалке в течение одного часа, затем приливают 5 мл дистиллированной воды и встряхивают еще 15 мин.
Образующуюся уксусную кислоту оттитровывают раствором КОН с концентрацией с = 0,5 моль/л в присутствии фенолфталеина до устойчивого (в течение 30 с) розового окрашивания. Анализ дублируется. Холостой опыт для определения начальной массовой доли уксусной кислоты проводят по аналитической методике параллельно с основным определением, но без добавки анализируемой смеси.
Далее расчет массовой доли спирта в анализируемой смеси ведется по формуле [1]:
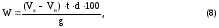
где W − массовая доля спирта в анализируемой смеси, %;
Va − объем раствора с(КОН) = 0,5 моль/дм3, пошедший на титрование холостой пробы, см3;
Vв − объем раствора с(КОН) = 0,5 моль/дм3, пошедший на титрование анализируемой пробы, см3;
t − титр раствора с(КОН) = 0,5 моль/дм3;
d − масса спирта, соответствующая 1 см3 раствора с(КОН) = 0,5 моль/дм3, г/см3.

где Мсп − молярная масса спирта, г/моль;
Z* − число эквивалентности.
Рассчитаем по формуле (3) массу спирта, соответствующую 1 см3 раствора с(КОН) = 0,5 моль/дм3, зная что число эквивалентности для KOH равно 1:
 г/см3.
г/см3.
Теперь рассчитываем массовую долю спирта в анализируемой смеси по формуле (3):
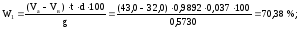
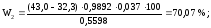
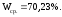
Таким образом, содержание непрореагировавшего спирта в катализате 70,23 %.
3.2 Потенциометрический метод титрования. Определение карбонильных соединений на основе реакции оксимирования
3.2.1 Теоретические основы метода
Определение карбонильных соединений солями гидроксиламина NH2OH∙HC1, (NH2OH)2∙H2SO4 является наиболее общим методом количественного анализа как альдегидов, так и кетонов. Метод основан на реакции
H
H


NH2OH∙HC1 + C=O → C=NOH + HC1 + H2O (10)


СН3СН2СН2
СН2СН2СН3
Альдоксим
Выделяющаяся кислота оттитровывается щелочью в присутствии индикатора бромфенолблау или потенциометрически.
HC1 + NaOH → NaCl + Н2O (11)
Часто полученные в результате работы реакционные смеси содержат продукты, которые мешают правильно заметить изменение цвета индикатора при визуальном титровании. В этом случае применяется потенциометрический метод титрования для определения конца титрования.
Потенциометрический метод титрования основан на измерении потенциала электрода, погруженного в раствор. Значение потенциала зависит от концентрации соответствующих ионов в растворе (в данном случае ионов водорода).
Электрод, по потенциалу которого судят о концентрации определяемых ионов в растворе, называется индикаторным электродом.
Потенциал индикаторного электрода определяют сравнением с потенциалом другого электрода, называемого электродом сравнения, в качестве которого может быть применен такой электрод, где значение потенциала остается неизменным при изменении концентрации определяемых ионов. Таким электродом является хлорсеребряный электрод.
Зависимость потенциала индикаторного электрода от концентрации раствора используется для определения эквивалентной точки при титровании.
В эквивалентной точке, когда концентрация определяемого иона сильно уменьшается и становится практически равной нулю, происходит резкое уменьшение потенциала, регистрируемое чувствительным милливольтметром прибора рН-340.
