
2. Гидроксиды
Все гидроксиды, или их ещё называют гидраты оксидов, подразделяют на три группы:
А) гидраты кислотных оксидов, называемые кислотами;
В) гидраты основных оксидов, называемые основаниями;
С) гидраты амфотерных оксидов, называемые амфотерными гидроксидами.
А. Кислоты
Кислоты - сложные химические соединения, состоящие из ионов водорода, способных замещаться ионами металла, и кислотных остатков.
По числу ионов водорода кислоты делят на одноосновные: HСl, HNO3; двухосновные: H2SO4, H2CO3 и многоосновные: H3PO4, H3AsO4.
Названия некоторых кислот приведены в таблице №1.
Химические свойства кислот
1. Кислоты реагируют с основными оксидами с образованием соли и воды:
2HCl+MgO = MgCl2+H2O.
2. Кислоты взаимодействуют с основаниями с образованием соли и воды (реакция нейтрализации):
H2SO4+Cu(OH)2 = CuSO4+2H2O.
3. Кислоты вступают в реакции с солями, если в результате реакции образуется более слабая кислота, малорастворимое или летучее соединение:
HCl+CH3COONa = NaCl+CH3COOH,
HCl - сильная кислота, CH3COOH - слабая кислота.
H2SO4+Ba(NO3)2 = BaSO4+2HNO3;
 CO2
CO2
2HCl+K2CO3 = 2KCl +H2CO3 H2O
4. Кислоты реагируют с амфотерными гидроксидами (оксидами) с образованием соли и воды:
2HCl+Zn(OH)2 = ZnCl2+2H2O.
5. Кислоты взаимодействуют с металлами.
Эти свойства специфичны для различных кислот, поэтому мы их не рассматриваем.
В. Основания
Основаниями называют сложные вещества, состоящие из иона металла или аммония (NH4)+ и одной или нескольких гидроксогрупп - (OH)-. Например, Fe(OH)3; NaOH; Ba(OH)2.
По растворимости в воде основания делятся на растворимые (щёлочи) и нерастворимые. Растворяются в воде основания щелочных и щелочноземельных металлов и гидроксид аммония.
Названия оснований составляют из слова "гидроксид" и названия металла. Например: KOH - гидроксид калия, Ca(OH)2 - гидроксид кальция. Если элемент образует несколько оснований, то в названиях указывается степень его окисления римской цифрой в скобках: Cr(OH)2 - гидроксид хрома(II), Cr(OH)3 - гидроксид хрома (III).
Химические свойства оснований
1. Основания взаимодействуют с кислотами с образованием соли и воды (реакция нейтрализации):
2KOH+H2SO4 = K2SO4+2H2O;
Mn(OH)2+2HCl = MnCl2+2H2O.
2. Щёлочи взаимодействуют с солями, если после реакции образуются труднорастворимые или слабые основания:
2NaOH+NiSO4 = Ni(OH)2+Na2SO4;
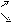 NH3
NH3
Ca(OH)2+2NH4Cl CaCl2 + NH4OH
H2O
3. Щёлочи реагируют с кислотными оксидами с образованием соли и воды:
Ca(OH)2+SO2 = CaSO3+H2O;
2NaOH+CO2 = Na2CO3+2H2O.
4. Щёлочи взаимодействуют с амфотерными основаниями с образованием соли:
NaOH+Al(OH)3 = Na[Al(OH)4].
С. Амфотерные основания
Амфотерными называются такие основания, которые взаимодействуют как с кислотами, так и со щелочами. Амфотерные основания (соответствуют амфотерным оксидам): Be(OH)2, Zn(OH)2, Sn(OH)2, Pb(OH)2, Al(OH)3, Cr(OH)3, и др.
