
Реферат на тему D-элементы
.docxМіністерство охорони здоров’я України
Запорізький державний медичний університет
Реферат
з медичної хімії
на тему:
«D-елементи»
Виконав:
Студент 1-го курсу 14 групи
1-го медичного факультету
Офіцеров Олег Дмитрович
Запоріжжя, 2011
Зміст
Загальна характеристика 3
Знаходження в природі та отримання 4
Хімічні властивості 4
Використання та біологічна роль 5
Список використаної літератури 6
D-елементи
Загальна характеристика
До d-елементів відносять ті елементи, атоми яких містять валентні електрони на (n - 1) d ns-рівнях і складають побічні (IIIВ-VIIв, IВ, IIВ) підгрупи, займаючи проміжне положення між типовими s-металами (IА, IIА) і p-елементами. 37 відносяться до d-елементів, з них останні 7 радіоактивні і входять в незавершений сьомий період. Електронна будова атомів d-елементів визначає їх хімічні властивості. 3d-Елементи за хімічними властивостями істотно відрізняються від 4d-та 5d-елементів. При цьому елементи IVВ-VIIв підгруп дуже схожі за багатьма хімічними властивостями. Ця схожість обумовлено лантаноідним стисненням, яке через монотонного зменшення радіусів при заповненні 4f-орбіталей призводить до практичного збігу радіусів цирконію і гафнію, ніобію і танталу, молібдену і вольфраму, технецію і ренію. Елементи цих пар дуже близькі за фізичними і особливо по хімічним властивостям; перші шість елементів зустрічаються в одних рудних родовищах, важко розділяються, їх іноді називають елементами-близнюками.
При утворенні хімічних зв'язків як валентних електронів виступають s-електрони зовнішнього рівня і частину або все d-електрони предзовнішньго рівня. Тому для d-елементів характерний великий набір ступенів окислення. Вища - № групи.
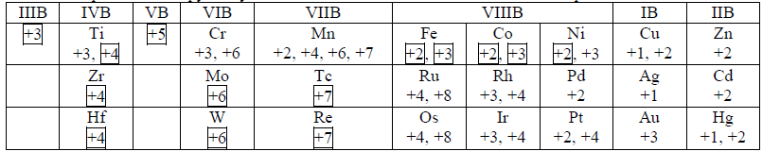
Валентні можливості d-елементів. Валентні електрони в атомів d-елементів перебувають на ns-і (n-1) d-орбіталях, тобто вони належать різним енергетичним рівнем. Це обумовлює особливості валентних можливостей атомів d-елементів. Для прикладу розглянемо 3d-елементи 4-го періоду. Для перших п'яти елементів вищий ступінь окислення дорівнює номеру їх групи. Для них стійкість сполук вищого рівня окислення збільшується із зростанням порядкового номера елемента. Для наступних п'яти елементів із зростанням порядкового номера ступінь окислення зменшується:
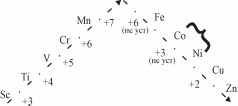
+2
У четвертому періоді від скандію до марганцю в міру заповнення d-орбіталей кількістю-ство неспарених електронів зростає, зростає і валентність. Починаючи з заліза кількість неспарених електронів, зменшується і валентність знижується.
У підгрупі із збільшенням атомного номера зростає стійкість сполук, які відповідають вищим ступенів окислення, що обумовлюється посиленням металевих властивостей атомів d-елементів.
З'єднання d-елементів різних ступенів окислення близькі по стійкості (Fe +2 і Fe +3; Сr +3 і Сr +6; Мn +2 і Mn +7).
Знаходження в природі та отримання
Fe - поширений елемент (зустрічається у вільному стані і метеоритного
походження).
У самородному стані зустрічаються Au, іноді Ag, Hg, Cu. Інші елементи у вигляді
з'єднань, найчастіше у вигляді сульфідних або оксидних руд.
Металотермія, карботермія, електроліз.
ZrCl4 + 4Na Zr + 4NaCl
MnO2 + 2C Mn + 2CO
4Au + 8NaCN + 2H2O + O2 4Na[Au(CN)2] + 4NaOH
4Na[Au(CN)2] + Zn Na2[Zn(CN)4] + 2Au
Cr2O3 + 2Al Al2O3 + 2Cr
WO3 + 3H2 = W + 3H2O
Хімічні властивості
IIIB - активні метали, похожие на Mg, Ca, гідроксиди практично не амфотерні.
IVB - на холоді малоактивні (міцна плівка оксидів). j »-1,7 ¸ 1,6. при звичайній
температурі повільно реагують з HF (конц.) і пекельною сумішшю
3Э + 18HF + 4HNO3 3H2[ЭF6] + 4NO + 8H2O
Ti с горячими HCl, H2SO4 и HNO3.
3Ti + 4HNO3 + H2O 3H2TiO3+ 4NO
Ti (Zr) + 4NaOH расплавNa4ЭO4 + 2H2
VB - метали середньої активності. j »-1,1. При звичайній температурі не розчиняються в
воді. При високій температурі з водяною парою реагують з виділенням Н2.
V розчиняється в HF VF3
HNO3 VO2NO3
HNO3 + HCl VO2Cl
H2SO4 tVOSO4
NaOH tNa3VO4
3Nb (Ta) + 5HNO3 + 21HF 3H2[ЭF7] + 6H2O
VIB - метали середньої активності, j <0. При звичайній температурі мала реакційна
здатність (міцна оксидна плівка).
Cr + HCl CrCl2 + H2
Cr + H2SO4 CrSO4 + H2
Mo + HNO3 H2MoO4 +…
Mo + HNO3 + HCl H2MoO4 +…
Mo + H2SO4 H2MoO4 +…
Mo (W) + 2HNO3 + 8HF H2[Mo(W)F8] + 2NO + 4H2O
2Э + 4NaOH + 3O2 2Na2ЭO4 + 2H2O
(Э - Cr, Mo, W)
2Э + 4Na2CO3 + 3O2 2Na2ЭO4 + 2CO2
VIIB - метали середньої активності, j <0. Tc, Re - малоактивні j> 0. З водою не
реагують (Mn - плівка Mn2O3).
Mn + 2H+ Mn2+ + H2
Tc (Re) + HNO3 HЭO4 +…
VIIB - метали середньої активності, j <0. Fe, Co, Ni стійкі до розчинів і розплавів
лугів (гідроксиди майже не виявляють амфотерних властивостей).
З кислотами: Э2+ и Н2
Э3+ - нет, т.к. Э3+ + Э Э2+
Fe + H2SO4(к) (HNO3(к))
Pt > 0
Не реагують з більшістю кислот і розчиняються тільки в царській горілці чи пекельної
суміші. Окислюються лугами у присутності кисню при нагріванні.
IB - малоактивні метали, j> 0
Cu + HCl H[CuCl2] + H2
IIB – Zn, Cd j < 0, Hg j > 0.
Zn + 2H+ Zn2+ + H2
Cd + 2H+ Cd2+ + H2
Hg + HNO3(к)(изб.)(р ?) Hg(NO3)2 + NO + H2O
Hg + HNO3(р)(недост.) Hg2(NO3)2 + NO + H2O
Zn + KOH + H2O = K2[Zn(OH)4] + H2
Zn + KOH tK2ZnO2 + H2
Cd + KOH(конц.) + H2O немного K2[Cd(OH)4] + H2
Використання та біологічна роль
Елементи, зміст яких не перевищує 10-3%, входять до складу ферментів, гормонів, вітамінів та інших життєво важливих сполук. Для білкового, вуглеводного і жирового обміну речовин необхідні: Fe, Co, Mn, Zn, Мо, V, В, W; в синтезі білків беруть участь: Mg, Мn, Fe, Со, Си, Ni, Сr, в кровотворенні - З, Ti, Сі, Mn, Ni, Zn; в диханні - Mg, Fe, Сu, Zn, Mn і Co. Тому мікроелементи знайшли широке застосування в медицині, як мікродобрив для польових культур, підгодівлі в тваринництві, птахівництві та рибництві. Мікроелементи входять до складу великої кількості біорегуляторів живих систем, в основі яких лежать біокомплекси.
Іони металів у ферментах виконують ряд функцій: є електрофільні групою активного центру ферменту і полегшують взаємодію з негативно зарядженими ділянками молекул субстрату, формують каталітично активну конформацію структури ферменту (у формуванні спіральної структури РНК, беруть участь іони цинку і марганцю), беруть участь у транспорті електронів (комплекси перенесення електрона). Здатність іона металу виконувати свою роль в активному центрі відповідного ферменту залежить від здатності іона металу до комплексоутворення, геометрії і стійкості утвореного комплексу. Це забезпечує підвищення селективності ферменту по відношенню до субстратів, активації зв'язків у ферменті або субстраті допомогою координації і зміні форми субстрату відповідно до стеричним вимогами активного центру.
Біокомплекси розрізняються по стійкості. Одні з них настільки міцні, що постійно знаходяться в організмі і виконують певну функцію. У тих випадках, коли зв'язок кофактора і білка ферменту міцна і розділити їх важко, його називають «простетичної групою». Такі зв'язки виявлені у ферментах, що містять гем-комплексне з'єднання заліза з похідним порфина. Роль металів таких комплексів високоспецифічний: заміна його навіть на близький за властивостями елемент призводить до значної або повної втрати фізіологічної активності. Дані ферменти відносять до специфічних ферментів.
Прикладами таких сполук є хлорофіл, поліфенілоксідаза, вітамін В12, гемоглобін і деякі металоферментів (специфічні ферменти). Небагато ферменти беруть участь тільки в одній певній або єдиної реакції.
Каталітичні властивості більшості ферментів визначаються активним центром, утвореним різними мікроелементами. Ферменти синтезуються на період виконання функції. Іон металу виконує роль активатора і його можна замінити іоном іншого металу без втрати фізіологічної активності ферменту. Такі віднесені до неспецифічних ферментами.
Список використаної літератури
-
Жолнін А.В., Хімія біогенних елементів, конспект лекцій. – Челябінськ, 2001р.
-
Балецька Л.Г., Неорганічна хімія, курс лекцій. – Таганрог, 2007р.
-
Корольков Д.В., Скоробогатов Г.А. Теоритична хімія. - СПб: СПб університета, 2001р.
-
Фримантл М. Хімія в дії. В 2-ух ч. Ч.2. Переклад з англ. – М.:Мір, 1998р.
-
Інтернет ресурси.
-
Карапетьянц М. Х. , Дракин С.И. Общая и неорганическая химия. – М.: Химия, 1993.
-
Ахметов Н.С. Общая и неорганическая химия. Учебник для вузов. – М.: Высш. шк., 2001.
-
Дроздов Д.А, Зломанов В.П., Мазо Г.Н., Спиридонов Ф.М. Неорганическая химия. В 3-х томах. Т.2. Химия непереходных элементов. / Под ред. Ю.Д. Третьякова -М.: Изд. «Академия», 2004
-
Балецкая Л.Г. Неорганическая химия. -Ростов-на-Дону, Феникс, 2005.
-
Черных, М.М. Овчаренко. Тяжелые металлы и радионуклиды в биогеоцинозах. –М.: Агроконсалт, , 2004.
