Лекція 10 Методи вимірювання теплоємності і тепловмісту.
План лекції
1. Вимірювання ентальпії методом змішування.
1.1. Рідинний колориметр
1.2. Льодяний колориметр
2. Вимірювання теплоємності.
2.1. Метод Сайкса-Грузіна
2.2. Метод Сміта
2.3. Способи отримання низьких і наднизьких температур.
Прилади, які використовуються для вимірювання ентальпії, або теплоємності, називаються калориметрами, а методика вимірювання – калориметрією.
Сучасні калориметри (колориметричні системи http://www.youtube.com/watch?v=Tcwls9J0Svg) працюють в діапазоні температур від 0,1 до 3500 К і дозволяють вимірювати кількість теплоти з точністю до 0,01-10%. Існує багато типів калориметрів, які відрізняються як за зовнішнім виглядом, так і за внутрішніми складовими, що визначається характером і тривалістю досліджуваного процесу, областю температур, при яких проводяться вимірювання, кількістю вимірюваної теплоти і необхідною точністю.
Колориметри ділять за величиною, яку можна за їх допомогою виміряти на:
- калориметри-інтегратори - призначені для вимірювання сумарної кількості теплоти Q, що виділяється в процесі перетворень від його початку до завершення,
- калориметри-осцилографи призначені для вимірювання теплової потужності (швидкості тепловиділення) і її зміни на різних стадіях процесу.
За конструкцією і методом вимірювання калориметричні системи діляться на:
рідинні
масивні,
одинарні
та диференціальні (подвійні) .
Класифікувати колориметри можна ще за трьома змінними, які є його характеристиками:
температурою колориметричної системи Tc;,
температурою оболонки To,
кількістю теплоти L, що виділяється в калориметрі в одиницю часу (тепловій потужності).
Калориметри зі сталими Tc і To називають ізотермічними;
з Tc = To — адіабатичними;
калориметри, що працюють при сталій різниці температур Tc — To=const, называють калориметрами зі сталим теплообміном;
у ізопериболічного калориметра (його ще называють калориметром з ізотермічною оболонкою) стала To, а Tc є функцією теплової потужності L.
Методи калориметрії ділять на:
метод прямої калориметрії (знімають криві охолодження зразка, нагрітого до певної температури, яка перевищує температуру перетворення в зразку),
метод зворотної калориметрії (холодний зразок розміщують в колориметричну систему і повільно її нагрівають, знімаючи криві нагрівання).
Крім того, існують різні методи калориметрії, назви яких утворилися історично:
метод змішування (занурюється оболонка зі зразком у рідину чи іншу речовину),
метод Сміта (використовується калориметр зі сталим теплообміном)
методСайкса (адіабатичний метод)
диференціальна адіабатична калориметрія,
імпульсна калориметрія (висока швидкість нагрівання)
поєднання термічного аналізу і калориметричного.
1. Вимірювання ентальпії методом змішування.
1. Метод змішування - це не прямий метод, який полягає у вимірюванні температури посудини з речовиною, у яку розміщують нагрітий зразок. Недоліки методу змішування
Метод змішування не дає точні результати тоді, коли існують фазові перетворення в заданому інтервалі температур. У цьому випадку використовують непрямі методи обчислення ентальпії через теплоємність.
Існує дві різновидності колориметрів, в якому реалізується цей метод: рідинний та льодяний калориметри.
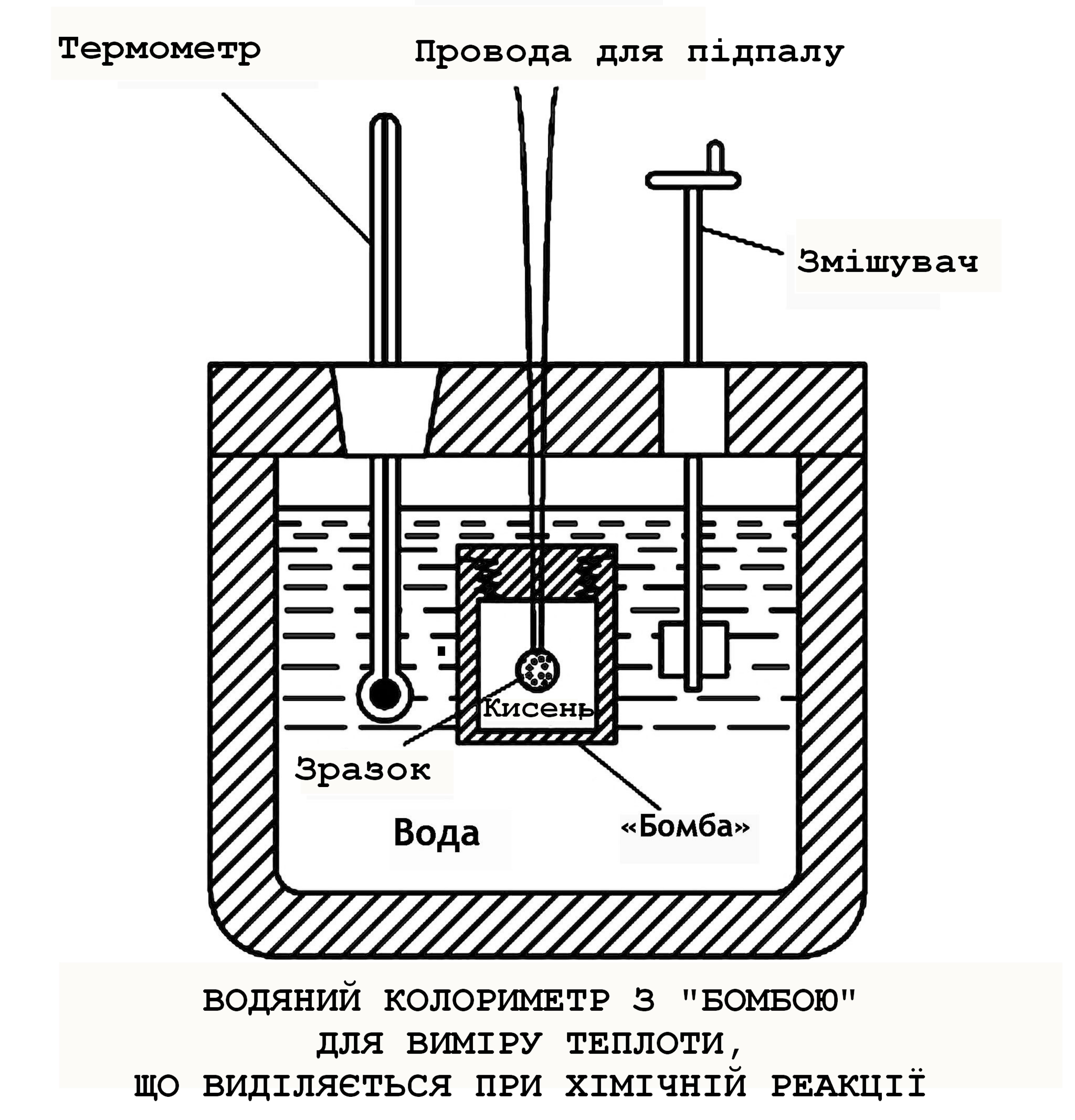
Рідинний калориметр.
Рідинний калориметр-інтегратор змінної температури із ізотермічною оболонкою застосовують для вимірювання теплоти розчинення і теплоти хімічних реакцій. Він складається з посудини з рідиною (зазвичай водою, може бути також анілін, парафінове масло), в якому знаходяться: камера для
|
проведення досліджуваного процесу («калориметрична бомба»), мішалка, нагрівач і термометр. У рідинних калориметрів ізотермічну температуру оболонки підтримують постійною. В цьому методі теплоту Q визначають по зміні температури калориметричної системи:
де W - теплове значення калориметра (тобто кількість теплоти, необхідної |
|
для його нагрівання на 1 К), знайдене у попередніх експериментах (градуювання калориметра).
Переваги: простота обладнання та виміру.
Недоліки:
1) При визначенні теплоти хімічної реакції найбільші труднощі часто пов'язані не з урахуванням побічних процесів, а з визначенням повноти протікання реакції і з необхідністю враховувати кілька реакцій.
2) Точність калориметра невелика через пароутворення або розбризкування калориметричної рідини. Для усунення цього недоліку зразок розміщують у додаткову посудину, яка занурюється у рідину. Але у цьому випадку період теплообміну збільшується і ускладнюється врахування поправок до додаткових теплових витрат.
3) Потребує попереднього градуювання.
|
Рис. 2. Льодяний калориметр Бунзена. |
1.2.
Льодовий калориметр Бунзена.
Колориметр складається з широкої
скляної трубки з товстими стінками
b,
перехідною в нижній частині в тоншу
трубку с;
до останньої прикріплена залізна
оправа
|
якому відбуваються екзотермічні перетворення, плавить лід, кількість якого вимірюють за зменшенням об’єму вмісту суміші вода-лід. Це один з так званих ізотермічних калориметрів, в яких температура залишається постійною у весь час дослідження. Більш досконалий льодяний калориметр створили Шуллер и Варт.
Якщо у зразку через протікання якогось процесу відбувається виділення теплоти, то в результаті певна частина льоду в калориметричній посудині перетворюється на воду і теплота перетворення дорівнює Q = Δmл·Δплh,
де Δmл — маса льоду, що розтанув, Δплh = (333.7 ± 0.3) Дж/г — питома теплота плавлення льоду. Визначити кількість льоду, що розплавився можна по зміні обсягу суміші льоду і води, що знаходяться в калориметричному посуді. Ця зміна ΔV визначається по зсуву в капілярі, причому ΔV <0 (густина льоду при 0оС менше густини води). Позначимо ρл і ρв як густину льоду і води при 0оС. У цьому випадку при плавленні 1 г льоду зміна об’єму дорівнює (1/ρв - 1/ρл), тоді
![]() ,
,
![]() (1)
(1)
Чутливість льодового калориметр дорівнює відношенню ΔV / Q і складає
![]() .
(2)
.
(2)
При нагріванні зразка на 1 Дж тепла ртуть переміщується на 0.2717 мм по капиляру з площиною перетину 1 мм2.
Переваги: Теплообмін між досліджуваним зразком і оточуючим середовищем (термостатом) зведений до мінімуму.
При всій своїй чутливості колориметр Бунзена має деякі недоліки:
1) він вимагає багато абсолютно чистого льоду;
2) пересування ртуті у вузькому капілярі, як відомо, є досить інертним.