
labs
.pdfМіністерство освіти і науки, молоді та спорту України
Національний технічний університет України «Київський політехнічний інститут»
МЕТОДИЧНІ ВКАЗІВКИ
ДО ЛАБОРАТОРНИХ РОБІТ ПО ДИСЦИПЛІНІ
«ТЕОРІЯ МЕТАЛУРГІЙНИХ ПРОЦЕСІВ»
для студентів напрямів підготовки 6.050401 – «Металургія»
6.050402 – «Ливарне виробництво»
Київ, 2011
Міністерство освіти і науки, молоді та спорту України
Національний технічний університет України “Київський політехнічний інститут”
Затверджено на засіданні кафедри “Фізико-хімічні основи технології металів” Протокол № 11/11 від 31.08.2011 р.
МЕТОДИЧНІ ВКАЗІВКИ
ДО ЛАБОРАТОРНИХ РОБІТ ПО ДИСЦИПЛІНІ
«ТЕОРІЯ МЕТАЛУРГІЙНИХ ПРОЦЕСІВ» для студентів напрямів підготовки
6.050401 – «Металургія»
6.050402 – «Ливарне виробництво»
Київ, 2011
2
Методичні вказівки до лабораторних робіт по дисципліні «Теорія металургійних процесів» для студентів напрямів підготовки 6.050401 – «Металургія», 6.050402 – «Ливарне виробництво» / Ю. Я. Готвянський. – Київ: НТУУ “КПІ”, 2011. – 47 с.
Методичні вказівки до лабораторних робіт по дисципліні
«Теорія металургійних процесів» для студентів напрямів підготовки
6.050401 – «Металургія»
6.050402 – «Ливарне виробницто»
Вказівки складали: Юрій Якович Готвянський
Редактор: В. М. Рибак
Рецензенти: |
М. М. Ямшинський |
|
М. І. Прилуцький |
3
ВСТУП
Дані методичні вказівки призначені для проведення лабораторних занять зі студентами напрямів підготовки 6.050401 – «Металургія» і 6.050402 – «Ливарне виробництво» по дисципліні «Теорія металургійних процесів».
Дисципліна «Теорія металургійних процесів» в сукупності з теплофізикою, хімією, фізичною хімією, та фізичним металознавством призначені сформулювати теоретичний базис металурга.
Передбачається, що в результаті засвоєння цієї дисципліни студент набуває інженерні знання, які дозволяють самостійно обрати металургійну технологію одержання заданого металу чи сплаву і визначити його властивості в залежності від призначення та умов експлуатації. Знання означеної дисципліни необхідне для роботи на виробництві і при наукових дослідженнях.
Мета даних вказівок – допомогти студентам набути практичних навичок при дослідженні теорії металургійних процесів, навчитись користуватись довідниковою інформацією, виконувати термодинамічні розрахунки і використовувати їх результати для аналізу металургійних реакцій.
4
ІНСТРУКЦІЯ
з техніки безпеки в навчальній лабораторії при проведенні лабораторних робіт
1.Перед початком лабораторних робіт викладач разом із завідувачем навчальної лабораторії повинні провести інструктаж по техніці безпеки серед студентів, що приступають до виконання лабораторних робіт.
2.Після проведення інструктажу оформляється спеціальний протокол із зазначенням найменування інструктажу, дати проведення інструктажу, списку студентів, що пройшли інструктаж і їхніх підписів у відповідних графах. Викладач і завідувач навчальної лабораторії також повинні поставити свої підписи в протоколі.
3.Для проведення лабораторних робіт академічна група поділяється на чотири бригади по 2...5 чоловік у кожній в залежності від числа студентів у групі.
4.Забороняється користуватися будь-яким устаткуванням лабораторії без дозволу викладача. Всі роботи в лабораторії повинні проводитися під наглядом викладача.
5.Знаходячись у лабораторії студенти повинні виконувати такі правила:
-дотримувати встановлену в лабораторії навчальну дисципліну;
-дотримувати робоче місце у відповідній чистоті;
-знаходитися на своєму робочому місці протягом усієї лабораторної
роботи;
-не торкати рубильники, кнопки й інші прилади без дозволу викладача;
-не заходити за огороджені ділянки, що знаходяться в лабораторії;
-не застосовувати наявний у лабораторії різноманітний інструмент і пристосування, не передбачені даною лабораторною роботою;
-не проводити одному роботи, яка потребує участі в ній кількох студентів із бригади;
-чітко виконувати інструкції про проведення лабораторної роботи.
6.При роботі з рідким металом або шлаком студенти повинні бути одягнені в цупкий одяг, мати закрите взуття, головні убори і засоби індивідуального захисту: маску та брезентові рукавиці.
7.Забороняється завантажувати в піч вологу шихту і флюси. При розливанні металу у форму останню необхідно прогріти.
5
ПОРЯДОК ВИКОНАННЯ ЛАБОРАТОРНИХ РОБІТ
Кожну лабораторну роботу студент виконує індивідуально. Порядок виконання кожної лабораторної роботи наступний:
1) Перед виконанням лабораторної роботи студент повинен:
-вивчити тему та мету лабораторної роботи;
-ознайомитися з теоретичними відомостями, правилами роботи з устаткуванням та інструментом, який використовується при виконанні лабораторної роботи;
-вивчити порядок виконання даної лабораторної роботи;
-з’ясувати які результати необхідно отримати;
-з’ясувати порядок опрацювання результатів досліджень;
-з’ясувати об’єм та порядок представлення результатів;
-підготувати відповідний протокол лабораторної роботи.
2) Під час виконання лабораторної роботи студент повинен:
-отримати допуск до виконання лабораторної роботи. Допуск отримується шляхом перевірки протоколу та відповіді на питання викладача. У випадку відсутності протоколу студент до виконання лабораторної роботи не допускається;
-виконати усі завдання, зазначені в порядку виконання лабораторної
роботи;
-опрацювати результати досліджень згідно з запропонованими методиками;
-оформити протокол, в якому навести усю необхідну інформацію що до проведеної роботи та отриманих результатів;
-зробити та записати у протокол висновки.
3) Після виконання лабораторної роботи студент повинен:
- захистити лабораторну роботу. Захист полягає в перевірці правильності, об’єму, якості проведених досліджень та розрахунків, а також відповіді на питання викладача стосовно лабораторної роботи.
За кожну лабораторну роботу студент може отримати максимальну кількість балів в залежності від рейтингової системи оцінювання знань студентів, що використовується в даному семестрі по даній дисципліні.
6

ЛАБОРАТОРНА РОБОТА №1 РІВНОВАГА РЕАКЦІЇ ГАЗИФІКАЦІЇ ВУГЛЕЦЮ ВУГЛЕКИСЛИМ ГАЗОМ
Мета роботи: вивчити експериментально вплив температури на рівновагу реакції взаємодії діоксиду вуглецю з вуглецем при постійному тиску газів в системі, таким чином визначити значення константи рівноваги реакції при різних температурах. За рівнянням (1.3) розрахувати значення константи рівноваги Кр(Т) при заданих температурах і зіставити їх з досвідченими значеннями. По дослідних значенням Кр(Т) визначити збільшення ентальпії та ентропії системи в результаті протікання хімічної реакції.
1.1. Термодинамічний аналіз реакції
Взаємодія вуглецю з вуглекислим газом отримує розвиток у випадку шарового спалювання твердого палива в топкових пристроях, при горінні коксу в вагранках та доменних печах, а також при отриманні захисних і відновлювальних атмосфер для процесів термічної оброб-
ки металів. Ендотермічна реакція CO2+C=2CO ( |
H0 |
=172585 Дж/моль) |
|||||||||
|
|
|
|
|
|
|
|
|
|
298 |
|
є оборотною. Константа рівноваги цієї реакції |
|
|
|||||||||
|
P2 |
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
||||||
Кр(T) |
|
|
|
|
PCO |
, |
|
(1.1) |
|||
CO |
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
||
|
P |
a |
|
|
|
|
|
|
|
||
|
|
PCO2 a |
|
|
|
||||||
|
CO2 |
c |
|
|
|
|
|
c |
|
|
|
де PCO і PCO2 - парціальні тиски оксиду та діоксиду вуглецю при ста-
ні термодинамічної рівноваги, відносних одиниць; ac - активність вуглецю.
Якщо вуглець знаходиться у вигляді чистої речовини, то ac=1,
2
Кр(T) PCO . (1.2)
PCO2
Залежність логарифма константи рівноваги від температури
|
|
H0 |
|
S0 |
8905 |
|
|
lgКp(T) |
|
T |
|
T |
9,11. (1.3) |
||
|
|
|
|||||
19,08T |
19,08T |
T |
|||||
|
|
||||||
Дня двофазної системи (ф=2), яка складається з трьох компонентів (К=3), в якій протікає одна незалежна хімічна реакція згідно з правилом фаз Гіббса, отримуємо С=2+(K-r)-ф=2+(3-1)-2=2, тобто система має дві термодинамічні ступені свободи. Тому рівноважний склад газової фази реакції взаємодії діоксиду вуглецю з вуглецем у вигляді графіту залежить як від температури, так і від сумарного (загального) тиску газів в системі.
Якісний вплив фізичних параметрів (тиск і температура) можна оцінити, застосовуючи правило Ле-Шательє. Оскільки реакція - ендотермічна, підвищення температури (зовнішній вплив-підвід теплоти до
Лист
Зм. Лист № докум. Підпис Дата
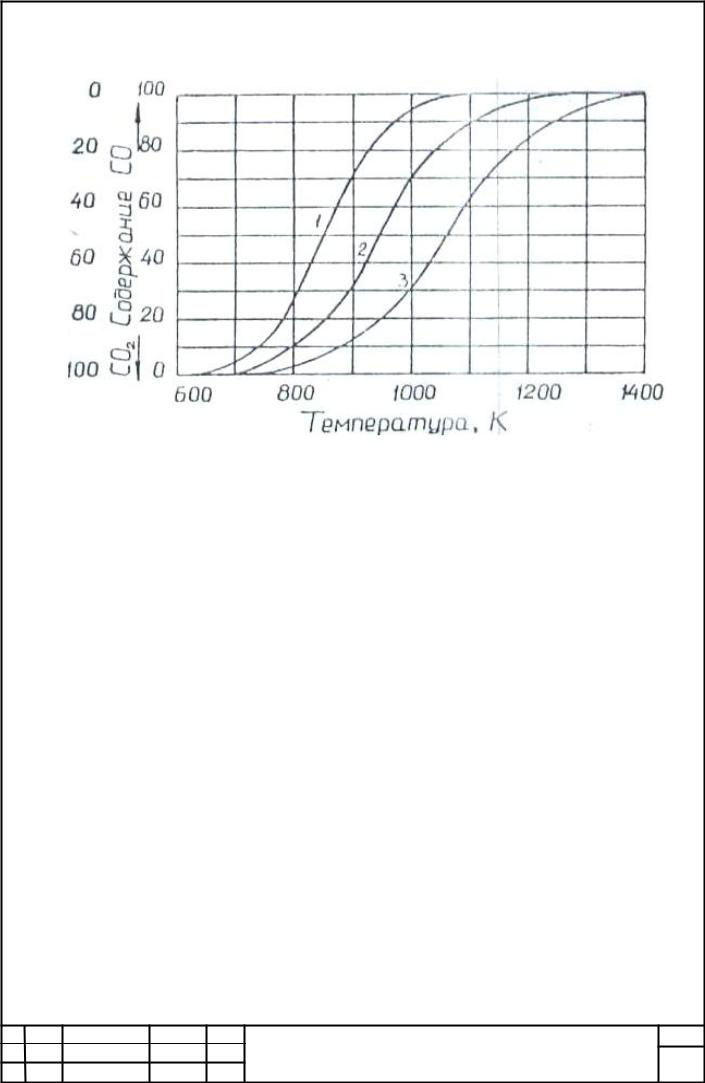
системи) зміщує рівновагу і сторону більшої частки оксиду вуглецю в рівноважній суміші (рис.1.1, крива 1).
Рис.1.1. Зміна рівноважних складів газової фази реакції CO2+C=2CO в залежності від температури при тиску газової фази в
системі 1,0(1), 10(2) і 0,1 відносних одиниць(3)
Збільшення тиску газів в системі перешкоджає розвитку реакції газифікації вуглецю і сприяє протіканню зворотної реакції, що йде з зменшенням обсягу газоподібних компонентів реакції. У результаті частка оксиду вуглецю в рівноважній газовій фазі зменшується (рис.1.1, крива 2). При зниженні тиску газів в системі рівноважний вміст оксиду вуглецю збільшується: (рис.1.1, крива 3).
1.2. Метод дослідження
Рівновага реакції газифікації вуглецю досліджується циркуляційним методом, сутність якого полягає в тому, що газова фаза з малою швидкістю фільтрується через шар нагрітого до заданої температури деревного вугілля, циркулюючи в замкнутій системі до встановлення в ній стану хімічної рівноваги.
1.3. Опис установки
Схема установки показана на рис. 1.2. Замкнута циркуляційна система включає в себе реакційну трубку 1 зі шаром 2 активованого вугілля, циркуляційної насос 3, запобіжний клапан 4, компенсатор 5 з зрівняльні посудиною 6 для компенсації зміни об'єму газової фази, манометр 7 для вимірювання тиску газу в системі і триходові крани 8 і 9.
Лист
Зм. Лист № докум. Підпис Дата
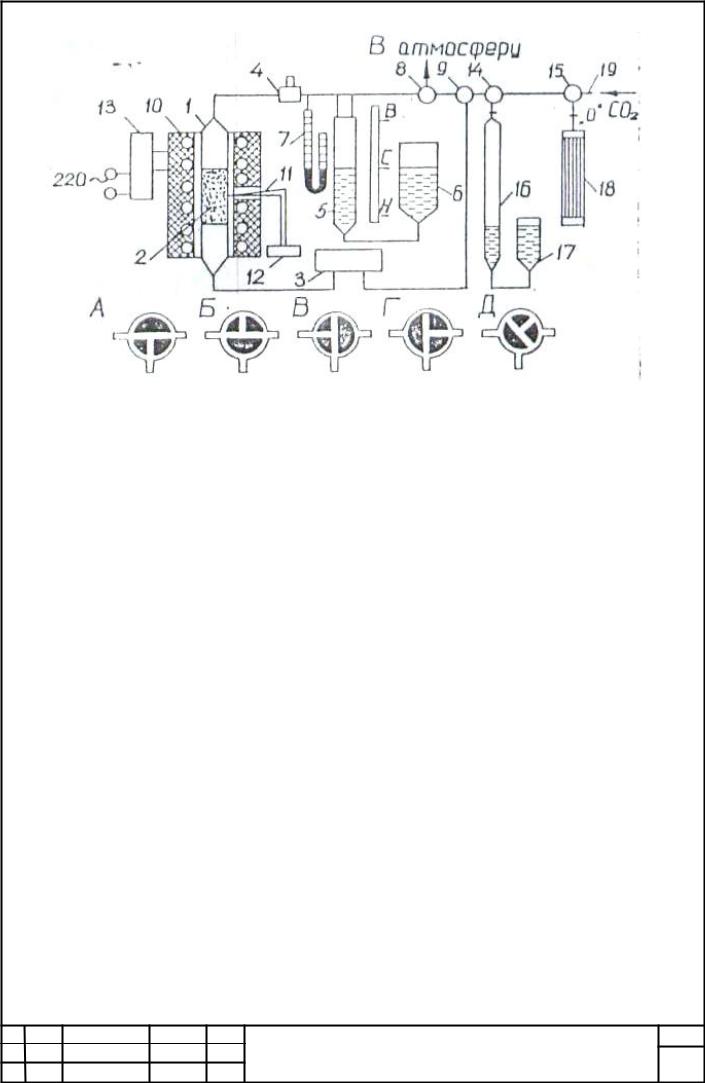
Рис.1.2. Схема для дослідження хімічної рівноваги реакції взаємодії діоксиду вуглецю з вуглецем
Реакційна трубка 1 поміщена всередині електричної печі 10. Температура в печі вимірюється термопарою 11, що працює в комплекті з потенціометром (мілівольтметром) 12, і регулюється або за допомогою регулятора напруги 13, або автоматично, за допомогою регулятора температури. Через крани 9, 14 і 15 циркуляційна система з'єднана з бюреткою 16 і вирівнювальною склянкою 17, поглинальні посудиною 18 і газової лінією 19 для введення в систему вуглекислого газу. Через кран 8 система з'єднана з атмосферою.
1.4. Порядок виконання роботи
Умовні позначення: кр. – кран; кр.8→А – кран 8 переводять в положення А.
1.Підготувати газоаналізатор до роботи. Кр.14 → Г; кр.15 → В. Повільним переміщенням напірної склянки 17 вниз рівень рідини в посудині поглинальної 18 встановити на мітці "0". Кр.15 → Д, кр.8 → Г, кр.9 → Б, кр.14 В. Повільно переміщаємо склянку 17 вгору, довести рівень рідини в бюретці 16 до верхньої позначки. Кр.14 → Б.
2.Перевірити герметичність циркуляційної системи (виробляється тільки при холодній печі). Встановивши зрівняльний посуд 6 у верхнє положення (позиція "в" на шкалою), кр.9→В, кр.8→Б (циркуляційна система з'єднується з атмосферою), опустити зрівняльний посудину 6 у положення "н" і заповнити компенсатор 5 повітрям. Кр.8→А (система стає замкненою). Установити посудину 6 у положення "с", створити в системі позитивний тиск, що фіксується манометром 7. При відсутності витоків газу, покази манометра залишаються незмінними.
Лист
Зм. Лист № докум. Підпис Дата

3.Включити електричну піч. Покажчик регулятора температури встановити на позначці 873 К (600 °С). Включити пускач, тумблер потенціометра перевести і положення "Вкл.".
4.Заповнити систему діоксидом вуглецю. Кр.8→К. Піднімаючи склянку 6, довести рівень рідини в компенсаторі до мітки "в". Кр.15→Б, кр.14→ Б, кр.9→А, відкрити вентиль на лінії вуглекислого газу. Через 5-10
скр.8→А, кр.9→В (система стає замкненою). Закрити вентиль на балоні вуглекислого газу; кр.15→Д, включити циркуляційний насос 3.
5.Температуру в печі довести до заданої і підтримувати постійною протягом усього часу досліду.
6.По мірі протікання реакції зміною положення зрівняльного судини 6 підтримувати постійним тиск газу в системі (контролюється за показами манометри 7).
7.По досягненні стану хімічної рівноваги реакції, про що свідчить сталість рівня рідини в компенсаторі 5, вимкнути насос 3 і відібрати пробу газу для аналізу. З цією: метою переміщенням склянки 6 вирівняти рівні рідини в посудині 5 і склянці 6 (при цьому в системі встановиться тиск, що дорівнює атмосферному); Кp.9→А, кр.14→В, потім, одночасно піднімаючи склянку 6 і опускаючи склянку 17, в бюретку 16 забрати близько 100 см3 суміші газів, що складається з СО та СО2. Кр.14→Г; піднімаючи склянку 17, вирівняти рівні рідини в бюретці 16 і склянці 17. Виміряти об'єм суміші газів V в бюретці 16, значення записати в колонку 5 табл.1.1.
8.Виконати аналіз проби газу. Як правило, проба газу аналізується хроматографічним методом за допомогою хроматографа типу "Газохром 3101" (аналіз виконує лаборант). Студент, пропалюючи гумову трубку, яка з'єднує бюретку 16 з краном 14, голкою шприца, забирає у ньому 5 см3 газової суміші і передає лаборанту. Кількісну інтерпретацію хроматограм виконують згідно додатку 1.
Хімічний аналіз суміші газів здійснюється шляхом поглинання діоксиду вуглецю водним розчином KOH в поглинальної посудині 10. Для цього кр.14→Г, кр.15→В; потім змінним підняттям і опусканням склянки 17 газову суміш перекачують з бюретки 16 в посудину 19 і назад до повного поглинання СО2 (6-7 хитань). Опускаючи рівень рідини в бюретці 16 донести рівень розчину KOH в посудині 18 до мітки "0"; Kp.15→Д. Вирівняти рівні рідини в бюретці 16 і склянці 17 і по шкалі на бюретці визначити обсяг, що залишився оксиду вуглецю; обсяг діоксиду вуглецю дорівнює різниці між початковим об'ємом суміші газів VCM і VCO; VCO2 -
VCO.
Процентний вміст СО і СО2 в суміші обчислюють за формулами:
Лист
Зм. Лист № докум. Підпис Дата
