
Лабораторна 2 Розчини Вступ до фаху
.doc
Розчини. Приготування і визначення концентрації розчину
Мета роботи
Навчитись готувати розчини заданої концентрації та визначати концентрацію розчину за допомогою ареометрів та титруванням.
Теоретична частина
Розчин — це однофазна система перемінного складу, що містить два або більше компонентів. Розчини — це гомогенні (однорідні) системи, тобто кожен з компонентів розподілений в масі іншого в вигляді молекул, атомів чи іонів.
Розчинник — компонент, агрегатний стан якого не змінюється при утворенні розчину. У випадку розчинів, утворених при змішуванні газу з газом, рідини з рідиною, твердої речовини з твердою, розчинником вважається той компонент, кількість якого в розчині переважає.
Розчинення — це перехід молекул речовини з однієї фази в іншу (розчин). Розчинення проходить в результаті взаємодії атомів (молекул) розчинника та розчиненої речовини. При розчиненні міжфазна поверхня розділу зникає, при цьому багато фізичних властивостей розчину (наприклад, густина, в’язкість, інколи — колір, та інші) змінюються.
Речовини, що беруть участь у процесі розчинення, характеризуються розчинністю—здатністю однієї речовини утворювати з іншими речовинами гомогенні суміші з дисперсним розподілом компонентів (розчини). Кількісно розчинність пари, рідини чи твердої речовини в рідкому розчиннику вимірюється концентрацією насиченого розчину при даній температурі. Насиченим розчином називається розчин, що знаходиться в рівновазі з надлишком розчиненої речовини. Для твердих і рідких речовин звичайно розчинність описується за допомогою коефіцієнта розчинності—максимальної кількості грамів компонента, що розчиняється при заданих умовах у 100 одиницях маси розчинника з утворенням насиченого розчину. Говорячи про розчинність речовини, потрібно завжди вказувати температуру. Розчинність як характеристика тієї чи іншої речовини наводиться для найбільш розповсюджених розчинників у спеціальних довідкових таблицях.
Чинники, що впливають на розчинність: природа речовини, яка розчиняється, і розчинника, температура, тиск. Відповідно до емпіричного правила «подібне розчиняється в подібному» тотожні за фізичними і хімічними властивостями речовини добре розчинні одна в одній.
Процес розчинення може проходити з поглинанням або виділенням тепла. Теплоту, що виділяється або поглинається при розчиненні, відносять до моля розчиненої речовини і вимірюють у Дж/моль. Розчинення газів найчастіше екзотермічний процес (АН < 0), але в органічних розчинниках вони іноді розчиняються з поглинанням тепла (АН > 0).
Розчинність пари в рідинах збільшується із збільшенням тиску і, в більшості випадків, з пониженням температури.
Більш складний процес розчинення рідини в рідині. Можна виділити кілька типів змішування рідин: а) необмежено розчинні одна в одній з утворенням гомогенного розчину (вода й етанол); б) частково розчинні (вода і діетиловий етер), при досить доброму розчиненні їхня взаємна розчинність досягає межі; в) практично не розчиняються (вода і ртуть). Абсолютно не розчинних одна в одній рідин немає. У більшості випадків з ростом температури взаємна розчинність рідин збільшується. Для рідин існує таке поняття, як критична температура розчинності — температура, при якій обидві рідини змішуються одна з одною в будь-яких співвідношеннях. Залежність взаємної розчинності рідин від тиску проявляється мало і стає помітною лише при значній зміні параметра тиску.
Розчинність твердих речовин в рідинах може змінюватися в широких межах. Звичайно вона зростає із збільшенням температури. Але є і винятки, коли розчинність із ростом температури знижується (натрію бутират).
За агрегатним станом розчини бувають: рідкі, тверді і газоподібні.
Важливою характеристикою будь-якого розчину є його склад. Він виражається концентрацією — відношенням кількісного вмісту компонента розчину до певної маси чи об'єму розчину або розчинника. Встановлення рівноваги між газом, рідиною чи твердим тілом у рідкому розчиннику досягається при концентрації насичення. Ця величина кількісно характеризує розчинність певної речовини при заданій температурі. Для приготування розчинів використовують кілька способів вираження концентрації розчиненої речовини: в одиницях маси, молях, еквівалентах.
Відповідно до призначення і вимог концентрація розчинів може виражатися з різною точністю. Розрізняють емпіричні, точні і приблизні розчини. Емпірична концентрація встановлюється для багатьох розчинів допоміжних речовин (специфічні реактиви, індикатори та ін.), і її значення наводиться у відповідних прописах. При виконанні препаративних, аналітичних і інших робіт розчини допоміжних реагентів (кислот, основ і інших речовин) готують приблизної концентрації, частіше для її вираження використовують відсоткову концентрацію за масою або об'ємом. Розчини з точною концентрацією (стандартні, робочі, титровані) частіше застосовуються в аналітичних дослідженнях. Їх концентрація виражається нормальністю, титром робочого розчину за аналізованою речовиною, а у фізико-хімічних дослідженнях — найчастіше молярністю.
Для приготування розчину необхідно знати різні способи вираження концентрації і вміти переходити від одного способу до іншого.
Масова частка — відношення маси розчиненої речовини до маси розчину. Масова частка вимірюється в частках від одиниці.
![]() ,
,
де:
m(х)— маса розчиненої речовини, г (кг);
mр— загальна маса розчину, г (кг).
Звідси:
![]() ,
,
![]()
Відсоткова концентрація C%(х) — кількість одиниць маси розчиненої речовини в 100 одиницях маси розчину.
![]()
Визначення інших величин, виходячи з основної формули:

 .
.
Об’ємна частка— відношення об’єму розчиненої речовини до об’єму розчину. Об’ємна частка вимірюється в частках від одиниці.
υ = V(x)/Vp
де:
V(x)— об’єм розчиненої речовини, л;
Vр— загальна об’єм розчину, л.
Молярна концентрація (молярність) С(х) — кількість молів розчиненої речовини в 1 л розчину. Вимірюється відношенням кількості речовини ν(х), що міститься в розчині, до об’єму цього розчину Vр:
![]() або
або
![]() .
.
Наприклад, С(х) = 1,0моль/л або 1,0 М (одномолярний розчин)
С(х) = 0,1моль/л або 0,1 М (децимолярний розчин)
С(х) = 0,01моль/л або 0,01 М (сантимолярный розчин)
С(х) = 0,001моль/л або 0,001 М (миллимолярный розчин)
С(х) = 2,0моль/л або 2,0 М (двомолярний розчин)
Визначення інших величин, виходячи з основної формули:
![]()
![]() .
.
Еквівалентна концентрація (нормальна концентрація або нормальність) СН(х) чи N – Число еквівалентів розчиненої речовини в 1 л розчину. Вимірюється відношенням кількості еквівалентів νекв(х), що міститься в розчині, до об’єму цього розчину Vр:
 ,
, 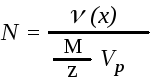
![]() ,
, ![]()
де:
z — число еквівалентності,
Е — еквівалентна маса розчиненої речовини, г/моль.
Наприклад: СН(х)=1,0 моль/л або 1,0н. (однонормальний розчин)
СН(х)=0,1 моль/л або 0,1н. (децинормальний розчин)
СН(х)= 0,01 моль/л або 0,1н. (сантинормальний розчин)
СН(х)= 0,001 моль/л або 0,001н. (мілінормальний розчин
Еквівалентом речовини називається така його кількість, яка в даній реакції рівноцінна (еквівалентна) 1 молю атомів водню. Нормальну концентрацію виражають в моль-екв/л. Нормальна концентрація може відрізнятися в залежності від реакції, в якій приймає участь речовина. Наприклад, одномолярний розчин H2SO4 буде однонормальним, якщо він використовується для реакції з лугом з утворенням гідросульфату KHSO4, і двонормальним в реакції з утворенням K2SO4.
Молярна концентрація еквівалента завжди більше молярної концентрації в z раз.
СН(х) = z∙С(х)
Титр (Т) — маса (у г чи мг) речовини, що міститься в 1 мл розчину. Для аналітичних цілей використовують вираження концентрації через титр за аналізованою речовиною — масу (у г чи мг) аналізованої речовини, яка еквівалентна певній кількості реагенту, що міститься в 1 мл розчину.
![]() .
.
Моляльна концентрація (моляльність) Сm(х)– вимірюється відношенням кількості речовини ν(х) до маси розчинника mр-ну:

При переході від масових концентрацій (масова частка, відсоткова концентрація. моляльність) до об’ємних (всі інші) необхідно знати густину розчину.
Методи кількісного визначення складу розчину
Метод денсиметрії – Визначення густини розчину за допомогою ареометра. Ареометр – це прилад для вимірювання густини рідини. Ареометр представляє собою поплавець з дробом або ртуттю і вузьким відростком – трубкою, в якій знаходиться шкала з поділами. Шкала градуйована в одиницях густини (кг/м3 або г/мл). Коли ареометр занурений в рідину, то рівень її поверхні збігається з тою поділкою на шкалі, що показує густину цієї рідини. Знаючи густину розчину, можна в довідковій літературі знайти масову частку розчиненої речовини. Наприклад, для розчину хлориду натрію при 15 ˚C є такі дані:
Таблиця 1
|
густина, г/мл |
1,00 |
1,0071 |
1,0144 |
1,0292 |
1,0441 |
1,0591 |
1,0742 |
1,0895 |
1,1049 |
1,1206 |
1,1364 |
1,1525 |
1,1689 |
|
Відсоткова концентра-ція, % |
0 |
1 |
2 |
4 |
6 |
8 |
10 |
12 |
14 |
16 |
18 |
20 |
22 |
Титрування Це метод кількісного хімічного аналізу, заснований на вимірюванні об'єму розчину з відомою концентрацією, витраченого на реакцію з розчином речовини невідомої концентрації, яку потрібно виміряти. Залежно від типу реакції, що лежить в основі процесу титрування. розрізняють кислотно-основне титрування, окислювально-відновне і т.д.
Для визначення концентрації кислоти застосовується кислотно-основне титрування розчином лугу. При цьому протікає реакція нейтралізації:
NaOH + HCl = NaCl + H2O,
до якої можна застосувати закон еквівалентів:
![]()
Якщо концентрація розчинів є еквівалентною концентрацією (N), то маса речовини (m) в об’ємі розчину (V) дорівнює:
m(NaOH) = N(NaOH) • M(NaOH) • V(NaOH),
m(HCl) = N(HCl) • M(HCl) • V(HCl),
для цієї реакції Е(NaOH)= M(NaOH), Е(HCl) = M(HCl),
і вираз закону еквівалентів приймає вигляд:
V (NaOH) • N (NaOH) = V (HCl) • N (HCl)
N (HCl) = V (NaOH) • N (NaOH) / V (HCl)
Таким чином, для визначення еквівалентної концентрації кислоти необхідно знати концентрацію лугу і об’єми розчинів кислоти і луги, що вступили в реакцію.
Фізико-хімічні методи: фотоколориметричний, спектрофотометричний, атомно-абсорбційний, рефрактометричний, поляриметричний, потенціометричний, хроматографічний, радіометричний. Детально методи визначення складу розчинів розглянуті в курсі аналітичної хімії.
Способи приготування розчинів
1. За точною наважкою вихідної речовини. Розраховують масу наважки речовини, необхідну для приготування розчину заданої концентрації в заданому об'ємі розчину. Масу наважки речовини, взяту на аналітичних вагах з точністю 0,0002 г, кількісно (повністю) переносять у мірну колбу заданої місткості, розчиняють у невеликому об'ємі води, доводять до мітки дистильованою водою.
2. Розведенням заздалегідь приготованого розчину з відомою концентрацією. Розраховують масу речовини в розведеному розчині, потім масу і об'єм концентрованого розчину, що містить дану масу речовини. Мірної піпеткою відбирають розрахований об’єм концентрованого розчину, переносять у мірну колбу і розбавляють дистильованою водою до необхідного об'єму.
3. З фіксаналу. Фіксанал - це герметично запаяна скляна ампула з точно взятою наважкою сухої речовини або точним об'ємом кислоти. У цьому випадку досягається найвища точність приготування. Але через високу вартість фіксаналів, розчини на їх основі готують в рідкісних випадках. Для цього вміст ампули кількісно переносять у мірну колбу заданого об'єму, розбиваючи ампулу об вкладений у лійку бойок, другим бойком розбивають верхнє заглиблення ампули, за допомогою промивалки через отвір ретельно промивають ампулу. Для промивання рекомендується не менше, ніж 6-кратний об'єм води (в порівнянні з місткістю ампули). Розчин доводять до мітки дистильованою водою і перемішують.
Експериментальна частина
1.Приготування розчину із заданою масовою часткою з наважки солі.
Прилади і реактиви: мірна колба на 50 мл , ареометр . Наважка солі.
Мета роботи: навчитися готувати розчин із заданою концентрацією з наважки солі. Оволодіти методикою денсиметрії.
завдання
1) приготувати розчин з наважки солі ;
2 ) виміряти густину приготованого розчину.
3) обчислити молярну , нормальну , моляльну концентрації отриманого розчину, а також його титр і мольну частку солі в розчині.
Вимоги техніки безпеки
При виконанні лабораторної роботи необхідно дотримуватися загальних правил техніки безпеки для хімічних лабораторій. З розчинами кислот і лугів поводитися обережно, при потраплянні їх на руки або одяг слід змити відразу ж великою кількістю води. Осколки скла прибирати або щіткою, або ганчірочкою або серветкою.
Порядок виконання експерименту
-
Отримати у викладача завдання на виконання досліду.
-
Розрахувати, скільки солі та води потрібно для приготування розчину заданої концентрації загальним об'ємом 50 мл. Використовувати значення густини знайдене по таблиці 1, ρтеорет.
-
Необхідну кількість солі перенести в мірну колбу. Невеликими порціями вливати воду в колбу при постійному перемішуванні. Після розчинення солі довести розчин до мітки.
-
Отриманий розчин перелити в циліндр (на 50 мл) і ареометром виміряти його густину. Якщо показання ареометра не збігаються з табличними даними, то масову частку визначити методом інтерполяції. Метод інтерполяції полягає у визначенні проміжного, між табличними, значення шуканої величини.
Припустимо, що за допомогою ареометра визначено густину розчину хлориду натрію 1,081. За методом інтерполяції розрахунок проводять у наступному порядку.
1) По таблиці густин знаходять менше і більше значення масової частки NaCl і густини розчинів:
менше значення ω = 10%, менше значення густини = 1,0742 г / мл;
більшого значення ω = 12%, більше значення густини = 1,0895 г / мл.
2) Знаходять різницю між табличними значеннями густин і концентрацій:
1,0895 - 1,0742 = 0,0153 (г / мл),
10 - 12 = 2 (%).
3) Знаходять різниця між значенням густини, визначеної ареометром, і меншим табличним: 1,081-1,0742 = 0,0068 (г / мл).
4) Складають пропорцію і вирішують її:
2 (%) - 0,0153 (г / мл)
х - 0,0068 (г / мл)
х = 2 · 0,0068 / 0,0153 = 0,89 %
5) Знайдене число додають до меншого табличного значення масової частки і отримують масову частку NaCl в розчині з густиною 1, 081:
10 + 0,89 = 10,89 %.
Оформлення досліду в робочому зошиті
1) Назва досліду
2 ) Вихідні дані
3) Розрахунок маси солі
4 ) Значення густини приготованого розчину , ρ практ .
5 ) Розрахунок похибки експерименту .
![]() (абсолютна похибка)
(абсолютна похибка)
![]() ( відносна похибка )
( відносна похибка )
3) Використовуючи величину густини розчину і відсоткову концентрацію(%), обчислити молярну, нормальну, моляльну концентрації отриманого розчину, а також його титр і мольну частку солі в розчині. Повинні бути приведені повні розрахунки: з назвами концентрацій, формулами для розрахунку концентрацій, значеннями, що використовуються для розрахунку величин та зазначенням одиниць виміру (розмірності) . Отримані результати подати у вигляді таблиці 2 .
Таблиця 2
|
Розчин |
Концентрації |
|||||||
|
Маса солі, г |
Маса води,г |
ρтеорет., г/мл |
% |
СМ, моль/л |
N, моль/л |
Т, г/мл |
Сm, моль/кг |
ω |
|
|
|
|
|
|
|
|
|
|
7 ) Висновок:
2. Приготування розчину хлороводневої кислоти заданної концентрації з концентрованого розчину кислоти (35%), визначення точної концентрації розчину титруванням.
Прилади і реактиви: лійка, мірний циліндр, мірна колба на 50 мл, піпетка на 10 мл, бюретка, 3 конічні колби, розчин фенолфталеїну, 0,1 н розчин NaOH.
Мета роботи: навчитися готувати розчин із заданою концентрацією методом розведення. Оволодіти методом визначення концентрації титрування.
Вимоги техніки безпеки
Під час роботи з мінеральними кислотами слід дотримуватись правил техніки безпеки: використовувати гумові рукавички і захисні окуляри, доливати відміряну циліндром кислоту у воду тоненьким струменем при постійному помішуванні. Якщо додавати воду до кислоти, то сильний розігрів суміші може викликати розбризкування кислоти і призвести до опіків. При сильному розігріванні суміші процес переривають для охолодження. Кислоту, що потрапила на підлогу і столи, засипають піском, нейтралізують натрію або кальцію карбонатом. Кислоту на одязі змивають великою кількістю води, нейтралізуючи розчином амоніаку або натрію гідрокарбонату.
Розчиняючи у воді луги (калію і натрію гідроксиди), користуються захисними окулярами і гумовими рукавичками. Ці речовини викликають хімічні опіки, тому брати їх руками заборонено!
Завдання
1) Приготувати розчин хлороводневої кислоти заданої концентрації з концентрованого розчину кислоти (35%).
2) Визначити методом титрування точної концентрацію приготованого розчину.
Порядок виконання експерименту
-
Отримати у викладача завдання на виконання досліду.
-
Обчислити об’єм концентрованого розчину кислоти, необхідний для приготування 50 мл заданого розчину.
-
Мірним циліндром або мірною бюреткою відміряти необхідний об’єм конц. розчину HCl . Налити в мірну колбу близько половини необхідної води. Вилити кислоту у мірну колбу з водою. Двічі обполоснути циліндр дистильованою водою, злити воду в ту ж колбу.
-
Вміст колби долити до мітки водою. Коли рівень рідини буде нижче мітки на 0,5-1 см , додавати воду слід по краплях з крапельниці. Розбавлення можна вважати закінченим, коли нижній рівень меніска рідини торкнеться мітки на колбі.
-
Закрити колбу пробкою і перемішати розчин, багаторазово перевертаючи колбу. Приготований розчин використовувати для титрування.
-
У мірну бюретку, закріплену в штативі, налити розчин лугу з еквівалентною концентрацією 0,1 моль / л ( 0,1 н . ). Цей розчин називається робочим розчином.
-
У три конічні колби набрати за допомогою мірної піпетки по 10 мл розчину HCl, приготованому раніше, додати в кожну колбу по одній краплі індикатора фенолфталеїну.
-
З бюретки повільно (по краплях) додавати розчин лугу до розчину кислоти до зміни забарвлення індикатора. По закінченні титрування записати об’єм лугу, що пішов на титрування.
-
Дослід повторити ще два рази, кожного разу заздалегідь доливаючи розчин лугу в бюретку до нульової поділки.
-
Розрахувати середній об’єм лугу, що пішов на титрування, і еквівалентну концентрацію кислоти. Обчислити титр розчину.
-
Зіставити концентрацію приготованого розчину, знайдену методом титрування, із заданим значенням. Розрахувати похибку, допущену при приготуванні розчину, у висновку вказати причини похибки.
Оформлення досліду в робочому зошиті
1) Назва досліду
2 ) Вихідні дані
3) Розрахунок об’єму конц. кислоти
4 ) Результати титрування та розрахунок концентрації HCl.
5 ) Розрахунок похибки експерименту .
=Nпракт- Nтеорет(абсолютна похибка)
δ = · 100%/ Nтеорет ( відносна похибка )


