
- •Поверхневі явища та дисперсні системи
- •Лабораторна робота № 1 «адсорбція»
- •Стислі теоретичні відомості
- •Робота 1.1. Адсорбція органічної кислоти вугіллям з водного розчину Хід виконання роботи
- •Питання до лабораторної роботи
- •Лабораторна робота № 2 «поверхневий натяг. Адсорбція на рідкій поверхні»
- •Стислі теоретичні відомості
- •Методи визначення поверхневого натягу
- •Метод підрахунку крапель
- •Метод максимального тиску газового пухирця (метод Ребіндера)
- •Робота 2.1. Адсорбція на поверхні рідини
- •Хід виконання роботи
- •Робота 2.2. Визначення питомої поверхні адсорбента
- •Хід виконання роботи
- •Питання до лабораторної роботи
- •Лабораторна робота № 3 «теплота змочування»
- •Стислі теоретичні відомості
- •Робота 3.1. Визначення природи поверхні гідрофільних та гідрофобних речовин калориметричним методом
- •Хід виконання роботи
- •Питання до лабораторної роботи
- •Лабораторна робота № 4 «седиментація»
- •Стислі теоретичні відомості
- •Робота 4.1. Седиментаційний аналіз суспензії
- •Хід виконання роботи
- •Питання до лабораторної роботи
- •Лабораторна робота № 5 «в’язкість»
- •Стислі теоретичні відомості
- •Робота 5.1. Дослідження в’язкості структурованих розчинів
- •Хід виконання роботи
- •Питання до лабораторної роботи
- •Таблиця 5.4. Значення констант k та рівняння Марка–Куна–Хаувінка для деяких систем полімер – розчинник
- •Хід виконання роботи
- •Таблиця 5.5. Дані для приготування досліджуваних розчинів
- •Таблиця 5.6. Експериментальні дані та результати розрахунків
- •Питання до лабораторної роботи
- •Лабораторна робота № 6 «одержання та коагуляцiя золів»
- •Стислі теоретичні відомості
- •Робота 6.1. Приготування золів
- •Хід виконання роботи
- •1. Фiзична конденсацiя (замiна розчинника)
- •2. Хiмiчна конденсацiя
- •2.1. Метод окисно-вiдновних реакцiй
- •2.2. Метод реакцiй обмiну
- •2.3. Реакцiї гiдролiзу
- •3. Отримання золю гiдроксиду залiза (III) пептизацiєю
- •3.1. Адсорбцiйна пептизацiя
- •3.2. Диссолюцiйна пептизація
- •4. Одержання емульсiї
- •Робота 6.2. Визначення знаку заряду частинок золів на підставі правила валентності – значності Хід виконання роботи
- •Робота 6.3. Визначення порогу коагуляцiї золю Хід виконання роботи
- •Питання до лабораторної роботи
- •Лабораторна робота № 7 «електрофорез»
- •Стислі теоретичнi вiдомостi
- •Хід виконання роботи
- •Питання до лабораторної роботи
- •Перелік рекомендованої літератури
Хід виконання роботи
Визначення проводиться в широкій пробірці, яку розташовано у термосі. Пробірка закриваться пробкою, в якій закріплено термометр Бекмана (точність вимірювання ±0,01 0С) та мішалку. Прилад для визначення теплових ефектів процесів називається калориметром.
З метою визначення теплоємності калориметра мірним циліндром відміряти в калориметричну пробірку 30 см3 дистильованої води та точно (±0,001 г) зважити на аналітичних терезах ~ 1 г KCl.
Перемішуючи воду мішалкою, зробити 6 вимірів температури з інтервалом 30 секунд за умови встановлення рівномірного ходу температури (температура після кожного вимірювання зростає або зменшується на одну й ту ж величину) і записати в табл. 3.1.
Всипати наважку KCl та енергійно перемішати, продовжуючи записувати температуру в табл. 3.1 з такими самими інтервалами часу (ще 5–7 вимірів після встановлення рівномірного ходу температури).
Побудувати графік температурного ходу для точного визначення Т з урахуванням теплообміну з оточуючим середовищем (рис. 12). Стрибок температури Т визначити екстраполяцією прямих АВ та CD на середину головного періоду ВС.
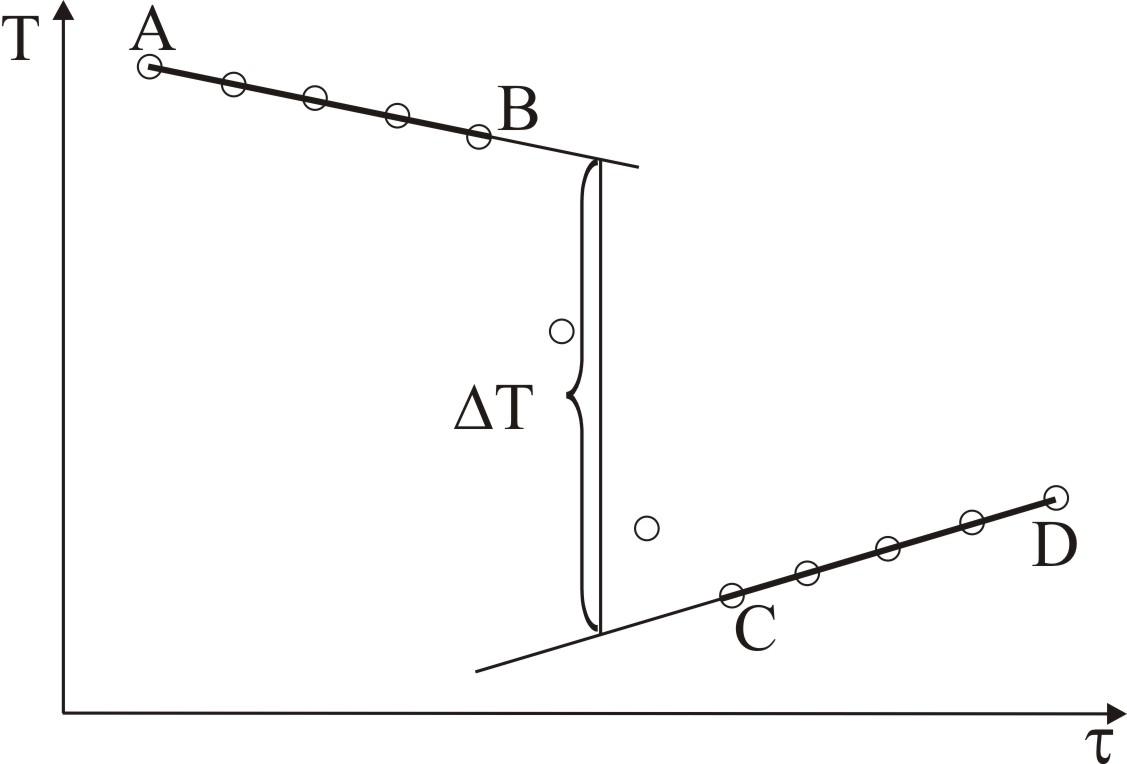
Рис.12. Графік для визначення зміни температури T при розчиненні KCl
На графіку відрізок АВ – попередній період, CD – заключний період, ВС – головний період, тривалість якого визначається крайніми точками В і С, де рівномірний хід температури переривається.
Таблиця 3.1. Результати вимірювань температури при змочуванні речовин
Розраховувати теплоємність калориметра Ск (Дж/К) за формулою:Властивості розчинників при 20 оС
Вода
Бензол
Питома теплоємність С,
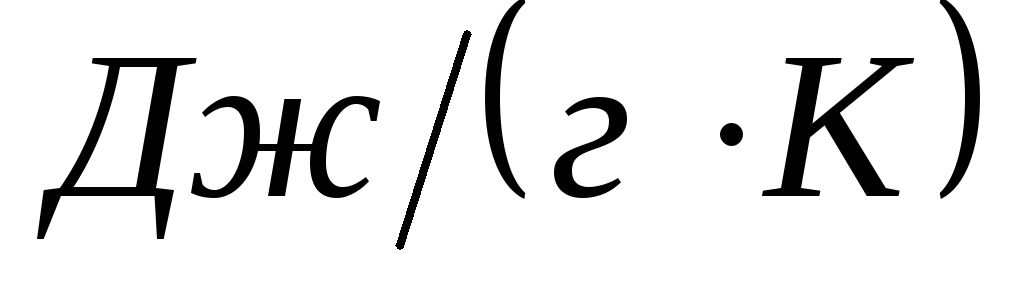
4,184
1,711
Густина , г/см3
0,998
0,879
Об’єм
 ,
см3
,
см3
30
30
Номер
виміру
Покази термометра Бекмана
Вода
Вода
Вода
Бензол
Бензол
KCl
Крохмаль
Вугілля
Вугілля
Крохмаль
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
Т
Ск, Дж/К
Q, Дж
|
|
(3.1) |
де а – наважка солі, г; M – молярна маса KCl, г/моль; QKCl – теплота розчинення KCl, яка складає 17500 Дж/моль; – густина води, г/см3; С – питома теплоємність води, Дж/(гК).
Вилити розчин солі та помити пробірку.
На технічних терезах зважити по дві наважки крохмалю та активованого вугілля масою 2 г кожна.
У вимиту калориметричну пробірку мірним циліндром налити 30 см3 дистильованої води. Перемішуючи воду мішалкою, зробити 5 –7 вимірів температури з інтервалом 30 с після встановлення рівномірного ходу температури. Всипати в пробірку крохмаль та, інтенсивно перемішуючи вміст пробірки, продовжувати записувати температуру з такими самими інтервалами часу до встановлення рівномірного температурного ходу, після чого зробити ще 5–7 вимірів. Покази термометра Бекмана упродовж дослідів записувати в табл. 3.1. Вилити суспензію та помити пробірку.
Аналогічні операції провести з активованим вугіллям. Вилити суспензію вугілля і води та помити пробірку. Витерти пробірку насухо фільтрувальним папером.
У висушену калориметричну пробірку мірним циліндром налити 30 см3 бензолу. Перемішучи бензол мішалкою, зробити 6 вимірів температури з інтервалом 30 с після встановлення рівномірного ходу температури. Засипати в пробірку активоване вугілля і провести вимірювання, аналогічні попереднім дослідам змочування водою. Вилити суспензію вугілля і бензолу у посуд для зливів (у витяжній шафі) та сполоснути пробірку бензолом.
Аналогічні операції провести для дослідження змочування крохмалю бензолом.
Побудувати графіки зміни температури з часом для визначення T. Розраховані значення записати в табл. 3.1.
Розрахувати теплоти змочування за формулою, Дж:
![]() ,(3.2)
,(3.2)
де V – об’єм рідини, см3; – густина рідини, г/см3; C – питома теплоємність рідини, Дж/(г∙К); Ск – теплоємність калориметра, Дж/К; T – зміна температури в ході досліду. При розрахунках теплот змочування у рівняння (3.2) слід підставляти властивості (, C) досліджуваної рідини. Результати обчислень записати в табл. 3.1.
Розрахувати величини коефіцієнтів змочування крохмалю та активованого вугілля як відношення теплот змочування відповідних матеріалів водою та бензолом:
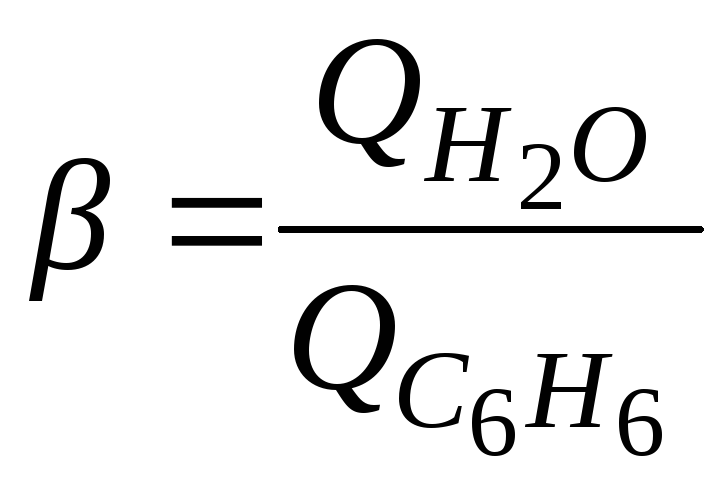 і зробити висновок про природу речовин.
і зробити висновок про природу речовин.
Звіт
Таблиця 3.1
Графіки T = f() для розчинення KCl у воді та змочування досліджуваних порошків рідинами (всього 5 графіків).
Теплоємність калориметра Ск = .... ... Дж/К.
Значення коефіцієнтів змочування крохмалю = ..............; вугілля = ............
Висновок.
