
ХИМИЯ)
.docx
Министерство образования науки РФ
КАЗАНСКИЙ ГОСУДАРСТВЕННЫЙ
АРХИТЕКТУРНО-СТРОИТЕЛЬНЫЙ УНИВЕРСИТЕТ
Кафедра химии
РАСЧЕТНО-ГРАФИЧЕСКАЯ РАБОТА
Выполнил студент
группы 3ПГ-105
Пичкалев А.А.
Проверил: Мурафа Н.К.
Казань, 2013
Билет №9
Задача 1
Решение:
Энергия Гиббиса — критерий самопроизвольного протекания химических реакций.
В
химических процессах одновременно
действуют два противоположных
фактора — энтропийный (![]() )
и энтальпийный (
)
и энтальпийный (![]() ).
Суммарный эффект этих противоположных
факторов в процессах, протекающих при
постоянном давлении и температуре,
определяет изменение энергии
Гиббса (
).
Суммарный эффект этих противоположных
факторов в процессах, протекающих при
постоянном давлении и температуре,
определяет изменение энергии
Гиббса (![]() ):
):
![]()
Из
этого выражения следует, что ![]() ,
то есть некоторое количество
теплоты расходуется на увеличение
энтропии (
,
то есть некоторое количество
теплоты расходуется на увеличение
энтропии (![]() ),
эта часть энергии потеряна для совершения
полезной работы (рассеивается в
окружающую среду в виде тепла), её часто
называют связанной энергией. Другая
часть теплоты (
),
эта часть энергии потеряна для совершения
полезной работы (рассеивается в
окружающую среду в виде тепла), её часто
называют связанной энергией. Другая
часть теплоты (![]() )
может быть использована для совершения
работы, поэтому энергию Гиббса часто
называют также свободной энергией.
)
может быть использована для совершения
работы, поэтому энергию Гиббса часто
называют также свободной энергией.
Характер
изменения энергии Гиббса позволяет
судить о принципиальной возможности
осуществления процесса. При ![]() процесс
может протекать, при
процесс
может протекать, при ![]() процесс
протекать не может. Если же
процесс
протекать не может. Если же ![]() ,
то система находится в состоянии химического
равновесия.
,
то система находится в состоянии химического
равновесия.
2Al + Fe2O3 = 2Fe + Al2O3
G0[Al]=0 потому что простой элемент
G0[Fe2O3]=-740.3 (кДж/моль)
G0[Fe]=0 потому что простой элемент
G0[Al2O3]=-1582.0 (кДж/моль)
ΔGпрям= G0[Al2O3] - G0[Fe2O3] = -1582 + 740,3 = -841(кДж/моль)
ΔGпрям <0, следовательно реакция может протекать самопроизвольно.
ΔGобр= G0[Fe2O3] - G0[Al2O3] = -740,3 +1582 = 841 (кДж/моль)
ΔGпрям >0, следовательно реакция не может протекать самопроизвольно.
Задача 2
Решение:
Энергия Гиббиса — критерий самопроизвольного протекания химических реакций.
В
химических процессах одновременно
действуют два противоположных
фактора — энтропийный (![]() )
и энтальпийный (
)
и энтальпийный (![]() ).
Суммарный эффект этих противоположных
факторов в процессах, протекающих при
постоянном давлении и температуре,
определяет изменение энергии
Гиббса (
).
Суммарный эффект этих противоположных
факторов в процессах, протекающих при
постоянном давлении и температуре,
определяет изменение энергии
Гиббса (![]() ):
):
![]()
Из
этого выражения следует, что ![]() ,
то есть некоторое количество
теплоты расходуется на увеличение
энтропии (
,
то есть некоторое количество
теплоты расходуется на увеличение
энтропии (![]() ),
эта часть энергии потеряна для совершения
полезной работы (рассеивается в
окружающую среду в виде тепла), её часто
называют связанной энергией. Другая
часть теплоты (
),
эта часть энергии потеряна для совершения
полезной работы (рассеивается в
окружающую среду в виде тепла), её часто
называют связанной энергией. Другая
часть теплоты (![]() )
может быть использована для совершения
работы, поэтому энергию Гиббса часто
называют также свободной энергией.
)
может быть использована для совершения
работы, поэтому энергию Гиббса часто
называют также свободной энергией.
Характер
изменения энергии Гиббса позволяет
судить о принципиальной возможности
осуществления процесса. При ![]() процесс
может протекать, при
процесс
может протекать, при ![]() процесс
протекать не может. Если же
процесс
протекать не может. Если же ![]() ,
то система находится в состоянии химического
равновесия.
,
то система находится в состоянии химического
равновесия.
Задача 3
Решение:
Химическим
равновесием называется такое состояние,
когда скорости прямой и обратной реакций
равны. Характеризуется химическое
равновесие константой К, она имеет
вид
aA
+ bB =cC + dD,
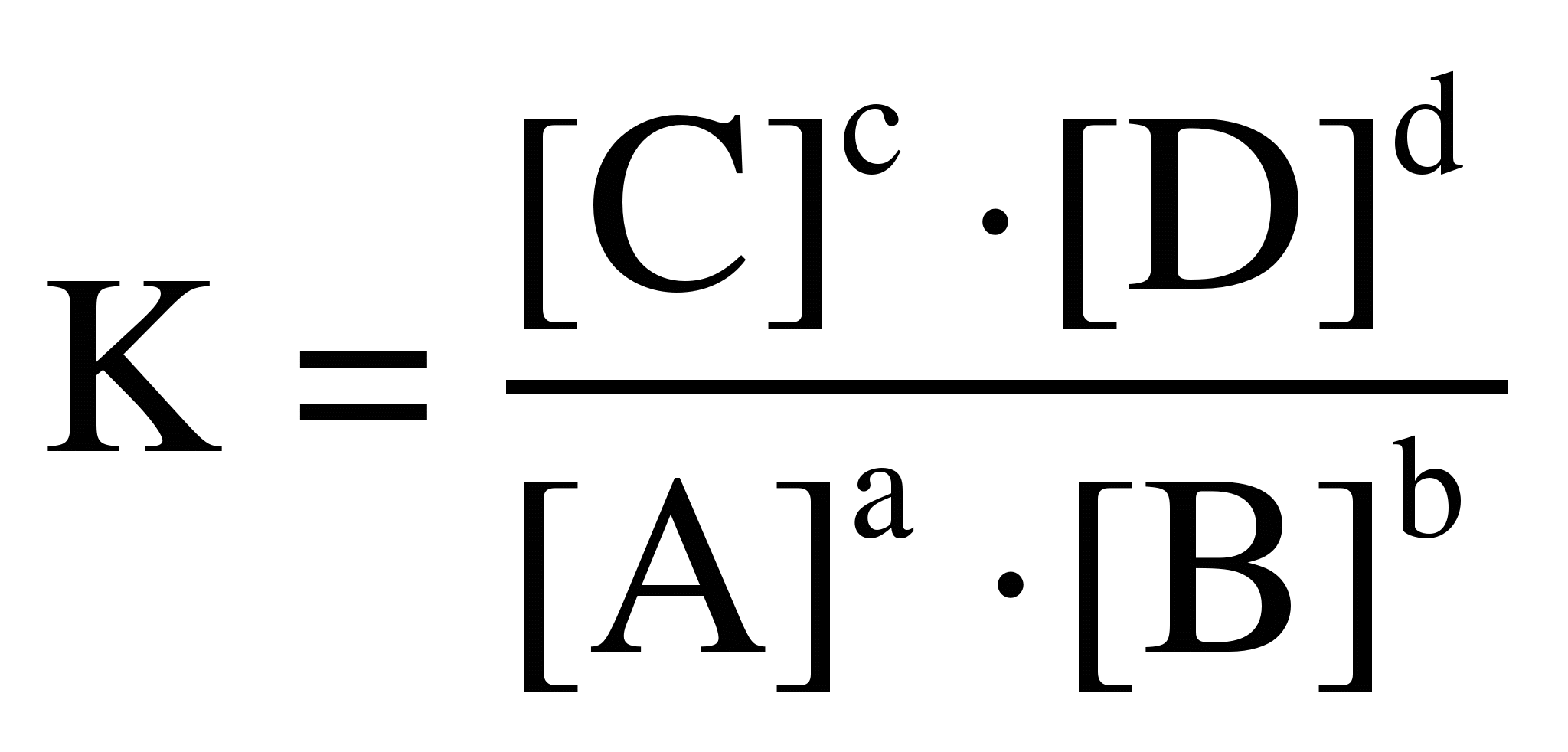 В
условии задачи даны равновесные
концентрации. Поэтому сразу можно
рассчитать константу химического
равновесия для реакции:
2SO2 +
O2
2SO3,
В
условии задачи даны равновесные
концентрации. Поэтому сразу можно
рассчитать константу химического
равновесия для реакции:
2SO2 +
O2
2SO3,
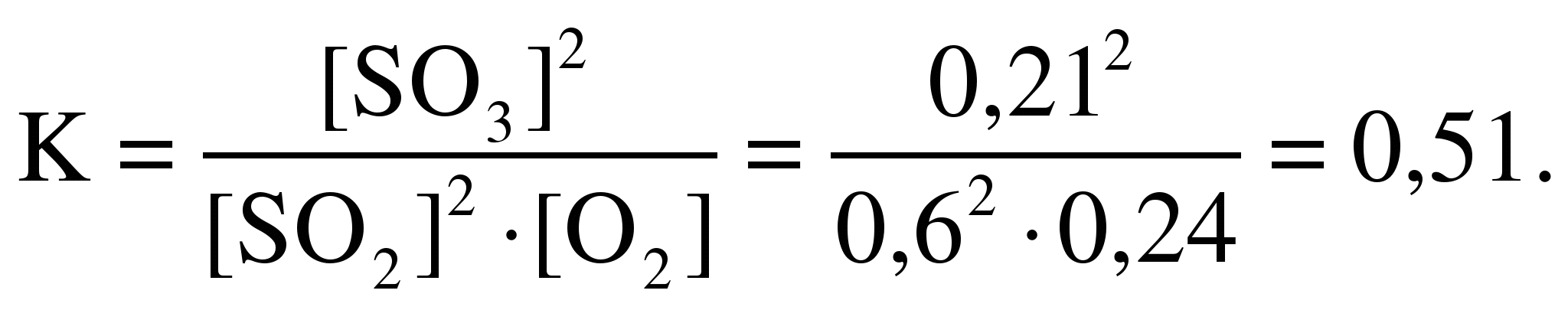 Чтобы
рассчитать исходные концентрации
кислорода и диоксида серы, необходимо
найти, сколько этих компонентов было
израсходовано на получение 0,21 моля
триоксида серы и сложить с равновесными
концентрациями. Согласно уравнению
реакции для получения 2 молей триоксида
серы требуется 2 моля диоксида серы, а
для получения 0,21 моля триоксида серы
Х молей диоксида серы. Отсюда
X
=
Чтобы
рассчитать исходные концентрации
кислорода и диоксида серы, необходимо
найти, сколько этих компонентов было
израсходовано на получение 0,21 моля
триоксида серы и сложить с равновесными
концентрациями. Согласно уравнению
реакции для получения 2 молей триоксида
серы требуется 2 моля диоксида серы, а
для получения 0,21 моля триоксида серы
Х молей диоксида серы. Отсюда
X
= ![]() =
0,21 моля.
Итак,
[SO2]изр. =
0,21 моль/л.
На
получение SO3 было
израсходовано 0,21 моля SO2,
тогда
[SO2]исх. =
[SO2]равн. +
[SO2]изр. =
0,6 + 0,21 = 0,81 моль/л,
[SO2]исх =
0,81 моль/л.
Для
получения 2 молей SO3 требуется
1 моль O2.
=
0,21 моля.
Итак,
[SO2]изр. =
0,21 моль/л.
На
получение SO3 было
израсходовано 0,21 моля SO2,
тогда
[SO2]исх. =
[SO2]равн. +
[SO2]изр. =
0,6 + 0,21 = 0,81 моль/л,
[SO2]исх =
0,81 моль/л.
Для
получения 2 молей SO3 требуется
1 моль O2.
Для
получения 0,21 моля SO3
X молей O2.
X
= ![]() =
0,105 молей.
Итак,
[O2]изр. =
0,105 моль/л.
[O2]исх. =
[O2]равн. +
[O2]изр. =
0,24 + 0,105 = 0,345 моль/л.
=
0,105 молей.
Итак,
[O2]изр. =
0,105 моль/л.
[O2]исх. =
[O2]равн. +
[O2]изр. =
0,24 + 0,105 = 0,345 моль/л.
Задача 4
Решение:
Гидролиз солей — разновидность реакций гидролиза, обусловленного протеканием реакций ионного обмена в растворах (преимущественно, водных) растворимых солей-электролитов. Движущей силой процесса является взаимодействие ионов с водой, приводящее к образованию слабого электролита.
Существует 4 вида гидролиза:
-
1. Гидролиз соли слабой кислоты и сильного (гидролиз по аниону);
-
2. Гидролиз соли сильной кислоты и слабого основания (гидролиз по катиону);
-
3. Гидролиз соли слабой кислоты и слабого основания;
-
4. Гидролиз соли сильной кислоты и сильного основания .
KOH — сильное основание
H2S — слабая кислота
H2CrO4 — сильная кислота
Соль [K2S] образованна сильным основанием и слабой кислотой.
K2S + 2HOH = H2S + 2KOH
Соль [K2S] образованна сильным основанием и слабой кислотой, она подвергается ступенчатому гидролизу:
1 ступень
K2S + HOH = K(HS) + KOH
2K+
+ S2-
+ HOH = K+
+(HS)-
+ K+
+ OH-
На первой ступени получили кислую соль [K(HS)]
2 ступень
K(HS) + HOH = H2S + KOH
K+
+ HS-
+
HOH = H2S
+ K+
+ OH-
В результате двухступенчатого гидролиза в растворе остается слабый электролит и свободные гидрооксильные группы солей, следовательно реакция среды щелочная , р(Н)>7.
Соль [H2CrO4] образовнна сильным основанием и сильной кислотой.
K2CrO4 + 2HOH = H2CrO4 + 2KOH
2K
+
CrO4
+ 2HOH = 2H
+
CrO4
+
2K
+ 2OH
Соль сильной кислоты и сильного основания не подвергается гидролизу, следовательно реакция среды нейтральна, р(Н)=7.
