
Физика. Лекции / Lect11
.docОсновы статистической физики
Все тела состоят из огромного числа частиц, движение которых хаотично и сопровождается массовыми столкновениями. Тем не менее в таком хаотическом движении устанавливаются стабильные закономерности статического характера.

Экспериментальная установка представляет собой два находящихся в вакууме жестко связанных между собой коаксиальных цилиндра, по оси которых натянута платиновая нить, покрытая серебром. Малый цилиндр радиуса r имеет вертикальную щель. Если по нити пропустить электрический ток, она будет нагреваться, серебро будет испарятся, его атомы будут пролетать через щель и осаждаться на большом цилиндре радиуса R, образуя изображение узкой щели в виде узкой полоски почернения серебра. Картина изменится, если установку привести во вращение с угловой скоростью . Изображение щели будет размыто с ярко выраженным максимумом. Это говорит о том, что атомы серебра имеют неодинаковые скорости, вследствие этого они имеют разные времена пробега и, поскольку цилиндр вращается, будут достигать его поверхности в разных точках. Наличие максимума в почернении, говорит о том, что имеется некоторая наиболее вероятная скорость атомов серебра. При этом простые вычисления дают возможность оценить скорость v атомов серебра. Приравнивая время пролета атомов между поверхностями цилиндров и время, в течение которого точки поверхности большого цилиндра сместились на x получим:
![]() .
.
Скорость атомов
серебра оказалась очень большой, порядка
![]() .
.
Максвелловское распределение молекул по их скоростям и энергиям
-
Возьмем идеальный газ. В результате столкновений молекул газа, их скорости все время изменяются, но в газе создается некоторое стационарное распределение молекул по их скоростям .
Пусть температура газа T = 300K.
|
Интервал скоростей |
Доля молекул, имеющих скорости в заданном интервале |
|
|
|
Эта таблица называется - распределением молекул по скоростям. Из этого распределения видно, что существует какая-то наиболее вероятная скорость.
-
Максвелл в 1860 г. получил формулу, которая описывает распределение молекул по скоростям:
Максвелловское распределение молекул
по их скоростям
![]() -
-
где n – число молекул в единице объема,
dn – число молекул в единице объема, имеющих скорость в интервале от v до v + dv,
m – масса молекулы,
k – постоянная Больцмана,
T – температура.
-
Построим кривые Максвелла для двух температур (
 ).
).

Физический смысл
кривой Максвелла:
![]() - число молекул, имеющих скорости в
единичном интервале скоростей. Возьмем
узкую полоску, которую можно считать
прямоугольной. Ее площадь равна :
- число молекул, имеющих скорости в
единичном интервале скоростей. Возьмем
узкую полоску, которую можно считать
прямоугольной. Ее площадь равна :
![]() .
.
Тогда площадь под всей кривой Максвелла равна n.
-
Для того, чтобы придать вероятностный характер распределению Максвелла, введем новую функцию :
![]() - функция
распределения Максвелла молекул по их
скоростям.
- функция
распределения Максвелла молекул по их
скоростям.
График этой функции
имеет аналогичный вид, но теперь площадь
под кривой
![]() равна 1.
равна 1.
![]() - имеет смысл
вероятности того, что молекула имеет
скорость в интервале от
- имеет смысл
вероятности того, что молекула имеет
скорость в интервале от
![]() до
до
![]() .
Согласно определению функции
.
Согласно определению функции
![]() имеем
имеем
![]() , откуда видно, что
, откуда видно, что
![]() - плотность
вероятности
того, что
молекула имеет скорость в интервале от
- плотность
вероятности
того, что
молекула имеет скорость в интервале от
![]() до
до
![]() .
.
Это очень важная
величина в теории вероятности, позволяющая
вычислять среднее значение любой
физической величины, являющейся функцией
скорости
![]() .
.
-
От распределения молекул по скоростям
 можно перейти к распределению молекул
по их кинетической энергии
можно перейти к распределению молекул
по их кинетической энергии
 .
Для этого надо в распределении молекул
по скоростям выразить
.
Для этого надо в распределении молекул
по скоростям выразить
 и
и
 через
через
 и
и
 .
.
![]() ,
,
![]() .
.
Производя вычисления, получим
Максвелловское расрпеделение молекул
по их кинетическим энергиям.
 -
-

Аналогично вводится :
![]() - функция
распределения Максвелла молекул по их
энергиям.
- функция
распределения Максвелла молекул по их
энергиям.
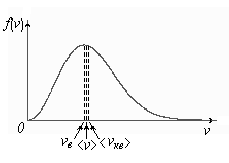
Характерные скорости молекул идеального газа .
-
 - наиболее
вероятная скорость
молекул
- наиболее
вероятная скорость
молекул
Это скорость
молекул, при которой функция распределения
![]() имеет максимум. Возьмем производную
от
имеет максимум. Возьмем производную
от![]() ,
и приравняв ее нулю, получим уравнение
для нахождения
,
и приравняв ее нулю, получим уравнение
для нахождения
![]() :
:
![]() ,
,
![]() ,
,
![]() ,
,
![]() -
-
- наиболее вероятная скорость молекул
-
<vкв> - средняя квадратичная скорость молекул.
Для нахождения <vкв> можно воспользоваться выражением для средней кинетической энергии <> поступательного движения молекул
![]() ,
,
 ,
,
или вычислить интеграл
![]()
![]() - средняя
квадратичная скорость молекул
- средняя
квадратичная скорость молекул
-
<v> - средняя арифметическая скорость молекул.
![]()
![]() - средняя
арифметическая скорость молекул
- средняя
арифметическая скорость молекул
Воспользовавшись
соотношением
![]() ,
формулы для характерных скоростей
молекул можно представить в виде
,
формулы для характерных скоростей
молекул можно представить в виде
![]() - наиболее
вероятная скорость молекул,
- наиболее
вероятная скорость молекул,
![]() - средняя
квадратичная скорость молекул,
- средняя
квадратичная скорость молекул,
![]() - средняя
арифметическая скорость молекул.
- средняя
арифметическая скорость молекул.
Распределение Больцмана молекул по их потенциальным энергиям
Если газ находится во внешнем силовом поле, то частицы газа обладают потенциальной энергией п . Рассмотрим распределение молекул идеального газа по высоте в однородном гравитационном поле. В этом случае для газа имеет место барометрическая формула:
![]() ,
,
где
![]() - давление газа на поверхности Земли,
- давление газа на поверхности Земли,
![]() - давление газа на высоте h.
- давление газа на высоте h.
С учетом того, что
![]() ,
,
![]() ,
,
![]() ,
,
получим распределение молекул по высоте в однородном гравитационном поле:
![]() .
.
Больцман показал, что полученное распределение применимо к идеальному газу, находящемуся в любом силовом поле:
распределение Больцмана молекул по
их потенциальным энергиям
![]() -
-
Если идеальный газ находится в силовом поле, то реализуются, вообще говоря, оба распределения: распределение Максвелла молекул по их кинетическим энергиям и распределение Больцмана молекул по их потенциальным энергиям.
Для этого надо объединить оба распределения:
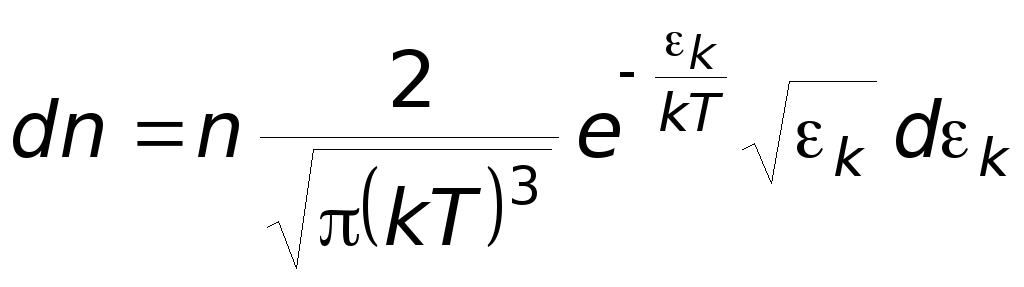 - распределение
Максвелла,
- распределение
Максвелла,
![]() - распределение
Больцмана,
- распределение
Больцмана,
В результате получим
распределение Максвелла-Больцмана.
 -
-
