
- •Содержание
- •Термодинамика электрохимических процессов. Электродвижущие силы и электродные потенциалы Термодинамика электрохимических систем
- •Классификация электродов
- •Электроды первого рода
- •Электроды второго рода
- •Окислительно-восстановительные электроды
- •Газовые электроды
- •Электрохимические цепи
- •Экспериментальная часть Лабораторная работа 1 определение электродвижущих сил гальванических элементов
- •Методика эксперимента
- •Отчет по работе
- •Лабораторная работа 2 измерение температурного коэффициента гальванического элемента и расчёт термодинамических величин
- •Методика эксперимента
- •Отчет по работе
- •Определение коэффициента активности измерением эдс гальванических элементов
- •Методика эксперимента
- •Отчет по работе
- •Определение pН буферного раствора с помощью хингидронного электрода
- •Методика эксперимента
- •Отчет по работе
- •Потенциометрическое титрование
- •Методика эксперимента
- •Отчет по работе
- •Библиографический список
Отчет по работе
Отчет должен содержать:
– теоретическое обоснование экспериментальной части работы;
– методику эксперимента;
– экспериментально измеренные значения электродвижущей силы для каждого из растворов;
– график зависимости
E+0,1183lgC=f(![]() )
иE+0,1183lgC=f(C);
)
иE+0,1183lgC=f(C);
– расчёт коэффициентов активности для всех растворов соляной кислоты;
– сравнение полученных результатов со справочными данными и обоснование ошибки измерения всех величин.
Лабораторная работа 4
Определение pН буферного раствора с помощью хингидронного электрода
ЦЕЛЬ РАБОТЫ: определение pH и буферной ёмкости раствора.
ПРИБОРЫ И РЕАКТИВЫ: иономер; каломельный электрод; растворы ацетата натрия и уксусной кислоты; хингидрон; 0,2н раствор соляной кислоты; две колбы на 500 мл; пипетки Мора на 100 и 20 мл.
Методика эксперимента
Для определения pH раствора составляют элемент:
Hg | Hg2Cl2, KCl(нас) | исследуемый раствор, хингидрон | Pt
Исследуемый раствор и KCl соединяют солевым мостиком, приготовленным из раствора хлорида калия в агар-агаре. Для определения ЭДС используют иономер.
В первом случае расчёт ведётся по уравнению:
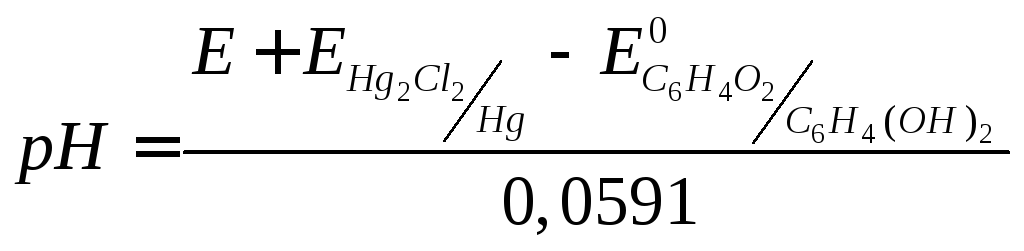 .
.
Во втором – отсчёт проводится непосредственно по шкале прибора.
Для приготовления исследуемого раствора в колбе 1 готовят 200 мл буферного раствора на основе ацетата натрия и уксусной кислоты с концентрацией, указанной преподавателем. Затем во вторую колбу переносят пипеткой 100 мл раствора из первой и добавляют 100 мл воды, то есть разбавляют в два раза. После тщательного перемешивания из колбы 2 отбирают 20 мл в специальный сосуд, куда добавляют хингидрон (из расчёта 0,1 г на 40 мл раствора). Содержимое сосуда перемешивают стеклянной палочкой и затем измеряют ЭДС. Затем в колбу 2 добавляют 10 мл раствора из колбы 1 и 10 мл 0,2н раствора соляной кислоты. После перемешивания содержимого колбы 2 отбирают 70 мл для определения ЭДС. Данную операцию проводят не менее 5 раз. Полученные и расчётные данные представляют по форме таблицы 3.
Таблица 3
|
C1, колба 1 |
C2, колба 2 |
Объём 0,2 нHCl,мл |
Число молей HCl, приходящихся на 1 лраствора |
E, В |
pH |
Буферная ёмкость раствора |
|
|
|
|
|
|
|
|
На основании
экспериментальных данных строят график
зависимости n – pH, где n
- число молей
HCl, приходящихся на 1 л
раствора с концентрацией, равной
концентрации раствора в колбе 2. По углу
наклона определяют буферную ёмкость
![]() ,
т.е. число молей HCl, необходимое для
изменения pH раствора на единицу.
,
т.е. число молей HCl, необходимое для
изменения pH раствора на единицу.
Для выполнения работы можно использовать непосредственное измерение рН иономером при условии его предварительной калибровки по буферным растворам методом двух или трех точек.
Отчет по работе
Отчет должен содержать:
– теоретическое обоснование экспериментальной части работы;
– методику эксперимента;
– экспериментально измеренные значения электродвижущей силы для каждого из растворов;
– график зависимости ЭДС от концентрации;
– график зависимости n – pH;
– определение буферной емкости из графической зависимости.
Лабораторная работа 5
