
5.2. Механизм ориентирующего влияния заместителей
Распределение электронной плотности в молекулах однозамещенных производных бензола до начала реакции замещения объясняет характер ориентирующего влияния заместителей в статическом состоянии (статические факторы).
Однако в момент реакции электрофильного замещения под влиянием атакующей частицы происходит значительное перераспределение электронной плотности, которое часто оказывает решающее влияние на скорость и направление реакции.
Причем динамические факторы, как правило, имеют более существенное значение, чем статические
В тех случаях, когда статические факторы способствуют иной ориентации, чем динамические, определяющая роль принадлежит факторам динамическим.
Такое «несогласованное действие» статических и динамических факторов наблюдается при наличии в качестве заместителей ароматического ядра, например, галогенов.
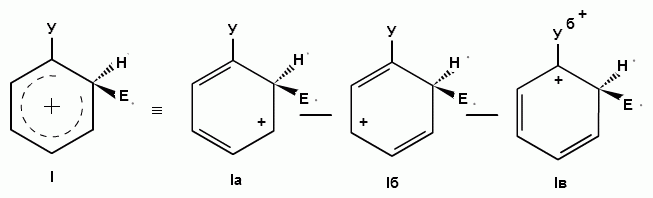
Главной стадией, определяющей направление и скорость реакций электрофильного замещения является стадия образования сигма-комплекса.
Для объяснения влияния различных заместителей на скорость и направление реакций электрофильного замещения в монозамещенных бензолах необходимо учитывать энергетическую выгодность образования того или иного ơ-комплекса, т.е. механизм реакции.
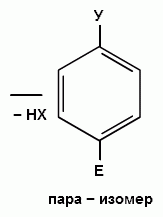
При взаимодействии монозамещенных бензолов с электрофильным реагентом возможно, хотя и с различной степенью вероятности, образование трех изомерных продуктов: орто-, мета-, пара-изомеров:



Электронодонорные заместители, повышающие электронную плотность бензольного кольца, особенно орто- и пара-положений, облегчают образование π-комплекса и способствуют стабилизации ơ-комплексов в орто- и пара-положениях, что приводит к образованию орто- и пара-изомеров.
Электроноакцепторные заместители, понижающие электронную плотность бензольного кольца, особенно орто- и пара-положений, сильно затрудняют образование π-комплекса и стабилизируют ơ-комплекс в мета-положении, что приводит к образованию мета-изомера.
Это можно наглядно показать при использовании резонансных граничных структур.
При этом следует учитывать следующие правила:
1) из всех возможных резонансных граничных структур более энергетически выгодны те, в которых за счет заместителя У возникает дополнительная возможность делокализации положительного заряда, привнесенного электрофильной частицей Е+;
2) чем больше можно написать резонансных граничных структур, тем более стабилен будет соответствующий сопряженный карбкатион (ơ-комплекс).








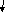
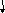













Ϭ-комплексы Резонансные граничные структуры
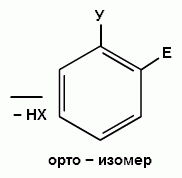
Рис. 1. Заместители первого рода:
1 тип: +I, М=0 (−СН3, −СН2R, −CHR2, −CR3)




































Ϭ-комплексы Резонансные граничные структуры
Рис. 2. Заместители первого рода
2 тип: +М; -I (+M > -I )
3 тип: +M; -I (+M < -I)
3 тип: Исключение составляют галогены:
являются дезактивирующими (- I –эффект - скорость),
но ориентируют в орто- и пара-положения (+М-эффект - ориентация)























Ϭ-комплексы Резонансные граничные структуры
Рис.3. Заместители второго рода
1 тип: -I, M = 0
2 тип: -I, -М
3 тип: -I M=0 (заместители смешанного действия)
Дополнительный материал
Один из самых простых примеров – свойства алкильных групп, обладающих положительным индуктивным (+I) эффектом. Индуктивный эффект проявляется тем сильнее, чем меньше расстояние. При замещении в орто- или пара-положения среди соответствующих граничных структур есть по одной особенно энергетически выгодной. В них донорная группировка непосредственно связана с углеродом, несущим положительный заряд. В случае замещения в мета-положение такой энергетически выгодной структуры нет. Группировки, обладающие +I эффектом, - орто- и пара-ориентанты.

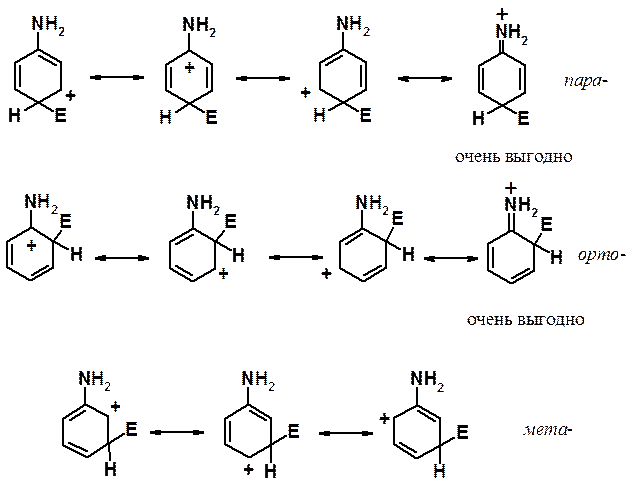
Рассмотрим свойства группировок, обладающих +М эффектом (способных отдавать электронную плотность за счет эффекта сопряжения) на примере амино-группы.
При атаке в орто- и пара-положения соответствующие s-комплексы могут быть изображены с помощью четырех граничных структур. Одна из них энергетически очень выгодна, поскольку она представляет собой не карбониевый, а аммониевый катион. При реакции в мета-положение структуру такого типа написать не удается. Аммониевые катионы очень устойчивы, достаточно вспомнить о существовании большого числа неорганических солей (например, NH4Cl), стабильных при комнатной температуре. Кроме того, при оценке стабильности ионов (молекул и свободных радикалов) с использованием граничных структур применяется простое правило: чем больше граничных структур можно написать, тем стабильнее ион (молекула, свободный радикал). Отчетливо видно, что при вхождении электрофила в орто- и пара-положения соответствующие s-комплексы показаны с помощью четырех структур, а при реакции в мета-положение граничных структур только три.
Таким образом, донорные заместители активируют все положения кольца к реакции ароматического электрофильного замещения, но орто- и пара-положения активированы в большей степени, чем мета-.
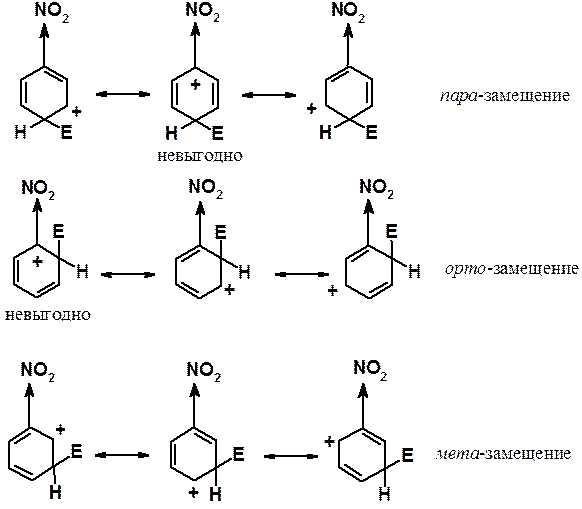
Акцепторные заместители (дезактивирующие) направляют входящий заместитель в мета-положение кольца. Доказательство аналогично изложенному выше. При протекании реакции в орто- или пара-положения есть по одной очень богатой энергией граничной структуре. В них акцептор непосредственно связан с атомом углерода, несущим положительный заряд. Как было указано, индуктивный эффект проявляется на небольших расстояниях. В этих граничных структурах акцептор сильнее всего уменьшает электронную плотность на атоме углерода, т.е. еще больше увеличивает на нем положительный заряд. Энергия орто- и пара-s-комплексов выше, чем у интермедиата реакции, протекающей в мета-положение. В последнем случае нет особенно невыгодных по энергии структур.
Акцепторные (дезактивирующие) заместители дезактивируют все положения бензольного цикла в реакциях ароматического электрофильного замещения, но мета-положение дезактивировано в меньшей степени, чем орто- и пара-. Следовательно, акцепторы являются мета-ориентантами.
В некоторых изданиях орто-, пара-ориентанты называют ориентантами I рода, мета-ориентанты – ориентантами II рода.
Заместители,
замедляющие реакцию (дезактивирующие)
и направляющие замещение в мета-
положения, называются ориентантами
второго рода.
К
ним относятся:
-CHHal2,
-СHal3, -NR3(+), -C(O)H, -C(O)R, -CN, -SO3H, C(O)OH, -C(O)OR, NO2
(Hal
- галоген = F, Cl, Br, I).
Важно
заметить, что просто галогены относятся
к ориорто-пара-ориентантам, потому что
они хотя и дезактивируют ядро, но из-за
мезомерного эффекта, все же напраляют
замещение в орто- и пара положение.
Для
объяснения ориентации замещения
рассмотрим строение сигма-комплексов
при атаке в орто-, мета- и пара-положения
монозамещенного бензола (как уже
отмечалось, образование сигма-комплексов
обычно является скоростьопределяющей
стадией электрофильного замещения;
cледовательно, легкость их образования
должна определять легкость протекания
замещения в данное положение) :
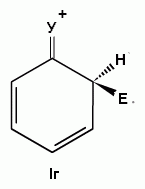
 Если
группа Z - донор электронов (неважно,
индуктивный или мезомерный) , то при
орто- или пара-атаке она может принимать
непосредственное участие в делокализации
положительного заряда в сигма-комплексе
(структуры III, IV, VI, VII). Если же Z - акцептор
электронов, то указанные структуры
будут энергетически невыгодными (из-за
наличия частичного положительного
заряда на атоме углерода, связанном с
электроноакцепторным заместителем) и
в этом случае оказывается предпочтительной
мета-атака, при которой не возникает
таких структур.
Приведенное
выше объяснение дано на основании так
называемого динамического эффекта, т.
е. распределения электронной плотности
в реагирующей молекуле. Ориентацию
электрофильного замещения в монозамещенных
бензолах можно объяснить и с позиции
статических электронных эффектов -
распределения электронной плотности
в нереагирующей молекуле. При рассмотрении
смещения электронной плотности по
кратным связям можно заметить, что при
наличии электронодонорного заместителя
более всего повышена электронная
плотность в орто- и пара- положениях, а
при наличии электроноакцепторного
заместителя эти положения наиболее
обеднены электронами:
Если
группа Z - донор электронов (неважно,
индуктивный или мезомерный) , то при
орто- или пара-атаке она может принимать
непосредственное участие в делокализации
положительного заряда в сигма-комплексе
(структуры III, IV, VI, VII). Если же Z - акцептор
электронов, то указанные структуры
будут энергетически невыгодными (из-за
наличия частичного положительного
заряда на атоме углерода, связанном с
электроноакцепторным заместителем) и
в этом случае оказывается предпочтительной
мета-атака, при которой не возникает
таких структур.
Приведенное
выше объяснение дано на основании так
называемого динамического эффекта, т.
е. распределения электронной плотности
в реагирующей молекуле. Ориентацию
электрофильного замещения в монозамещенных
бензолах можно объяснить и с позиции
статических электронных эффектов -
распределения электронной плотности
в нереагирующей молекуле. При рассмотрении
смещения электронной плотности по
кратным связям можно заметить, что при
наличии электронодонорного заместителя
более всего повышена электронная
плотность в орто- и пара- положениях, а
при наличии электроноакцепторного
заместителя эти положения наиболее
обеднены электронами:
 Особый
случай представляют собой галогены -
будучи заместителями в бензольном ядре,
они дезактивируют его в реакциях
электрофильного замещения, однако
являются орто-, пара-ориентантами.
Дезактивация (снижение скорости реакции
с электрофилами) связана с тем, что, в
отличие других группировок с неподеленными
электронными парами (таких как -OH, -NH2 и
т. п.) , обладающих положительным мезомерным
(+М) и отрицательным индуктивным эффектом
(-I), для галогенов характерно преобладание
индуктивного эффекта над мезомерным
(+М< -I).
Особый
случай представляют собой галогены -
будучи заместителями в бензольном ядре,
они дезактивируют его в реакциях
электрофильного замещения, однако
являются орто-, пара-ориентантами.
Дезактивация (снижение скорости реакции
с электрофилами) связана с тем, что, в
отличие других группировок с неподеленными
электронными парами (таких как -OH, -NH2 и
т. п.) , обладающих положительным мезомерным
(+М) и отрицательным индуктивным эффектом
(-I), для галогенов характерно преобладание
индуктивного эффекта над мезомерным
(+М< -I).
 В
то же время, атомы галогенов являются
орто, пара-ориентантами, поскольку
способны за счет положительного
мезомерного эффекта участвовать в
делокализации положительного заряда
в сигма--комплексе, образующемся при
орто- или пара- атаке (структуры IV, VII в
приведенной выше схеме) , и тем самым
снижают энергию его образования.
В
то же время, атомы галогенов являются
орто, пара-ориентантами, поскольку
способны за счет положительного
мезомерного эффекта участвовать в
делокализации положительного заряда
в сигма--комплексе, образующемся при
орто- или пара- атаке (структуры IV, VII в
приведенной выше схеме) , и тем самым
снижают энергию его образования.
