
- •Тема 20. Ароматические углеводороды ряда бензола.
- •Гомологический ряд. Общая формула.
- •Номенклатура аренов.
- •Номенклатура радикалов
- •2. Получение из нефти
- •1. Получение из соединений алифатического ряда.
- •3.2. Реакция Вюрца-Гриньяра.
- •3.3. Алкилирование по Фриделю-Крафтсу.
- •3.4. Восстановление ароматических кетонов (по Клеменсену).
- •3.5. Сплавление солей ароматических кислот со щелочами.
- •3.6. Декарбоксилирование ароматических кислот.
- •Физические свойства аренов.
- •Химические свойства аренов
- •1. Реакции электрофильного замещения
- •1.1. Реакции нитрования
- •1.2. Реакции сульфирования.
- •Механизм реакции
- •1.3. Реакции галогенирования.
- •1.4. Реакции алкилирования по Фриделю-Крафтсу.
- •1.5. Реакции ацилирования по Фриделю-Крафтсу.
- •3. Реакции гомологов бензола с участием боковой цепи
- •3.1. Реакции галогенирования.
- •3.2. Реакции окисления.
- •3.2.1. Окисление кислородом воздуха.
- •3.2.2. Окисление сильными окислителями.
1. Реакции электрофильного замещения
1.1. Реакции нитрования
Под действием концентрированной азотной кислоты или смеси концентрированных азотной и серной кислот (нитрующая смесь) атомы водорода бензольного ядра замещаются на нитрогруппу:

нитробензол
Нитрованию предшествует образование электрофильного реагента NO2 - катиона нитрония.
В реакции нитрования бензола нитрующей смесью катион нитрония (NO2) образуется в результате протонирования азотной кислоты присутствующей концентрированной серной кислотой:

Дальнейшее нитрование происходит с трудом, так как нитрогруппа является заместителем второго рода и затрудняет течение реакций с электрофильными реагентами:

нитробензол 1,3-динитробензол 1,3,5-тринитробензол
Гомологи бензола (толуол, ксилолы) нитруются легче, чем бензол, так как алкильные группы являются заместителями первого рода и облегчают течение реакций с электрофильными реагентами:
1,3,5-тринитробензол

толуол орто-нитротолуол пара-нитротолуол
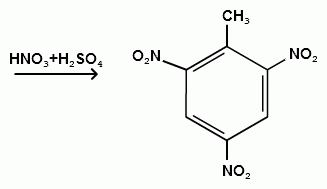
1,3,5-тринитробензол


1.2. Реакции сульфирования.
При действии на бензол и его гомологи концентрированной серной кислотой или триоксидом серы атомы водорода в бензольном ядре замещаются на сульфогруппу:

бензолсульфокислота
Механизм реакции
Сульфированию предшествует образование электрофильного реагента HSO+3 - гидросульфониевого иона:
3H2SO4 → Н3О+ + HSO+3 + 2HSO-4
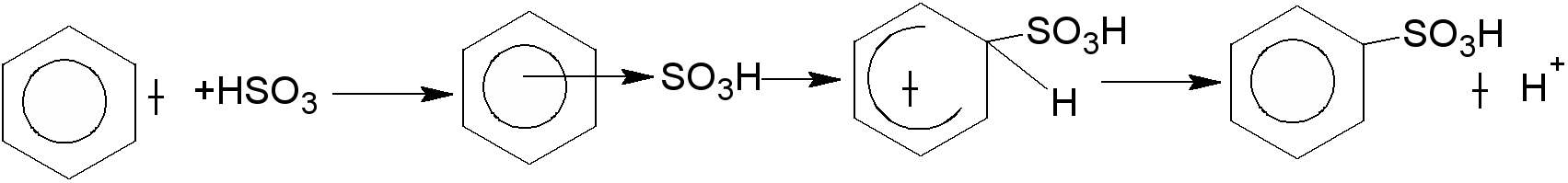 π-комплекс
σ-комплекс
π-комплекс
σ-комплекс
H+ + HSO-4 → H2SO4
Еще более активным электрофильным реагентом является триоксид серы, в котором имеется дефицит электронной плотности на атоме серы:

σ- комплекс
биполярный ион
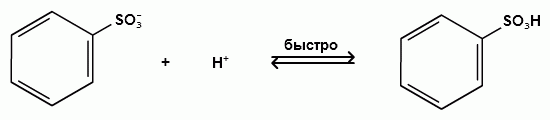
Гомологи бензола сульфируются легче, чем бензол, так как алкильные группы являются заместителями первого рода и облегчают течение реакций с электрофильными реагентами:

1.3. Реакции галогенирования.
В присутствии катализаторов кислот Льюиса (AlCl3; AlBr3; FeCl3; FeBr3; ZnCl2) при комнатной температуре происходит замещение атомов водорода бензольного ядра на атомы галогена:

Причем хлор замещает водород в ароматическом ядре активнее брома, а осуществить иодирование и фторирование аренов практически не удается, вследствие недостаточной активности иода и чрезмерной активности фтора.
Роль катализатора заключается в образовании или положительного иона галогена или комплекса галогена с кислотой Льюиса с поляризацией связи галоген-галоген:
1) образование положительного иона галогена:

2) образование комплекса галогена с кислотой Льюиса с поляризацией связи галоген-галоген:

Дальнейшее галогенирование происходит с трудом, так как галогены затрудняют реакции с электрофильными реагентами, но являются орто- и пара-ориентантами:
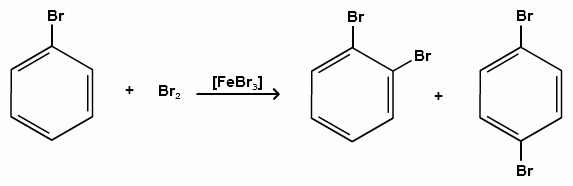
бромбензол 1,2-дибромбензол 1,4-дибромбензол
Гомологи бензола галогенируются легче, чем бензол, так как алкильные группы являются заместителями первого рода и облегчают течение реакций с электрофильными реагентами:

толуол орто-хлортолуол пара-хлортолуол
