
- •Лабораторная работа №1 кинетика физико-химических процессов. Химическое равновесие
- •Экспериментальная часть
- •1.1. Ход и данные опыта
- •1.2. Расчет и анализ данных, или анализ результатов наблюдений
- •1.3. Вывод
- •2.1. Ход и данные опыта
- •2.2. Расчет и анализ данных, или анализ результатов наблюдений
- •2.3. Вывод
- •4.2. Расчет и анализ данных, или анализ результатов наблюдений
- •4.3. Вывод
- •5.1.Ход и данные опыта
- •5.2. Расчет и анализ данных, или анализ результатов наблюдений
- •5.3. Вывод
- •6.1. Контрольные вопросы
- •Литература
- •Лабораторная работа №1 Тема: Кинетика физико-химических процессов. Химическое равновесие.
Лабораторная работа №1 кинетика физико-химических процессов. Химическое равновесие
Цель работы: изучить влияние различных факторов на скорость и равновесие физико-химических процессов.
Экспериментальная часть
. Название опыта: Зависимость скорости реакции от концентрации реагирующих веществ
1.1. Ход и данные опыта
Условие
проведения опыта: Используем реакцию
взаимодействия раствора иодата калия![]() с раствором сульфита натрия
с раствором сульфита натрия![]() в присутствии серной кислоты и крахмала
(индикатора на свободный иод). Процесс
взаимодействия протекает в несколько
стадий. Суммарное уравнение реакции
имеет вид
в присутствии серной кислоты и крахмала
(индикатора на свободный иод). Процесс
взаимодействия протекает в несколько
стадий. Суммарное уравнение реакции
имеет вид
![]() ,
,
или в ионной форме
![]() .
.
Считая началом реакции момент сливания растворов реагентов, а концом – момент выделения свободного иода (появление синей окраски), можно установить время реакции (τ) по секундомеру и определить относительную скорость реакции как 1/τ. Изменяя концентрацию раствора одного из реагентов, установили зависимость скорости реакции от концентрации реагирующих веществ при постоянной температуре.
Для
выполнения опыта использовали растворы:
раствор А (0,002 н раствор иодата
калия), раствор Б (0,02 н раствор
сульфита натрия, содержащий в 500 мл
0,02 н раствора
![]() 50 мл 2 н раствора серной кислоты и
50 мл
50 мл 2 н раствора серной кислоты и
50 мл![]() -ного
раствора крахмала).Реакция проводится
при постоянной температуре (комнатной),
постоянной концентрации иодата калия
(раствор А) и переменной концентрации
сульфита натрия (табл.1, раствор Б).
-ного
раствора крахмала).Реакция проводится
при постоянной температуре (комнатной),
постоянной концентрации иодата калия
(раствор А) и переменной концентрации
сульфита натрия (табл.1, раствор Б).
Порядок выполнения опыта: Используем мерный цилиндр и пронумерованные химические стаканы, раствор Б пяти различных концентраций согласно табл.1.
Взяли 2 пробирки, в одну из них внес пипеткой 20 капель раствора А, в другую из стакана №1 – 20 капель раствора Б (первый вариант концентрации). Быстро слили растворы и одновременно включили секундомер (в процессе опыта пробирку не встряхивали). В момент появления синего окрашивания выключили секундомер. Данные внесли в табл.1. Затем в том же порядке выполнили 2, 3, 4 и 5–й варианты опыта. Для каждого варианта рассчитали относительную скорость процесса (1/τ, с–1) и занесли в табл.1.
|
Таблица 1 | |||||
|
Номер стакана |
Объём, мл |
Относительная концентрация раствора Б (нормальность) |
Время , с |
Относительная скорость
реакции
| |
|
Раствор Б |
Дистил. вода | ||||
|
1 |
10 |
0 |
0,02 |
3,91 |
0,25 |
|
2 |
10 |
5 |
0,0133 |
5,09 |
0,19 |
|
3 |
10 |
10 |
0,01 |
11,66 |
0,08 |
|
4 |
10 |
15 |
0,008 |
19,51 |
0,05 |
|
5 |
10 |
20 |
0,0066 |
27,63 |
0,03 |
1.2. Расчет и анализ данных, или анализ результатов наблюдений
Рассчитаем
относительную скорость реакции во всех
вариантах опыта по формуле
![]() .
Данные внесем в таблицу 1.
.
Данные внесем в таблицу 1.
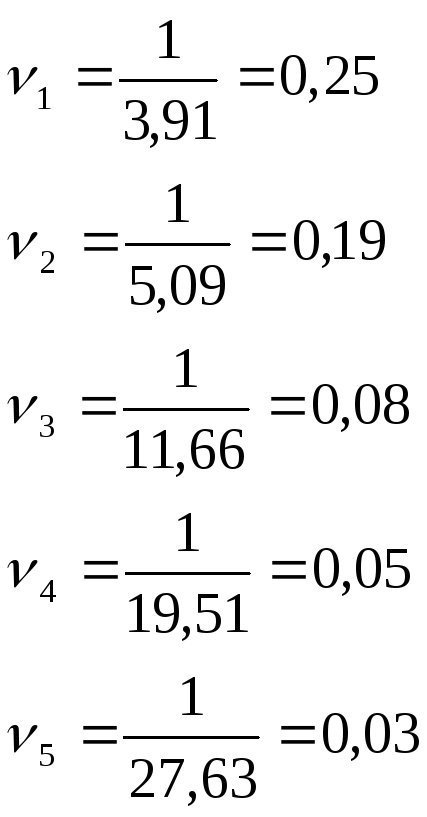
Построим график зависимости скорости реакции от концентрации реагирующих веществ.

В
химической кинетике исходят из того,
что реагируют только не частицы, которые
сталкиваются. В любой системе число
столкновений пропорционально числу
имеющихся частиц, следовательно, скорость
химической реакции должна быть
пропорциональна произведению концентраций
реагирующих веществ и с увеличением
концентрации веществ должна увеличиваться.
Что подтверждается ЗДМ:
![]()
