
- •Химическая термодинамика и самопроизвольное протекание процесса
- •Учебно-методическое и информационное обеспечение дисциплины «химия»
- •Содержание дисциплины «Химия»
- •Содержание лекций
- •1. Порядок работы:
- •1Фотона
- •3. Газовые законы (стехиометрические):
- •7. Правила и формулы расчета молярных эквивалентных масс (мэ)
- •7.4.1. Эквивалентная масса оксида:
- •7.4.2. Эквивалентная масса основания:
- •7.4.3. Эквивалентная масса кислоты:
- •7.4.4. Эквивалентная масса соли:
- •3. Закон Авогадро (а. Авогадро, 1811):
- •3.3.Из закона Авогадро выведено несколько важных следствий:
- •4. Закон идеального газового состояния (Менделеева–Клапейрона, 1834 - 1874).
- •I. Химическая термодинамика (энергетика химичес- ких процессов)
- •Термохимия -
- •Термохимические уравнения
- •Законы термохимии
- •Процессы в живых организмах
- •Теплоемкость
- •Второе начало (закон) термодинамики
- •Энтропия – мера приближения системы к равновесию
- •4.2. Примеры решения типовых задач
- •III. Дисперсные системы. Растворы.
- •2. Основные классы неорганических соединений
- •2.1. Оксиды
- •2.2. Гидроксиды
- •2.3. Кислоты
- •2.4. Соли
- •2.5. Комплексные (координационные) соединения
- •2.6. Соединения- объекты супрамолекулярной химии Примеры супер- и супрамолекул
- •2.5. Некоторые правила построения графических формул химических соединений:
- •2.6. Отличительные электрофизические свойства металлов, полупроводников, диэлектриков.
- •3. Комплексные соединения (к.С.) -
- •3.1. Супер- и супрамолекулярные соединения -
- •1. Первые (до Томсона) модели атома.
- •2. Спектры испусканния электронов в полупроводниках, светодиоды.
- •3. Радиоактивность: понятие, виды, характеристики.
- •1. Протонно-нейтронная теория строения атома.
- •2. Квантово-механическая теория строения атома.
- •2.1. Три основополагающие идеи (положения) квантовой механики:
- •2. Двойственная природа (корпускулярно–волновой дуализм) электрона.
- •2.2. Основные особенности квантового состояния электрона и электронной структуры атомов.
- •II. Химическая связь
- •1.Определение, основные типы и природа химической связи. Количественные характеристики химической связи на основе квантово-механической теории.
- •2. Типы химической связи
- •2.4. Гибридизация ковалентной связи.
- •3.2. Примеры решения типовых задач
3.2. Примеры решения типовых задач
Задача 1.
Какую валентность и степень окисления имеют элементы в соединениях Na3N, F2, BCl? Показать направление перекрывания электронных облаков, конфигурацию молекул и типы связей по направлениям.
Решение.
а) Na3N: поскольку Na в соединениях всегда имеет степень окислениия (с.о.), равную +1, то с.о.(N) = – 3.
П остроимэлектронные
формулы Na
и N
и краткие
электронно-графические
формулы,
иначе –
схемы заполнения электронами их АО
внешнего энергетического уровня:
остроимэлектронные
формулы Na
и N
и краткие
электронно-графические
формулы,
иначе –
схемы заполнения электронами их АО
внешнего энергетического уровня:
В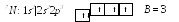 алентность
элемента определяется количеством
неспаренных электронов на внешнем
энергетическом уровне, поэтому валентностьNa
равна 1. Поскольку валентный электрон
находится в s–состоянии,
формой его электронного облака является
сфера.
алентность
элемента определяется количеством
неспаренных электронов на внешнем
энергетическом уровне, поэтому валентностьNa
равна 1. Поскольку валентный электрон
находится в s–состоянии,
формой его электронного облака является
сфера.
Атом
азота имеет три неспаренных р–электрона
на внешнем энергетическом уровне,
поэтому его валентность В
= 3. Поскольку у азота в соединении Na3N
степень
окисления (по модулю) и валентность
численно совпадают, то гибридизации
атома не будет. Три валентных р–электрона
имеют форму электронного облака в виде
гантели и располагаются в околоядерном
пространстве п о
взаимно перпендикулярным осям:
о
взаимно перпендикулярным осям:
В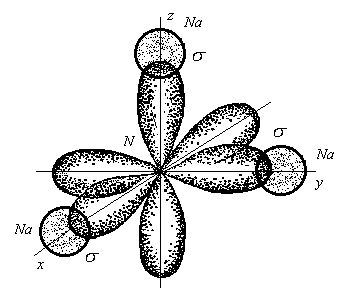 молекулеNa3N
каждый
валентный р–электрон
азота перекрывается с валентным
s–электроном
каждого из трех атомов натрия. Таким
образом, конфигурация молекулы будет
следующей:
молекулеNa3N
каждый
валентный р–электрон
азота перекрывается с валентным
s–электроном
каждого из трех атомов натрия. Таким
образом, конфигурация молекулы будет
следующей:
Поскольку перекрывание s– и р– электронов находится на оси, соединяющей центры атомов, то по всем направлениям имеет место σ– связь.
б) F2 – простое вещество, поэтому степень окисления его (с.о.) равна 0.
Электронная формула атома фтора и схема заполнения его валентных АО:
Н а
внешнем энергетическом уровне атомаF
находится один неспаренный рX
–электрон.
Поэтому валентность фтора, В(F) = 1;
рX
–электрон
имеет конфигурацию электронного облака
а
внешнем энергетическом уровне атомаF
находится один неспаренный рX
–электрон.
Поэтому валентность фтора, В(F) = 1;
рX
–электрон
имеет конфигурацию электронного облака
![]() .
В молекуле F2
каждый из рX
–электронов
атомов фтора перекрывается друг с другом
посредством σ–
связи:
.
В молекуле F2
каждый из рX
–электронов
атомов фтора перекрывается друг с другом
посредством σ–
связи:
в
 ) В
молекулеBCl3
степени
окисления хлора и бора: с.о.(Cl)
= –1, с.о.(В) = +3. Построим электронные
формулы и схемы заполнения валентными
электронами АО (B
и
Cl):
) В
молекулеBCl3
степени
окисления хлора и бора: с.о.(Cl)
= –1, с.о.(В) = +3. Построим электронные
формулы и схемы заполнения валентными
электронами АО (B
и
Cl):
Поскольку атом бора имеет один неспаренный рX –электрон на внешнем энергетическом уровне, то в невозбужденном состоянии его валентность В = 1. Степень окисления бора в соединении BCl3 не совпадает с этой валентностью, значит, при взаимодействии атома бора с хлором происходит его возбуждение, распаривание s–электронов, переход одного из них во вторую ячейку р–подуровня и гибридизация.
Электронная формула атома бора в возбужденном состоянии и схема распределения валентных электронов по АО имеют следующий вид:

П роисходитsp2–гибридизация,
для которой характерно следующее
расположение электронных облаков:
роисходитsp2–гибридизация,
для которой характерно следующее
расположение электронных облаков:
Н
Cl![]() .
Общая конфигурация молекулы BCl3
будет иметь следующий
вид:
.
Общая конфигурация молекулы BCl3
будет иметь следующий
вид:
К Cl Cl B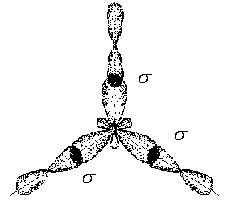
Задача 2.
Определить тип химической связи и структуру молекул СН4 и Н2S.
Решение.
а ) В
молекулеСН4
степень окисления углерода –4, водорода
+1. Электронная формула атома углерода:
) В
молекулеСН4
степень окисления углерода –4, водорода
+1. Электронная формула атома углерода:
Поскольку у атома С два неспаренных электрона, то его валентность в невозбужденном состоянии В = 2. Так как степень окисления С не совпадает с его валентностью, то при возбуждении атома происходит распаривание s–электронов, переход одного из них в третью ячейку р–подуровня и гибридизация. Электронная формула и схема распределения валентных электронов по АО атома углерода в возбужденном состоянии имеют следующий вид:
П роисходитsp3–гибридизация
с характерной для нее конфигурацией
электронных облаков, при которой
гибридные орбитали ориентированы от
центра тетраэдра к его углам:
роисходитsp3–гибридизация
с характерной для нее конфигурацией
электронных облаков, при которой
гибридные орбитали ориентированы от
центра тетраэдра к его углам:
К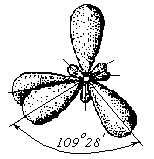
 аждый
из четырех гибридных электронов
перекрывается с каждымs–электроном
атома водорода.
аждый
из четырех гибридных электронов
перекрывается с каждымs–электроном
атома водорода.
Таким образом, форма структуры молекулы СН4 – объемный тетраэдр:
б) В молекуле Н2S степень окисления серы –2, водорода +1.
Электронная формула и схема распределения валентных электронов атома серы по АО:
П оскольку
у атомаS
два неспаренных электрона, то валентность
невозбужденного атома серы В
(S) = 2.
Так как валентность совпадает со степенью
окисления серы (по модулю), то гибридизации
нет. Два валентных р–электрона
располагаются в околоядерном пространстве
по взаимно перпендикулярным осям и
перекрываются с s–электронами
двух атомов Н
посредством σ–
связей:
оскольку
у атомаS
два неспаренных электрона, то валентность
невозбужденного атома серы В
(S) = 2.
Так как валентность совпадает со степенью
окисления серы (по модулю), то гибридизации
нет. Два валентных р–электрона
располагаются в околоядерном пространстве
по взаимно перпендикулярным осям и
перекрываются с s–электронами
двух атомов Н
посредством σ–
связей:

Сравним структуры молекул СН4 и H2S. Молекула СН4 – тетраэдрическая и дипольный момент этой молекулы как векторная величина, равная геометрической сумме моментов диполей входящих в нее связей С–Н, равен нулю. Поэтому молекула СН4 – неполярная.
Молекула Н2S – угловая, в одной ее части преобладает положительный, в другой – отрицательный заряд. Поэтому эта молекула - полярная.
Задача 3.
Определить структуру и характер связей молекулы N2.
Решение.
Электронная формула атома азота:
А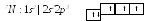 том
азота имеет три валентных неспаренныхр–электрона,
расположенных в пространстве по трем
взаимноперпендикулярным осям. Поэтому
связей в молекуле N2
три: одна σ–
и две –связи.
том
азота имеет три валентных неспаренныхр–электрона,
расположенных в пространстве по трем
взаимноперпендикулярным осям. Поэтому
связей в молекуле N2
три: одна σ–
и две –связи.
З адача
4.
адача
4.
Какая из молекул: Н2О, Н2S, H2Se - имеет наибольший электрический момент диполя?
Решение. ??
Элементы О, S и Se являются электронными аналогами, их электронные формулы имеют следующий вид:
8O : 1s2 | 2s2 2p4
16S : 1s2 | 2s2 2p6 | 3s2 3p4
34Se : 1s2 | 2s2 2p6 | 3s2 3p6 3d10 | 4s2 4p4
Структура их внешних электронных оболочек одинакова.
Поскольку с ростом порядкового номера элементов размеры атомов, находящихся в одной группе, возрастают, то будут возрастать и размеры соответствующих им однотипных молекул. Поэтому будут возрастать длины диполей и связанные с ними электрические моменты диполей µ.
Следовательно, µ(H2Se)> µ(H2S)> µ(H2O).
Задача 5.
Определить, какая из связей: H–N, H–S, H–Te, H–Li - наиболее полярна. К какому из атомов смещено электронное облако в каждой паре элементов?
Решение.
Для определения характера связи необходимо знать электроотрицательность каждого элемента:
|
Элемент |
H |
N |
S |
Te |
Li |
|
Относительная электроотрицательность (ОЭО ) |
2,1 |
3,0 |
2,5 |
2,1 |
1,0 |
Определим разность электроотрицательностей ОЭО для данных соединений:
ОЭО(H–N) = 3,0 –2,1 = 0,9; ОЭО(H–S) = 2,5 – 2,1 = 0,4;
ОЭО(H–Te) = 2,1 – 2,1 = 0; ОЭО(H–Li) = 2,1 –1,0 = 1,1;
Чем больше разность электроотрицательностей соединяющихся атомов, тем более полярна связь.
Таким образом, наиболее полярной является связь H–Li.
Молекулярное электронное облако смещается в сторону атома, обладающего большей электроотрицательностью, т.е. в сторону азота в соединении H–N, серы - в связи H–S , водорода – между H–Li. В паре H–Te электронное облако находится на равном расстоянии от H и Te, т.е. связь между ними неполярна.
Задача 6.
Энергия ионизации ( ) атомов фтора и хлора составляет соответственно 17,4 и 13,0 эВ, а энергия сродства к электрону (Е) 3,45 и 3,61 эВ. Для какого из этих элементов более характерно образование ионных соединений? Указать знак заряда ионов галогенов в этих соединениях.
Решение.
Степень ионности возрастает с увеличением электроотрицательности, которая может определяться как полусумма энергий ионизации и сродства:
ЭО = 1/2 (I + Е).
Определим электроотрицательность для F и Cl:
ЭО (F) = ½ (17,4 + 3,45) = 10,425, эВ;
ЭО (Cl) = ½ (13 + 3,61) = 9,805, эВ.
Поскольку электроотрицательность F выше, чем Cl, то для F более характерно образование ионных соединений. Знак заряда ионов у обоих элементов (–), т.к. внешней р–орбитали их атомов, расположенных в VIIA-группе Периодической системы, до полного заполнения не хватает одного электрона, и с его добавлением каждый из этих атомов превращается в отрицательный ион.
Задача 7.
Показать энергетическую диаграмму F2 методом молекулярных орбиталей (МО), то есть расположить электроны на МО в молекуле F2.
Решение.
Молекула F2 состоит из двух атомов, в ней 18 электронов. Реакцию образования молекулы F2 из атомов F и распределение электронов, соединяющихся атомов на МО можно записать следующим образом (см. раздел 3.1.1, ММО):
![]() .
Таким образом, на 10 связывающих
электронов, расположенных на s–,
у–
и z–орбиталях,
приходится 8 электронов, расположенных
на разрыхляющих орбиталях. Поэтому в
молекуле F2
порядок
связи п
= ½(10 -8) = 1 и
обеспечивается
устойчивая химическая связь.
.
Таким образом, на 10 связывающих
электронов, расположенных на s–,
у–
и z–орбиталях,
приходится 8 электронов, расположенных
на разрыхляющих орбиталях. Поэтому в
молекуле F2
порядок
связи п
= ½(10 -8) = 1 и
обеспечивается
устойчивая химическая связь.
Энергетическая диаграмма МО для молекулы F2 представляется в виде:
Электронно-графические формулы (для валентных подуровней –
снизу вверх, от s- к р-).
АО (атома F) МО (молекулы F2) АО (атома F)
2s22р5 (2sсв)2(2s*)2(2русв)2(2рzсв)2(2рхсв)2(2ру*)1 2s22р5


Задача 8. Объяснить
механизм образования молекулы SiF4
и иона ![]() методом
валентных связей. Может ли существоваь
ион
методом
валентных связей. Может ли существоваь
ион ![]() ?
?
Решение.
а) Электронная формула атома Si14: 1s2 |2s22р6|3s23р23d0. Заполнение АО в невозбужденном состоянии может быть представлена следующей электронно-графической формулой, схемой:
П ри
возбуждении атомSi
переходит в состояние: 1s2
|2s22р6|3s13р33d0,
а электронно-графическое строение его
валентных орбиталей имеет вид:
ри
возбуждении атомSi
переходит в состояние: 1s2
|2s22р6|3s13р33d0,
а электронно-графическое строение его
валентных орбиталей имеет вид:
Н еспаренные
электроны возбужденного атомаSi
могут участвовать в образовании черырех
ковалентных связей по обычному обменному
механизму с sр3
– гибридизацией атомов Si
с атомами F
(1s2
|2s22р5),
имеющими по одному неспаренному
электрону. В результате образуется
молекула SiF4.
еспаренные
электроны возбужденного атомаSi
могут участвовать в образовании черырех
ковалентных связей по обычному обменному
механизму с sр3
– гибридизацией атомов Si
с атомами F
(1s2
|2s22р5),
имеющими по одному неспаренному
электрону. В результате образуется
молекула SiF4.
Для
образования иона ![]() к молекуле SiF4
должны присоединиться два иона F-
(1s2
|2s22р6),
все валентные электроны которых спарены.
Связь осуществляется по донорно-акцепторному
механизму за счет пары электронов
каждого из фторид-ионов и двух вакантных
3d-орбиталей
атома кремния.
к молекуле SiF4
должны присоединиться два иона F-
(1s2
|2s22р6),
все валентные электроны которых спарены.
Связь осуществляется по донорно-акцепторному
механизму за счет пары электронов
каждого из фторид-ионов и двух вакантных
3d-орбиталей
атома кремния.
б)
Углерод (1s2
|2s22р2)
может образовать соединение СF4
подобно
кремнию, но при этом валентные возможности
углерода будут исчерпаны (нет неспаренных
электронов, неподеленных пар электронов
и вакантных орбиталей на валентном
уровне). Поэтому ион ![]() образоваться
не может.
образоваться
не может.
Лекция № 9.
Тема: Окислительно-восстановительные реакции (ОВР).
Вопросы:
1. Классификации химических реакций. Типы уравнений реакций. Окислительно-восстановительные реакции (ОВР), их типы и распространенность в природе.
ОВ-свойства химических элементов и соединений. Понятия окислителя и восстанови-теля. Алгоритмы составления уравнения ОВР двумя методами: электронного баланса и полуреакций (ионно-электронного баланса). ОВ-эквивалент вещества.
2. Определение направления ОВР. Физико-химические параметры (температура, концентрация реагентов, их природа, кислотность среды и др.) на направление и глубину протекания ОВР.
ПРОБЛЕМНЫЕ ЛЕКЦИИ
ПО ДИСЦИПЛИНЕ
«ХИМИЯ»
