
- •Рабочая программа
- •1. Цели и задачи освоения дисциплины
- •2. Место дисциплины в структуре ооп впо
- •3. Компетенции обучающегося, формируемые в результате освоения дисциплины «Неорганическая химия»
- •4. Содержание и структура дисциплины (модуля)
- •4.1. Содержание разделов дисциплины
- •1 Семестр
- •15. Пятнадцатая группа Периодической системы д.И. Менделеева
- •2 Семестр
- •17. Тринадцатая группа Периодической системы д.И. Менделеева.
- •4.2. Распределение часов по семестрам и видам занятий
- •4.5. Практические занятия (семинары)
- •I семестр
- •2 Семестр
- •I семестр
- •II семестр
- •5. Образовательная технология
- •5.1. Интерактивные образовательные технологии, используемые в аудиторных занятиях
- •6. Оценочные средства для текущего контроля успеваемости и промежуточной аттестации
- •1 Семестр
- •1 Аттестация
- •2 Аттестация
- •2 Семестр
- •1Аттестация
- •2 Аттестация
- •I семестр
- •2 Семестр
- •7. Порядок проведения текущих и промежуточных аттестаций. Шкалы оценок
- •8. Учебно-методическое обеспечение дисциплины (модуля)
- •8.1. Основная литература
- •8.3. Периодические издания
- •8.4. Программное обеспечение и Интернет-ресурсы
- •Интернет-ресурсы: Общие поисковые системы: Google (www.Google.Com), Яндекс (www.Yandex.Ru), Рамблер (www.Rambler.Ru) Специализированные поисковые системы: cas On-line (http://info.Cas.Org),
- •Базы данных: The Patent Office (http://gb.Espacenet.Com)
- •Электронные библиотеки:Электронная библиотека Имперского колледжа (http://www.Imperial.Ac.Uk/library/ejournals/a1.Html).
- •8.5. Методические указания к лабораторным занятиям
- •8.6. Методические указания к практическим занятиям
- •8.7. Методические указания к курсовой работе и другим видам самостоятельной работы
- •Дополнения и изменения в рабочей программе дисциплины на 20_____/20_______уч.Г.
2 Аттестация
1. Какова электронная конфигурация атома меди в основном состоянии:
1)…3d104s1 2)…3d24s2
2. Какие вещества образуются при взаимодействии меди с концентрированной серной кислотой при нагревании?
1) СuSO4 2) CuO 3) H2 4) SO2
3. Какие металлы вытесняются медью из растворов их солей?
1) Fe 2) Zn 3) Sn 4) Ag
4. Какие вещества образуются при взаимодействии цинка с 3%-ным раствором азотной кислоты?
1) NH4NO3 2) N2 3) NO 4) NO2
5. Какие вещества образуются при взаимодействии цинка с 3%-ным раствором азотной кислоты?
1) NH4NO3 2) N2 3) NO 4) NO2
6. Какие вещества образуются при взаимодействии металлического титана с горячей концентрированной азотной кислотой?
1) TiO(NO3)2 2) TiO2∙nH2O 3) NO2 4) NH4NO3
7. В результате каких реакций получается β-титановая кислота?
-
1)

3)

2)

4)

8. Какие степени окисления имеет ванадий в наиболее устойчивых своих соединениях?
1) -3 2) +2 3) +4 4) +5
9. Какие оксиды ванадия обладают амфотерным характером?
1) VO 2) V2O3 3) VO2 4) V2O5
10. Какова конфигурация валентных электронов в атоме хрома в основном состоянии?
1) … 4s24p4 2) … 3d44s2 3) … 3d54s1
11. Какие соли хрома подвергаются полному гидролизу в водном растворе?
1) CrCl3 2) Cr2S3 3) Cr2(SO4)3
12. Напишите уравнение реакции и приведите сумму коэффициентов:
![]()
13. Какие степени окисления имеет марганец в наиболее устойчивых своих соединениях?
1) +2 2) +4 3) +6 4) +7
14. Какое соединение марганца остается в растворе в результате взаимодействия MnO2 c концентрированной соляной кислотой?
1) MnCl2 2) MnCl3 3) MnCl4
В виде каких соединений встречается в природе железо?
1) FeCl3∙6H2O 2) Fe3O4 3) FeS2 4) K4[Fe(CN)6]
В виде каких соединений встречается в природе железо?
1) FeCl3∙6H2O 2) Fe3O4 3) FeS2 4) K4[Fe(CN)6]
17. Какие реакции можно использовать для получения ферритов?
-
1)

3)
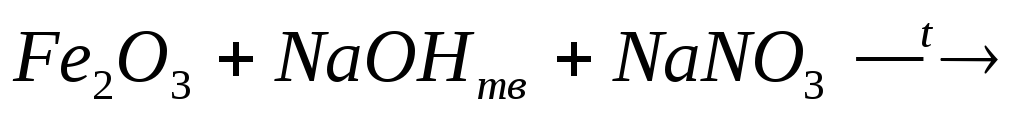
2)

4)

18. Напишите уравнение реакции и подсчитайте сумму коэффициентов в левой части уравнения:
![]()
19. Какие реакции можно использовать для получения ферритов?
-
1)
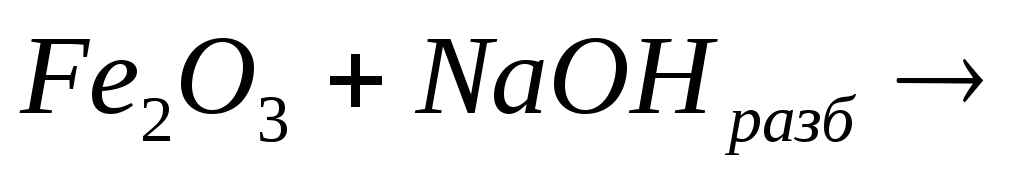
3)

2)

4)

20. Какие ионы могут существовать в щелочной среде?
1) [Cr(H2O)6]3+ 2) [Cr(OH)6]3- 3) CrO42- 4) Cr2O72-
21. Какие вещества образуются при пропускании H2S в раствор FeCl3?
1) Fe2S3 2) FeS 3) S 4) FeCl2
22. Какие соединения получаются в результате прокаливания KMnO4?
1) MnO2 2) MnO 3) K2MnO4 4) Mn3O4
23. Какой ион получается при растворении хрома в соляной кислоте в отсутствие кислорода?
1) [Cr(H2O)6]2+ 2) [Cr(H2O)6]3+ 3) CrO42- 4) Cr2O72-
24. Какой состав имеет карбонил железа?
1) Fe(CO)6 2) Fe(CO)5 3) Fe(CO)4 4) Fe2(CO)8
25. Какие вещества обесцвечивают подкисленный раствор перманганата калия?
1) FeSO4 2) H2O2 3) (NH4)2SO4 4) CO2
26. Определите, возможно ли термодинамически окисление Cr2+ водой в отсутствие кислорода воздуха в растворе, содержащем 10-3 моль/л HCl, если Ео (Сr3+/Cr2+)=0,409 В; а(Сr2+) = а(Сr3+)=1. Напишите соответствующие уравнения реакций.
Сопоставьте и объясните кислотно-основные свойства в ряду Mn(II)—Mn(IV)—Mn(VII). Ответ подтвердите уравнениями реакций.
27. На основании диаграмм Латимера для рН=0 и рН=14 соответственно:

1) Определите устойчивость к процессам диспропорционирования Mn3+ в стандартных условиях (рН=0). Напишите уравнение реакции.
2) Оцените граничные значения рН, при которых ион Mn3+ад термодинамически устойчива к диспропорциоинированию.
3) Определите, какая из форм марганца, устойчива к диспропорционированию, может взаимодействовать с растворителем с выделением кислорода при рН=14, если Ео (О2/ОН-)=0,4 В.
Какие продукты образуются при взаимодействии растворов FeSO4 и Na2CO3, Fe2(SO4)3 и Na2СО3? Укажите условия.
а) Объясните высокую термодинамическую устойчивость цианидных комплексов железа;
б) почему красная кровяная соль ядовита, чем желтая кровяная соль?
в) Как желтую кровяную соль превратить в красную и наоборот?
г) Каков состав и строение соединения, образующегося при взаимодействии солей Fe2+ с K3[Fe(CN)6] и солей Fe 3+ с K4[Fe(CN)6]?
Чем объяснить потерю массы металлического никеля при нагревании его в токе оксида углерода (II)?
Оцените, возможно ли с термодинамической точки зрения получение галогенидов ртути (I) при взаимодействии [HgHal4]2- c металлической ртутью, если известно:

Укажите, как меняется устойчивость комплексных ионов [HgHal4]2- при переходе от Cl к I и объясните наблюдаемую закономерность.
Полный перечень вопросов выносимых на экзамен
