
- •1. Белки. Структура и функции
- •1.1. Строение белков
- •Структура аминокислот
- •Пептидная связь в молекуле белка
- •Аланилфенилаланилвалин
- •Биологически активные пептиды
- •1.2. Уровни структурной организации белковой молекулы
- •Первичная структура
- •Вторичная структура белка
- •Третичная структура белка
- •Структуры глобулярного белка
- •Четвертичная структура белка
- •1.3. Физико-химические свойства белков
- •Механизм растворения белков (гидратация)
- •Кислотно-основные свойства белков (электрические)
- •Электрофорез
- •На хроматографической бумаге
- •Коллоидные и осмотические свойства белков
- •1. Оптические свойства белков
- •3. Осмотические свойства белков
- •4. Высокая вязкость белковых растворов
- •5. Способность белков к образованию гелей
- •Осаждаемость белков
- •2. Методы выделения, фракционирования и очистки белков
- •2.1. Методы гомогенизации
- •2.2. Экстракция (извлечение) белков
- •2.3. Методы фракционирования (разделения) белков
- •3. Классификация белков
- •3.1. Простые белки
- •3.2. Сложные белки
Четвертичная структура белка
Некоторые белки построены из нескольких полипептидных цепей, каждая из которых имеет вторичную и третичную структуры. Для таких белков введено понятие четвертичной структуры. Белок с четвертичной структурой называют олигомером, а его полипептидные цепи с третичной структурой – протомеры или субъединицы. Самостоятельной биологической активностью протомеры не обладают. Чаще встречаются димеры, тетрамеры и в пределах десяти, но может быть и больше (рис. 7).
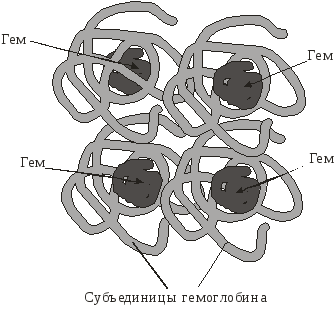
Рис. 7. Четвертичная структура гемоглобина
Молекула состоит из четырех протомеров
(двух α-субъединиц и двух β-субъединиц глобина)
Стабилизация четвертичной структуры белка
Контакты между поверхностями субъединиц осуществляются посредством полярных групп радикалов аминокислот (водородные и ионные связи, иногда образуются и дисульфидные связи) или гидрофобных. Контактные поверхности взаимодействующих субъединиц комплементарны друг другу. Некоторые белки состоят из двух и более пептидных цепей, но они не являются полноправными глобулами и их нельзя отнести к группе олигомерных белков. Например, гормон инсулин состоит из двух полипептидных цепей, связанных между собой дисульфидными связями. Но он не относится к белкам с четвертичной структурой, так как его полипетидные цепи образовались путем частичного протеолиза единой полипептидной цепи.
Большинство белков-ферментов имеют четвертичную структуру. Это аспарагиновая аминотрансфераза (АСТ), синтаза жирной кислоты, лактатдегидрогеназа (ЛДГ), фруктозодифосфатаза, митохондриальная АТФ-аза, глутаминсинтетаза, ацетил~SКоA-карбоксилаза и др.
Белки с молекулярной массой более 50 тысяч почти всегда являются олигомерными.
1.3. Физико-химические свойства белков
Физико-химические свойства белков определяются их аминокислотным составом и пространственной структурой (организацией). Белки обладают следующими основными свойствами:
– кислотно-основными;
– буферными;
– осмотическими;
– оптическими;
– растворимостью;
– осаждаемостью;
– денатурацией.
Механизм растворения белков (гидратация)
Белки – это гидрофильные вещества. Сначала сухой белок набухает, а затем переходит в раствор. При набухании молекулы воды проникают внутрь белка и связываются с полярными группами радикалов аминокислот. Плотная упаковка полипептидных цепей разрыхляется. Затем белки растворяются, т.е. молекулы белка отрываются от общей массы и переходят в раствор.
Однако, не все молекулы белка, набухая, переходят в раствор. Например, коллаген только набухает (так ведут себя многие фибриллярные белки).
Растворение белков связано с их гидратацией, т.е. образованием гидратной оболочки. Молекулы воды электростатически связываются с ионогенными и неионогенными полярными группами радикалов аминокислот (с их полными положительными и отрицательными зарядами, а также с частично положительными и частично отрицательными зарядами) (рис. 8).
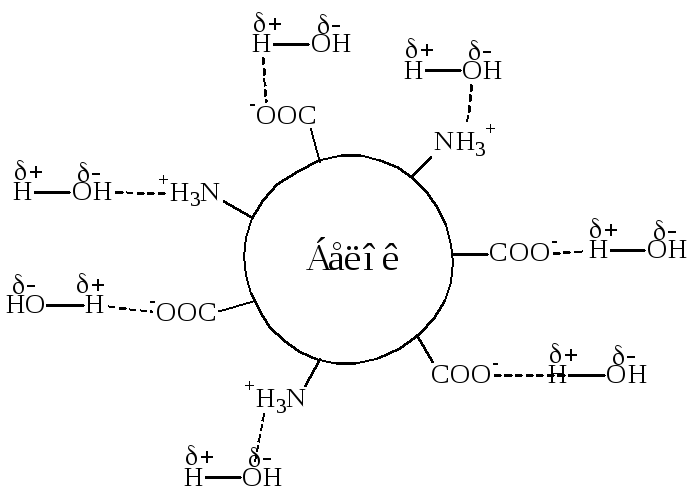
Рис. 8. Схема формирования гидратной оболочки
Однако часть гидратной воды связывается с атомами пептидных групп водородными связями. Подобным образом преимущественно связывает воду коллаген, так как этот белок содержит много гидрофобных аминокислот.
Количество воды, связанной с белком достигает 30–50 г на 100 г белка. Гидрофильных полярных групп значительно больше на поверхности белковой глобулы, чем в центре.
На стабилизацию (устойчивость) белка в растворе влияют два фактора:
– заряд белковой молекулы;
– наличие гидратной оболочки.
Оба фактора препятствуют коагуляции (конгломерации или склеиванию) белков и выпадению их в осадок.
Между этими двумя факторами существует тесная взаимосвязь: чем больше полярных групп в белке, тем больше связывается воды и тем лучше растворимость белка.
Например, такие глобулярные белки сыворотки крови и молока как альбумины хорошо растворимы даже в воде, а глобулины только в слабо-солевых растворах. Большинство фибриллярных белков плохо растворяются в воде и физиологических растворах или совсем не растворяются.
Растительные белки – проламины – растворяются в 60–80%-ном спирте, а глютелины – в щелочах (0,1–0,2% раствор гидроксида натрия).
Факторы, влияющие на растворимость белков:
аминокислотный состав полипептидной цепи белка (генетически обусловленный фактор);
преимущественное расположение гидрофильных аминокислот и олигосахаридных фрагментов на поверхности белковой глобулы. Большинство белков имеют гидрофильную поверхность. Однако есть и гидрофобные белки, поверхность которых образована гидрофобными радикалами аминокислот. Такие белки растворяются в липидах и встречаются преимущественно в мембранах;
чем ниже относительная гидрофобность белков (т.е. ниже взаимодействие с липидами), тем выше взаимодействие их с молекулами растворителя, следовательно, выше растворимость;
наличие спирализованных участков на поверхности белка повышает их растворимость;
растворимость белков зависит от рН среды (в изоэлектрической точке белки имеют наименьшую растворимость);
от концентрации солей: невысокая концентрация солей щелочных металлов и аммония (NaCl, Na2SO4, (NH4)2SO4) повышает растворимость, так как ионы соли препятствуют ионному (электростатическому) взаимодействию заряженных боковых радикалов аминокислот. Высокие концентрации солей снижают гидратацию глобулы (снимают гидратную оболочку) и тем самым усиливают белок-белковые взаимодействия (белок коагулирует и выпадает в осадок);
от размеров и формы молекул: низкомолекулярные глобулярные белки с большим количеством гидрофильных групп лучше растворимы в воде и слабосолевых растворах, а фибриллярные – хуже или совсем не растворяются;
денатурированные белки теряют способность к растворению, поскольку при денатурации изменяется конформация белковой молекулы, и он теряет гидратную оболочку и заряд.
