
- •1. Белки. Структура и функции
- •1.1. Строение белков
- •Структура аминокислот
- •Пептидная связь в молекуле белка
- •Аланилфенилаланилвалин
- •Биологически активные пептиды
- •1.2. Уровни структурной организации белковой молекулы
- •Первичная структура
- •Вторичная структура белка
- •Третичная структура белка
- •Структуры глобулярного белка
- •Четвертичная структура белка
- •1.3. Физико-химические свойства белков
- •Механизм растворения белков (гидратация)
- •Кислотно-основные свойства белков (электрические)
- •Электрофорез
- •На хроматографической бумаге
- •Коллоидные и осмотические свойства белков
- •1. Оптические свойства белков
- •3. Осмотические свойства белков
- •4. Высокая вязкость белковых растворов
- •5. Способность белков к образованию гелей
- •Осаждаемость белков
- •2. Методы выделения, фракционирования и очистки белков
- •2.1. Методы гомогенизации
- •2.2. Экстракция (извлечение) белков
- •2.3. Методы фракционирования (разделения) белков
- •3. Классификация белков
- •3.1. Простые белки
- •3.2. Сложные белки
Пептидная связь в молекуле белка
У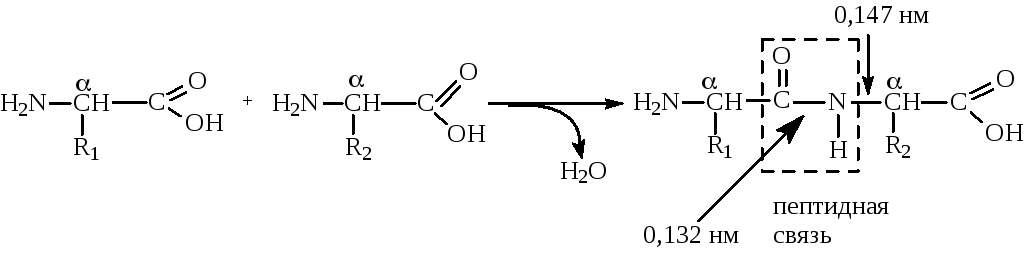 ниверсальным
типом связи в белковой молекуле является
пептидная связь. Образование пептидной
связи можно представить как отщепление
воды от α-карбоксильной группы первой
аминокислоты и α-амино группы второй:
ниверсальным
типом связи в белковой молекуле является
пептидная связь. Образование пептидной
связи можно представить как отщепление
воды от α-карбоксильной группы первой
аминокислоты и α-амино группы второй:
Однако, расстояние между атомами «С» и «N» пептидной связи может изменяться от 0,132 нм до 0,127 нм, что характерно для непредельной связи:
Р езонансная
стабилизация пептидной связи придает
ей характер частично двойной связи и
этим можно объяснитьжесткость
связи между
атомами углерода и азота пептидной
связи. Свободное вращение атомов
кислорода и водорода вокруг пептидной
связи невозможно и все четыре атома
пептидной группы лежат в одной плоскости
(копланарны). Кроме того, атомы кислорода
и водорода пептидной группы занимают
транс-положение.
езонансная
стабилизация пептидной связи придает
ей характер частично двойной связи и
этим можно объяснитьжесткость
связи между
атомами углерода и азота пептидной
связи. Свободное вращение атомов
кислорода и водорода вокруг пептидной
связи невозможно и все четыре атома
пептидной группы лежат в одной плоскости
(копланарны). Кроме того, атомы кислорода
и водорода пептидной группы занимают
транс-положение.
Вокруг остальных связей полипептидного остова возможно свободное вращение.
Такая полужесткость строения полипептидной цепи имеет важное значение для формирования более высокого уровня структурной организации белковой молекулы (вторичной, третичной и четвертичной структур).
Номенклатура полипептидной цепи белковой молекулы:
Аланилфенилаланилвалин
Трипептид включает три аминокислотных остатка.
В зависимости от количества аминокислотных остатков в полипептидной цепи различают:
– несложные пептиды (ди-, три-, тетра- и пентапептиды);
– олигопептиды (включают 11-30 аминокислотных остатков);
– полипептиды (включают от 30 до 50 аминокислотных остатков)
– белки – это полипептиды с молекулярной массой от 5000 до 1 млн Дальтон, содержащие более 50 аминокислотных остатков, длина их полипептидной цепи может достигать сотен и тысяч остатков аминокислот (Дальтон, D, Да – единица массы, равная массе атома водорода (1,0000) по шкале атомных масс).
Универсальной пробой на обнаружение белков в растворе служит биуретовая реакция: в щелочной среде ионы меди образуют комплексное соединение с атомами пептидных групп, окрашенное в сине-фиолетовый или розово-фиолетовый цвет. Эта реакция лежит в основе количественного определения белков в биологических жидкостях (в молоке, крови) и тканях растительного и животного происхождения, так как интенсивность окрашивания прямо пропорциональна количеству белка (количеству пептидных связей).
Биологически активные пептиды
Гормоны гипоталамуса (вазопрессин, окситоцин, тиролиберин, соматостатин и др.) их называют нейропептиды.
Г лутатион
– это трипептид, входит в состав
простетической группы ферментов класса
оксидоредуктаз (Гл-SH),
например, глутатионпероксидаза и
глицеральдегидфосфатдегидрогеназа
(фермент гликолиза):
лутатион
– это трипептид, входит в состав
простетической группы ферментов класса
оксидоредуктаз (Гл-SH),
например, глутатионпероксидаза и
глицеральдегидфосфатдегидрогеназа
(фермент гликолиза):
Это восстановленный глутатион. SH-Группа является каталитическим участком активного центра фермента, так как может окисляться и восстанавливаться:
–2Н
 Гл-SH
+ HS-Гл
Гл-S-S-Гл
Гл-SH
+ HS-Гл
Гл-S-S-Гл
восстановленная +2Н окисленная форма (имеет дисульфид-
форма ную связь и называется цистин)
Глутатион также принимает участие в транспорте аминокислот через мембрану клеток (особенно мозга), обезвреживает соединения ртути, ароматические углеводороды, перекисные соединения. Особенно много глутатиона содержится в дрожжах и зародыше пшеницы.
Карнозин и ансерин – дипептиды, обнаружены в мышцах животных и человека. Они являются составной частью экстрактивных веществ мяса (бульонов): Содержание их в мясе достигает 0,2–0,3% от сырой массы продукта.
Биологическая роль карнозина: он увеличивает амплитуду мышечного сокращения, предварительно сниженную утомлением, увеличивает эффективность работы ионных насосов мышечной клетки.

Ансерин также выполняет буферные функции за счет входящего в его состав имидазольного кольца гистидина:
В азоактивные
пептиды:
брадикинин, коллидин и ангиотензин. Они
оказывают влияние на тонус сосудов
(вазус
– сосуд). Например, ангиотензин
(асп-арг-вал-тир-иле-гис-про-фен) обладает
сосудосуживающим действием и,
следовательно, влияет на артериальное
давление.
азоактивные
пептиды:
брадикинин, коллидин и ангиотензин. Они
оказывают влияние на тонус сосудов
(вазус
– сосуд). Например, ангиотензин
(асп-арг-вал-тир-иле-гис-про-фен) обладает
сосудосуживающим действием и,
следовательно, влияет на артериальное
давление.
Пептидные токсины. Они вырабатываются (синтезируются) микроорганизмами, ядовитыми грибами, пчелами, змеями, морскими моллюсками, скорпионами и рядом растений. Изучено 5 энтеротоксинов, продуцируемых бактериями Staphylococcus aureus и 7 нейротоксинов, вырабатываемых Clostridium botulinum.
Токсины могут стать причиной пищевого отравления при употреблении молочных, мясных, рыбных, жидких яичных продуктов, а также салатов и кремовых начинок мучных кондитерских изделий.
К наиболее сильнодействующим ядам относятся ботулинические токсины (эти токсины инактивируются при 80 0С и в кислой среде). Они могут вызывать смертельные пищевые отравления.
Энтеротоксины могут вырабатываться также бактериями Salmonella и Clostridium perfringens. Вызывают расстройства работы кишечника, обморочные состояния и лихорадки. Чаще они содержаться в говядине, птице, рыбе, сыре, реже в фасоли. Они влияют на водно-солевой (электролитный) обмен и транспорт глюкозы в клетке, что приводит к обезвоживанию и гибели клеток кишечника.
Гриб бледной поганки содержит 10 циклических пептидов (Мм≈1000) из них особо ядовит токсин α-аманитин.
Яд пчел содержит апамин (18 аминокислот). Оказывает сильное влияние на центральную нервную систему.
Яд морских моллюсков – конотоксин (13 аминокислот).
Пептиды-антибиотики:
Грамицидин S – это циклический антибиотик, синтезируемый бактериями Bacillus Brevis;
Сурфактин – синтезируется бактериями Bacillus subtitles.
Оба антибиотика применяют при борьбе с инфекционными заболеваниями, вызываемыми стрептококками и пневмококками.
Антибиотики из группы пенициллина – вырабатываются плесневыми грибами Penicillium. По структуре это дипептид, состоит из D-валина и цистеина.
Группа пенициллиновых антибиотиков эффективна при борьбе с инфекциями вызываемыми стафилококками и другими микроорганизмами.
Вкусовые пептиды – сладкие и горькие пептиды.
Аспартам – подсластитель, представляет собой метиловый эфир L-α-аспартил-L-фенилаланин:

Слаще сахарозы в 180 раз. Противопоказан больным фенилкетонурией.
Пептиды горького вкуса – образуются при распаде белков (αs-казеина, β-казеина) в сырах и молоке. Содержат от 2 до 8 аминокислотных остатков.
