
Раздел 1. НЕОРГАНИЧЕСКАЯ ХИМИЯ
Неорганическая химия - это химия элементов Периодической системы элементов Д.И. Менделеева и образованных ими простых или сложных химических соединений (веществ). Неорганическая химия неотделима от общей химии.
Общая химия изучает теоретические представления и концепции, составляющие фундамент всей системы химических знаний.
Стехиометрия - раздел химии, рассматривающий количественный состав веществ и количественные соотношения (массовые, объемные) между реагирующими веществами. Расчеты таких количественных соотношений между элементами в соединениях и между веществами в уравнениях химических реакций, вывод формул называются стехиометрическими расчетами. Их теоретической основой являются фундаментальные законы химии (стехиометрические законы).
Закон эквивалентов.
Эквивалент. Молярная масса эквивалента вещества. Эквивалентный объем
Эквивалент (химический) - это реальная или условная частица вещества, которая в данной кислотно-основной или ионно-обменной реакции эквивалентна одному катиону водорода (протону) либо в данной окислительно-восстановительной реакции одному электрону. Количество эквивалента вещества выражается в молях
(nэ). |
Масса 1 |
моль эквивалента вещества, |
т.е. молярная масса эквивалента |
|||||
|
||||||||
вещества (Мэ), равна произведению фактора |
эквивалентности |
(fэкв) |
на молярную |
|||||
массу вещества (М). |
эквивалентности |
Мэ= fЭKB · М [г/моль]. |
|
доля |
реальной |
|||
|
Фактор |
- число, |
показывающее, какая |
|||||
частицы |
вещества |
эквивалентна |
одному катиону |
водорода в |
данной |
кислотно- |
||
основной |
реакции |
или одному |
электрону |
в |
окислительно-восстановительной |
|||
реакции. |
|
|
|
|
|
|
|
|
Пример1. Определить молярную массу эквивалента (эквивалентную массу)
гидроксида бария Ва(ОН)2 в кислотно-основной реакции. |
|
|
|
|||||
Решение. |
1 .Ва(ОН)2 + 2НСl = ВаС12 + 2Н20; (НС1 в избытке). |
|
||||||
|
В данной реакции участвуют два катиона водорода (Н+). Одному катиону |
|||||||
водорода |
эквивалентна условная частица ½ молекулы |
Ва(ОН)2, а fэкв = ½. |
Молярная |
|||||
масса эквивалента Ва(ОН)2 |
равна: |
|
|
|
|
|
||
|
|
|
Мэ(Ва(ОН)2) = f3KB · М (Ва(ОН)2). |
|
|
|||
|
|
М (Ва(ОН)2)= 137 + 2·16 + 2·1= 171 г/моль. |
|
|
||||
2. Ва(ОН)2 |
|
Мэ(Ва(ОН)2) = ½ 171 = 85,5 г/моль. |
|
|
||||
+ НС1 = BaOHCl + Н20; (НС1 в недостатке). |
которому |
будет |
||||||
В |
этой |
реакции |
участвует |
один |
катион |
водорода, |
||
соответствовать 1 молекула Ва(ОН)2, a fэкв = 1. |
|
|
|
|
||||
|
|
|
Мэ(Ва(ОН)2) = 1 · 171 = 171 г/моль. |
эквивалентности |
||||
Из рассмотренных примеров |
следует: |
эквивалент, фактор |
||||||
и эквивалентная |
масса одного и того же вещества - величина переменная и зависит |
|||||||
она от того, в какую реакцию это вещество вступает. |
|
|
|
|||||
Примечание. Фактор эквивалентности может быть меньше единицы или равен единице.
4
Широко используется такое понятие, как объем эквивалента газообразного вещества (эквивалентный объем). Это объем, который занимает при
нормальных |
условиях |
1моль эквивалентов |
газообразного вещества. |
Известно, что 1 |
||||||||||
моль любого газа |
(н.у.) занимает |
|
постоянный объем, |
равный 22,4 |
л |
(следствие из |
||||||||
закона Авогадро). |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Пример 2. |
Вычислить |
эквивалентный объем кислорода, |
условия |
нормальные |
||||||||||
(н.у.). |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Решение: 1. Вычисляем эквивалентную массу кислорода: |
|
|
|
|
|
|||||||||
|
|
|
|
|
|
Мэ = А / В, |
|
|
|
|
|
|
||
где А- |
атомная |
масса элемента, г/моль (величина |
табличная); |
В |
- валентность |
|||||||||
(степень окисления) элемента. |
|
|
|
|
|
|
|
|
|
|
|
|||
Валентность кислорода |
в |
химических соединениях |
чаще всего |
равняется |
||||||||||
двум, степень окисления = -2. Отсюда, Мэ(О) = 16/2 = 8 г/моль. |
|
|
|
|
|
|||||||||
Из |
закона Авогадро |
следует, |
что 32 г/моль |
O2 |
(1 |
моль |
O2) |
занимают |
||||||
объем 22,4 л, а |
8 г/моль (1 |
моль |
эквивалента O2) будут |
занимать эквивалентный |
||||||||||
объем (объем эквивалента): кислорода: |
|
|
|
|
|
|
|
|
||||||
|
|
|
Vэ(O2) = 22,4 · 8 /32 = 5,6 л/моль. |
|
|
|
|
|
|
|||||
|
|
|
|
Закон эквивалентов |
|
|
|
|
|
|
||||
Массы (объемы) реагирующих друг с другом |
веществ |
прямо |
||||||||||||
пропорциональны их молярным массам эквивалентов (объемам эквивалентов): |
|
|||||||||||||
Эквивалентом |
m1 / m2 = МЭ1 |
/ МЭ2 |
или Vi / V2 = V3I |
/ V32. |
|
|
|
|
||||||
сложного |
вещества |
является такое |
его количество, которое |
|||||||||||
взаимодействует без остатка с одним эквивалентом любого другого вещества. Такие расчеты возможны благодаря закону эквивалентов.
Пример 1. При сжигании 2,28 г металла было получено 3,78 г его оксида. Определить молярную массу эквивалента (эквивалентную массу) металла.
Решение. Находим массу кислорода m (О) = m (оксида) - m(Ме); m (О) = 3,78-2,28= 1,50 г.
По закону эквивалентов: m(Me)/m(0) = Мэ(Ме) / Мэ(0) вычисляем эквивалентную массу металла
Мэ(Ме) = m(Ме)-Мэ(0) / m(О), M3(Me) = 2,28 · 8 /1,5 = 12,16 г/моль.
Пример 2. Из 3,85 г нитрата металла получено 1,60 г его гидроксида. Вычислите эквивалентную массу металла (молярную массу эквивалента).
Решение. При решении задачи следует иметь в виду: а) эквивалентная масса гидроксида металла равна сумме эквивалентных масс металла и гидроксильных групп; б) эквивалентная масса соли равна сумме эквивалентных масс металла и кислотного остатка. По закону эквивалентов:
М3(МеОН) / М3 (MeN03) = m (МеОН) /m(MeN03) или |
|
|
||
М3(Ме) + М3(ОН-) / Мэ (Me) + M3(N03-) = m (МеОН) /m(MeN03) |
|
|||
подставляем числовые значения |
|
|
|
|
М3(Ме) +17 / М3(Ме) + 62 = 1,60 / 3,85, |
|
|
|
|
М3(Ме) = 15 г/моль. |
кислоты |
из 2 |
н раствора |
|
Пример 3. Приготовить 500 мл 0,1 н |
раствора серной |
|||
H2S04. |
взаимодействуют |
друг |
с |
другом в |
Решение. Известно, что вещества |
||||
количествах, пропорциональных их эквивалентам: n31= n32., a n3 = V CN.
5
Отсюда V1- CN1 =. V2- CN2. Исходя из чего растворы с молярной концентрацией эквивалента вещества (нормальность) реагируют друг с другом в объемах, обратно пропорциональных их молярным концентрациям эквивалентов (нормальностям):
V1 / V2 = CN2 / CN1 или V1 · CN1 = V2 · CN2,
где V1, V2 - объемы растворов реагирующих веществ, CN1, CN2 - молярные концентрации эквивалентов (нормальности) этих растворов.
Находим объем (V2) 2 н раствора серной кислоты, применив выражение
V1 · CN1 = V2 · CN2;
V2 = V1 · СN1 / CN2, подставляем числовые значения
V2= 500 · 0,1 /2 = 25 мл.
Объем воды, необходимый для приготовления раствора, вычисляем по разности
V(H20) = V1-V2 ;
V(H20) = 500 - 25 = 475 мл.
Лабораторная работа № 1 Определение молярной массы эквивалента металла методом вытеснения
водорода
Метод основан на измерении объема водорода, который выделяется при взаимодействии кислоты с металлом по уравнению: Me +2НС1 → МеС12 + Н2,
Следовательно, Мэ(Н)=М(Н)/(në), где në - число электронов, принятых 1 моль водорода.
Из уравнения реакции видно, что 2Н+ +2е = Н2, отсюда Мэ(Н)=1/1= 1 г/моль.
Выполнение работы
Проверьте прибор на герметичность, предварительно подобрав пробирку нужного диаметра. Убедившись в герметичности прибора, отсоедините пробирку, налейте в нее 1,0-1,5 мл 2 н раствора соляной кислоты и добавьте 1-2 капли раствора катализатора (CuSO4). Затем осторожно внесите в пробирку взвешенный металл и соедините пробирку с прибором. Запишите в журнал начальный объем воды в бюретке. Наклоните штатив так, чтобы металл упал в кислоту. Наблюдайте выделение водорода и вытеснение воды в уравнительный сосуд (воронку). По окончании реакции следует подождать 1-3 мин, пока газ примет комнатную температуру и уровень жидкости в бюретке станет постоянным. Тогда приведите воду в бюретке и уравнительном сосуде к одному уровню, т.е. создайте в бюретке давление равное атмосферному. По положению нижнего края мениска воды в бюретке определите конечный объем, а затем по разности (Укон - Унач) вычислите объем выделившегося водорода (VH2). Запишите условия проведения определения: температуру и барометрическое давление.
Запись данных опыта и расчеты:
В(валентность металла) = 2 m(масса металла), г =
VНАЧ (начальный объем воды в бюретке), мл = Vкон (конечный объем воды в бюретке), мл =
V(H2) = VНАЧ-VКОН (объём выделившегося водорода), мл = t (температура),°С =
6
Т(абсолютная температура) =273 + t°C, К = Р(атмосферное давление), мм. рт. ст. =
h (Н20) (давление насыщенного водяного пара), мм.рт.ст.= Р(Н2)(парциальное давление водорода) = Р- h (Н20), мм.рт.ст = Числовое значение h н2о берут из справочной таблицы. R(универсальная газовая постоянная), мм.рт.ст мл/моль К
По полученным данным рассчитайте молярную массу эквивалента металла двумя способами:
1-й способ. Применяя уравнение идеального газа Клапейрона - Менделеева
PV= nRT, зная, что n = m/М, вычислите массу водорода в измеренном вами объеме. На основании закона эквивалентов вычислите молярную массу эквивалента металла. По закону эквивалентов:
m(Н2)/m(Ме) = МЭ(Н2)/ Мэ(Ме), откуда Мэ(Ме) = m(Ме) Мэ(Н2) / m(Н2).
II й способ. Приведите объем V(H2) выделившегося водорода к нормальным условиям Vo(H2), используя уравнение объединенного газового закона:
PV/T = PoV0/T0.
Заменив в выражении закона эквивалентов массу и молярную массу эквивалента водорода на пропорциональные им объемные значения:
V0(H2)/m(Me) = V3(H2)/ Мэ(Ме), получим расчетную формулу:
Мэ(Ме)= m (Me) VЭ(H2) / V0(H2).
Зная, что АПРАКТ (Me) = Мэ(Ме)·В(Ме), вычислите практическую атомную (мольную) массу металла. Затем по таблице Д.И. Менделеева определите, какой
это металл. Перепишите из таблицы Д.И. Менделеева теоретическое значение атомной массы металла.
Вычислите погрешности (ошибки) опыта: абсолютную ( = АТЕОР - АПРАКТ) и относительную ( % = ·100/АТЕОР).
Сформулируйте и запишите вывод.
СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Химическая кинетика - раздел физической химии, изучающий вопросы о скоростях и механизмах химических реакций.
Скорость химической реакции определяется изменением концентрации реагирующих веществ за единицу времени в единице реакционного пространства.
Скорость химической реакции зависит от природы реагирующих веществ, их
концентрации, температуры, давления и присутствия катализатора. |
|
|
|||
Зависимость |
скорости |
химической |
реакции |
от |
концентрации |
реагирующих веществ |
выражается основным |
законом химической кинетики - |
|||
законом действия масс: при постоянной температуре скорость химической реакции
прямо |
пропорциональна |
произведению молярных концентраций реагирующих |
||||||
веществ, возведенных в степень их стехиометрических коэффициентов. |
|
|||||||
|
Химические |
реакции, |
в |
которых |
исходные |
вещества |
целиком |
|
превращаются в продукты реакции, называются необратимыми: |
|
|
||||||
|
|
|
2КСlO3 = 2КСl + 3O2 ↑ |
|
|
|
||
|
Значительно |
чаще |
υ1 |
= k1- С2(КСlO3). |
идущие |
одновременно |
в двух |
|
|
происходят |
реакции, |
||||||
противоположных направлениях - прямом и обратном: 2NO + O2 ↔ 2NO2
7
υ1 |
= k1[NO]2·[O2], |
υ2 = k2·[NO2]2. |
|
Состояние обратимой реакции, |
при котором скорости прямой и обратной |
реакций равны между собой, называется химическим равновесием. |
|
При химическом равновесии υ1 = υ2, откуда |
|
Kc = k1/k2 |
= [NO2]2/[NO]2·[O2], |
где Кс - константа химического равновесия (величина табличная), выраженная |
|
через равновесные молярные концентрации реагирующих веществ; к1, к2 - константы |
|
скоростей прямой и обратной химических реакций; [NO2],[NO],[O2] - равновесные молярные концентрации реагирующих веществ.
Для обратимой химической реакции: отношение произведения равновесных концентраций продуктов реакции к произведению равновесных концентраций исходных веществ есть величина постоянная при постоянной температуре и называется константой химического равновесия. Она зависит от температуры, природы реагирующих веществ, наличия катализатора и не зависит от концентраций реагирующих веществ.
Пример 1. Как изменится скорость реакции горения этилена при увеличении
концентрации кислорода в три раза? |
|
|
Решение. |
С2Н4 +3O2 = 2СO2 |
+ 2Н2O. |
Скорость |
реакции горения этилена до |
изменения концентрации кислорода |
равна υ1= k1[C2H4]·[O2]3. (закон действия масс). |
в три раза скорость реакции станет |
|
С увеличением концентрации кислорода |
||
равной
υ1'= k1 [С2 Н4](3[O2])3 = 27k1[С2Н4][O2]3=27 υ1.
Следовательно, скорость увеличивается в 27 раз.
Пример 2. Во сколько раз увеличится скорость реакции при повышении температуры от 20 до 70°С, если температурный коэффициент равен 2?
Решение. Зависимость скорости химической реакции от температуры
определяется правилом Вант-Гоффа (при повышении температуры на каждые 10°С скорость химической реакции возрастает в 2-4 раза) по формуле: υt2 = υt1·γt2-t1/10.
Находим, что
υt1/υt2 = 270-20/10 = 25 = 32.
Следовательно, скорость реакции увеличится в 32 раза.
Пример 3. В какую сторону сместится равновесие в гомогенных системах
1. 2НВr ↔ H2 + Вr2 - 70,18 кДж; 2. 2NO + O2 ↔ 2NO2+117кДж
вследствие повышения давления и температуры?
Решение. В первой системе реакция идет без изменения объема, поэтому изменение давления не вызывает смещения равновесия, а повышение температуры приведет к увеличению скорости прямой эндотермической реакции (принцип Ле - Шателье)
Во второй системе |
повышение давления |
вызовет |
смещение равновесия в |
сторону прямой реакции, |
идущей с уменьшением объема, |
а повышение температуры |
|
- в сторону обратной реакции (эндотермической). |
|
|
|
8
Лабораторная работа № 2 Скорость химических реакций. Химическое равновесие
Опыт 1. Влияние концентрации реагирующих веществ на скорость реакции в гомогенной системе
а) Взаимодействие тиосульфата натрия с серной кислотой
Реакция тиосульфата натрия с серной кислотой протекает по уравнению:
Na2S203 + H2S04 = Na2S04 + S ↓ + S02 ↑ + H20.
Выполнение работы. Предварительно проделать качественную реакцию, для
чего в пробирку внести 10 капель раствора тиосульфата натрия (Na2S2G3) и 1 каплю |
||||
2 н раствора |
серной кислоты |
(H2S04). Наблюдать |
появление слабой опалесценции |
|
(сине-фиолетовое |
свечение) и |
дальнейшее помутнение раствора от выпавшей |
||
свободной серы. |
|
|
|
|
В |
трех |
сухих пробирках приготовить |
растворы тиосульфата натрия |
|
различных концентраций. Для чего: в 1-ю пробирку внести 5 капель 1 н раствора тиосульфата натрия и 10 капель дистиллированной воды, во 2-ю - 10 капель тиосульфата натрия и 5 капель воды, в 3-ю - 15 капель тиосульфата натрия. Растворы в первой и второй пробирках тщательно перемешать. Таким образом, относительная концентрация Na2S203 (в моль) будет в пробирке №1-1С, в пробирке №2 - 2С, в пробирке №3-3C.
Включить секундомер, затем в пробирку №1 внести одну каплю 2 н раствора серной кислоты, тщательно перемешать. По секундомеру измерить время от момента добавления кислоты до появления в растворе заметной опалесценции (синефиолетовое свечение). Также последовательно внести по одной капле раствора серной кислоты в пробирки №2 и №3 и измерить время от момента добавления H2S04 до появления в растворе заметной опалесценции.
Данные опыта занести в таблицу. |
|
|
|
|
|||
|
|
Запись данных опыта |
|
|
|||
Номер |
Число |
Число |
|
Число |
Концентра |
Время |
Скорость |
пробирки |
капель |
капель |
|
капель |
ция |
τ, |
реакции |
|
Na2S203 |
Н20 |
|
H2SO4 |
Na2S203 |
с |
1/ τ |
1 |
10 |
0 |
|
1 |
Качественная реакция / |
||
2 |
5 |
10 |
|
1 |
1С |
|
|
3 |
10 |
5 |
|
1 |
2С |
|
|
4 |
15 |
0 |
|
1 |
ЗС |
|
|
Начертить график зависимости скорости реакции от концентрации одного из реагирующих веществ. На оси абсцисс отложить в определенном масштабе относительные концентрации тиосульфата натрия, на оси ординат - соответствующие им скорости. Сформулировать и написать вывод в соответствии с законом действия масс.
Опыт 2. Смещение химического равновесия обратимых реакций
а) Влияние концентрации реагирующих веществ на смещение равновесия
Выполнение работы. В четыре конические пробирки внести по 5 капель 0,0025 н раствора хлорида железа (III) (FeCl3) и по 5 капель 0,0025 н раствора тиоцианата (роданида) калия (KSCN). Растворы тщательно перемешать и поставить в штатив. Напишем уравнение реакции:
FeCl3 + 3KSCN → Fe(SCN)3 + ЗКС1.
9
Пробирку №1 с |
полученным раствором (контроль) сохранить для |
||
сравнения |
с результатами |
опытов. В остальные |
пробирки добавить следующие |
реактивы: |
в пробирку №2 - 1 |
каплю насыщенного |
раствора хлорида железа (III), №3 - |
1 каплю насыщенного раствора тиоцианата калия, №4 - 1 каплю насыщенного раствора хлорида калия (КС1). Сравнить интенсивность окраски полученных растворов с интенсивностью окраски контрольного раствора.
Запись данных опыта. Записать свои наблюдения. Написать кинетические уравнения для прямой и обратной реакций и выражение константы равновесия.
Ответьте на следующие вопросы: 1. Какие вещества |
находятся в исследуемом |
растворе в состоянии равновесия? 2. Какое вещество |
придает раствору кроваво- |
красную окраску? 3. Как изменяется интенсивность окраски раствора, и в каком направлении смещается равновесие данной равновесной системы при добавлении избытка: а) хлорида железа (III);
б) тиоцианата (роданида) калия; в) хлорида калия?
Сформулировать и написать вывод в соответствии с принципом Ле Шателье.
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ Электролитическая диссоциация - распад ионной молекулы на ионы под
действием воды или другого растворителя. Вещества, полностью или частично распадающиеся в растворе или расплаве на ионы, называются электролитами.
Пример. Написать ионно-молекулярные уравнения реакций взаимодействия между водными растворами следующих веществ: а) НС1 и КОН; б) Pb(N03)2 и Na2S;
в) NaCIO и HN03; г) К2С03 и H2S04; д) СН3СООН и NaOH.
Решение. Ионно-молекулярные или просто ионные уравнения реакции обмена отражают состояние электролита в растворе. Сильные электролиты, как полностью диссоциированные, записывают в виде ионов. Слабые электролиты, малорастворимые и газообразные вещества записывают в виде молекул. Затем одинаковые ионы из обеих частей уравнения исключаются. При составлении ионных уравнений следует помнить, что сумма зарядов в левой части уравнения должна равняться сумме зарядов в его правой части, т.е. реакция в целом электронейтральна.
Запишем уравнения реакций взаимодействия перечисленных веществ в молекулярном виде:
а) НС1 + КОН = КС1+ Н20;
б) Pb(N03)2 + Na2S = PbS ↓ + 2NaNQ;
в) NaCIO + HN03 = NaN03 + HC10;
г) K2C03 + H2S04 = K2S04 + C02↑ +H20;
д) CH3COOH + NaOH = CH3COONa + H20.
Следует отметить, что все указанные реакции будут протекать, так как в результате взаимодействия веществ происходит связывание ионов с образованием слабых электролитов (Н20, НС1О), осадка (PbS), газа (С02).
Запишем эти уравнения в ионном виде:
а) Н+ + Сl- + К++ ОН- = К++ Сl- + Н20;
б) Pb2++ 2NO3- + 2Na++ S2- = PbS + 2Na++ 2N03- ; в) Na++ C10- + H++ N03- = Na++ N03- + HCIO;
г) 2K++ CO32- + 2Н++ S042- = 2K+ + SO42- + C02 + H20;
д) CH3COOH + Na+ + OH- = CH3COO- + Na+ + H20.
Исключив одинаковые ионы из обеих частей равенства, получим ионномолекулярные уравнения соответствующих реакций:
10
а) Н+ + ОН- = Н20;
б) Рb2++ S2- = PbS; в) СlO- + Н+ = НСlO;
г) С032- + 2Н+ = С02 + Н20;
д) СНзСООН +ОН- = СН3СОО-+H2O.
|
|
|
Лабораторная работа № 3 |
|
|
|
|
|
||||
|
|
|
Электролитическая диссоциация |
|
|
|
|
|||||
Опыт 1. Смещение равновесия диссоциации слабых электролитов |
|
|
||||||||||
а) Влияние соли слабой кислоты на диссоциацию этой кислоты |
|
|
|
|||||||||
Выполнение работы. В две |
пробирки |
внести |
по 5 |
капель |
0,1 |
н |
раствора |
|||||
уксусной кислоты (СН3СООН), которая распадается незначительно на ионы: |
|
|
||||||||||
Затем в |
|
CH3COOH ↔ CH3COO- + Н+ (Ка = 1,8 10-5). |
|
- |
метилового |
|||||||
каждую пробирку |
прибавить |
по 1 |
капле |
индикатора |
||||||||
оранжевого. Под влиянием каких ионов метиловый |
оранжевый приобретает красный |
|||||||||||
цвет? |
Одну |
пробирку с уксусной |
кислотой |
оставить в |
качестве контрольной, а в |
|||||||
другую |
внести 3 |
капли насыщенного |
раствора |
ацетата |
натрия |
(CH3COONa → |
||||||
СН3СОО- + |
Na+) |
и перемешать раствор. |
Сравнить |
окраску |
полученного |
раствора с |
||||||
окраской раствора в контрольной пробирке. На изменение концентрации каких ионов указывает изменение цвета метилового оранжевого?
Запись данных опыта. Написать выражение константы диссоциации уксусной кислоты. Объяснить, как согласно принципу Ле Шателье смещается равновесие диссоциации кислоты при добавлении к ней ацетата натрия. Как меняются при этом
степень диссоциации уксусной кислоты и концентрация ионов водорода [Н+]? |
|
|
б) Влияние соли слабого основания на диссоциацию этого основания |
|
|
Выполнение работы. В две пробирки внести по 5 капель 0,1 |
н |
раствора |
аммиака NH3·H20 (Кв=2,0·10-5). В каждую пробирку прибавить по |
1 капле |
|
индикатора - фенолфталеина. Под влиянием каких ионов фенолфталеин приобретает
малиновый |
цвет? |
Одну |
пробирку с раствором аммиака |
оставить |
в качестве |
|
контрольной, |
а в |
другую внести несколько |
кристалликов |
хлорида |
аммония |
|
(NH4C1→NH4++Сl-) |
и раствор |
тщательно |
перемешать. |
Сравнить |
окраску |
|
полученного раствора с окраской раствора в контрольной пробирке. На изменение концентрации каких ионов указывает изменение цвета фенолфталеина?
Запись данных опыта. Схема равновесия в водном растворе аммиака: NH3+H20→NH4++0H-. Объяснить, как смещается равновесие в этом растворе при добавлении к нему хлорида аммония. Почему при этом цвет фенолфталеина становится менее интенсивным (розовый)?
Опыт 2. Характер диссоциации гидроксидов Выполнение работы. Поставить в два ряда 10 пробирок. Затем в две пробирки
№1 внести по 2 капли 0,5 н раствора хлорида магния (MgCl2), №2 - нитрата |
|||
алюминия (Аl(NO3)3), №3 - силиката |
натрия (Na2Si03), |
№4 - сульфата |
никеля |
(NiS04), №5 - сульфата цинка (ZnS04). |
В две пробирки |
№№ 1,2,4,5 по |
каплям |
добавлять 2 н раствор гидроксида натрия (NaOH) до выпадения осадков гироксидов магния, алюминия, никеля и цинка. В две пробирки №3 добавлять до выпадения осадка гидроксида кремния (кремниевая кислота) 2 н раствор хлороводородной кислоты. Написать уравнения протекающих реакций. Отметить цвет осадков.
Определить химический характер гидроксидов. Для этого в один ряд пробирок с осадками добавить по 4 капли раствора гидроксида натрия, а в другой -
11
по 4 капли раствора хлороводородной кислоты. В каких случаях осадки растворились только в щелочи, только в кислоте и какие осадки растворились и в щелочи, и в кислоте? Написать уравнения соответствующих реакций. При этом следует учесть, что при растворении амфотерных гидроксидов в водных растворах щелочей образуются гидроксокомплексы. Например, при растворении гидроксида цинка в растворе гидроксида натрия образуется тетрагидроксоцинкат натрия:
Zn(OH)2 + 2NaOH - Na 2[Zn(OH)4].
Запись данных опыта
Указать кислотными, основными или амфотерными свойствами обладают гидроксиды магния, алюминия, кремния, никеля, цинка? Составить уравнения диссоциации (без ступеней) полученных гидроксидов, без учета процессов гидратации.
|
ПРОИЗВЕДЕНИЕ РАСТВОРИМОСТИ |
|
|
|||
Гетерогенное равновесие: осадок ↔ насыщенный |
раствор подчиняется |
|||||
правилу произведения растворимости |
- |
в насыщенном растворе |
трудно |
|||
растворимого |
электролита |
произведение |
концентраций |
(активностей) |
ионов, |
|
возведенных в степени стехиометрических коэффициентов, есть величина постоянная |
||||||
при данной температуре. |
|
|
|
|
|
|
Если малорастворимый электролит распадается на ионы по уравнению: |
|
|||||
|
Са3(Р04)2 = ЗСа2+ + 2Р043-, |
|
|
|||
то выражение для произведения растворимости будет иметь вид: |
|
|||||
ПР(Са3(Р04)2) = а3(Са2+) · а2(Р043-) = fa(Ca2+)[Ca2+]3·fa(P043-)·(P043-]2. |
|
|||||
В разбавленных растворах, какими являются насыщенные растворы трудно |
|
|||||
растворимых электролитов, при fa =1, а = С, тогда: ПP(Ca3(P04)2) = [Са2+]3·[Р043-]2., |
|
|||||
Отсюда вытекают два следствия: |
|
|
|
|
||
1. Условие |
растворения |
осадка: |
произведение |
концентраций |
ионов, |
|
возведенных в степень стехиометрических коэффициентов, должно быть меньше
величины произведения растворимости. ПР(Са3(Р04)2) > [Са2+]3·[Р043-]2. |
||||
2. Условие |
образования |
осадка: |
произведение |
концентраций ионов, |
возведенных в степень стехиометрических коэффициентов, должно быть больше
величины произведения растворимости. ПР(Са3(Р04)2) < [Са2+]3·[Р043-]2. |
|
|
||||||
Пример 1. Растворимость (S) карбоната кальция в воде при температуре 25° С |
||||||||
составляет 6,9 · 10 -5 моль/л. Найти ПР(СаС03). |
|
S |
S |
S |
|
|||
Решение. В насыщенном растворе карбоната кальция: СаС03 ↔ Са2++С032-, |
|
|||||||
[Са2+] = |
[С032-] = S = 6,9 10 -5 |
моль/л. Отсюда ПР(СаСОэ) = [Ca2+][C032-]=S·S= |
||||||
S2. |
|
|
|
|
|
|
|
|
Подставляем числовые значения: ПР(СаС03) = (6,9 10 -5)2 = 4,8 10 |
|
1,1 10-9. |
||||||
Пример |
2. Произведение растворимости |
йодида |
свинца |
ПР(РbI2) = |
||||
Чему равна S (растворимость) йодида свинца? |
S |
S |
2S |
|
|
|||
Решение. |
Запишем уравнение |
диссоциации: РbI2 |
↔ РЬ2+ |
+ 2I-. |
Из |
каждой |
||
молекулы йодида свинца образуются один ион РЬ2+ и два иона I-. Следовательно, в |
||||||||
насыщенном |
растворе PbI2 |
растворимость ионов |
свинца [Pb2+] |
= S, а йодид |
- ионов |
|||
[I-] - 2S. Отсюда получаем: ПР(PbI2) = [РЬ2+] [I-]2 = S |
(2S)2 = |
4S3. |
Растворимость |
|||||
йодида свинца |
|
|
|
|
|
|
|
|
12

Лабораторная работа № 4 Произведение растворимости
Опыт 1. Дробное осаждение Выполнение работы. В две пробирки внести по 1 капле 0,5 н раствора
нитрата серебра (AgN03). В пробирку №1 добавить 2 капли 0,5 н раствора хлорида
калия (AgN03+KCl→AgCl ↓ +KN03), №2 - 2 капли 0,5 н раствора хромата калия
(2AgN03+K2Cr04→Ag 2СrO4 ↓ +2KNO3). |
|
|
|
|
|
|
|
|||
Написать ионные уравнения реакций, отметить цвет осадков хлорида и |
||||||||||
хромата серебра. |
|
|
|
|
|
|
|
|
|
|
Какое |
вещество будет |
выпадать |
в осадок |
первым |
из |
раствора, |
содержащего |
|||
ионы Сl-, СЮ42- и Ag+ в равных концентрациях? |
|
|
|
|
|
|
||||
|
ПР(AgCl)=l,810-10; |
|
|
ПР(Ag2Cr04)=4 · 10-12. |
№3 |
внести |
||||
Проверить |
предположение опытом, |
для чего |
в |
пробирку |
||||||
сначала 2 |
капли 0,5 н раствора хлорида калия |
|
(КСl), затем 2 капли 0,5 н раствора |
|||||||
хромата |
калия |
(К2СrO4), |
добавить |
3 капли |
дистиллированной воды. |
Раствор |
||||
тщательно перемешать. Осторожно прибавить к нему 1 каплю 0,5 н раствора нитрата серебра (AgN03), перемешать. Какое вещество при этом образуется? Добавить ещё несколько капель раствора нитрата серебра, тщательно перемешать. Наблюдается ли образование хромата серебра? Отметить его образование при дальнейшем увеличении концентрации ионов серебра.
Запись данных опыта. Описать наблюдаемые явления. Написать выражения
произведений растворимости |
хлорида и хромата серебра. Объяснить, |
применив |
|||||
следствие |
правила |
произведения растворимости, |
последовательность |
образования |
|||
осадков |
в данном |
опыте |
(пробирка №3), учитывая |
величины |
произведений |
||
растворимости хлорида и хромата серебра. На все вопросы ответить письменно. |
|
||||||
|
|
Опыт 2. Условия растворения осадков |
|
|
|
||
а) Влияние величины произведения растворимости на растворение осадков. |
|
||||||
Выполнение работы. В три пробирки внести по 1 капле 0,5 н |
раствора |
||||||
нитрата серебра (AgN03). Затем в первую пробирку добавить 1 каплю 0,5 н |
раствора |
||||||
хлорида калия (AgN03+KCl→AgCl↓ +KN03), во вторую – 1 |
каплю 0,5 |
н |
раствора |
||||
бромида калия (AgN03+KBr→AgBr↓+KN03), в третью - 1 |
каплю 0,5 н раствора йодида |
||||
калия |
(AgN03+Kl→Agl ↓+KN03). |
Отметить цвет |
н |
образовавшихся осадков. К |
|
осадкам |
в каждую пробирку добавлять по каплям 2 |
водный |
раствор аммиака |
||
(NH3·H20), тщательно перемешивая полученные растворы. В какой пробирке осадок растворился быстрее? Осадок какого вещества практически не растворим?
Запись данных опыта. Написать уравнения реакций растворения осадков соответствующих галогенидов серебра в водном растворе аммиака, протекающих с
образованием комплексного иона [Ag(NH3)2]+ |
(AgCl+2NH3·H20=[Ag(NH3)2]++ |
|
Сl-+2Н20.) Написать выражения произведений растворимости хлорида, |
бромида и |
|
йодида серебра (ПP(AgCl)=l,8·10-10; ПP(AgBr)=6·10-13; ПP(AgI)=1,1·10-16). Как влияет |
||
величина произведения растворимости на растворимость сильных, |
но трудно |
|
растворимых электролитов? |
|
|
13
|
|
ГИДРОЛИЗ СОЛЕЙ |
|
|
Химическое |
обменное взаимодействие ионов растворенной соли с водой |
|||
(растворителем), |
приводящее |
к |
образованию слабодиссоциирующих |
продуктов |
(молекул слабых |
кислот или |
|
оснований, анионов кислых солей или |
катионов |
основных солей) и сопровождающееся изменением реакции среды (рН), называется
гидролизом.
Пример 1. Составьте ионно-молекулярные и молекулярные уравнения гидролиза (1 ступень) следующих солей: a) KF; б) Cu(NO3)2; г) Na2S. Укажите реакцию среды растворов этих солей.
Решение. а) Фторид калия - KF ↔ К+ + F-, соль образована слабой кислотой
HF и сильным основанием КОН. Гидролиз простой будет протекать по аниону. F- + НОН ↔ HF + ОН-.
Ионно-молекулярное уравнение гидролиза:
К++ F- + НОН ↔ HF + ОН- + К+ или в молекулярной форме:
KF + Н20 ↔ HF + КОН .
В результате гидролиза в растворе увеличивается концентрация гидроксидионов, поэтому раствор KF имеет щелочную реакцию (рН > 7).
б) нитрат меди (II) - Cu (N03)2 ↔ Cu2+ + 2N03-, соль образована слабым основанием Сu(ОН)2 и сильной кислотой НСl. Гидролиз сложный ступенчатый будет
протекать по катиону:
I ступень: Сu2+ + НОН ↔ (СuОН)++ Н+.
Ионно-молекулярное уравнение гидролиза: 2N03-+ Сu2+ + НОН ↔ (CuOH)+ + Н++ 2N03-.
В молекулярной форме:
Cu (N03)2 + H20 ↔ (Cu0H)N03 + HN03.
В результате гидролиза в растворе увеличивается концентрация ионов водорода, поэтому раствор Cu(N03)2 имеет кислую реакцию (рН <7).
в) сульфид натрия - Na2S ↔ 2Na+ + S2-, соль образованна сильным основанием NaOH и слабой кислотой H2S. Гидролиз сложный ступенчатый будет протекать по аниону:
I ступень: S2- + НОН ↔ HS- + ОН-
Ионно-молекулярное уравнение гидролиза
2Na+ + S2- + НОН ↔ HS- + ОН-+ 2Na+,
В молекулярной форме:
Na2S + НОН ↔ NaHS + NaOH.
В результате гидролиза в растворе увеличивается концентрация гидроксидионов, поэтому раствор Na2S имеет щелочную реакцию (рН > 7).
Пример 2. Вычислить константу гидролиза и степень гидролиза хлорида аммония (NH4CI) в 0,2 М растворе.
Решение: Соль образована слабым основанием NH3·H20 и сильной кислотой НС1.
Уравнение диссоциации соли NH4CI ↔ NH4+ + Сl-.
Гидролиз будет протекать по катиону. Уравнение реакции гидролиза: NH4+ + Н20 ↔ NH3·H20 + Н+.
14

Найдем константу гидролиза: Кг = КH20/Косн, где К H20 - ионное произведение воды
(10-14). Косн - константа диссоциации основания (1,8·10-5).
КГ= 10-14 / 1,8·10-5 = 5,56·10-10.
Вычисляем степень гидролиза 
Лабораторная работа № 5 Гидролиз солей
Опыт 1. Реакция среды (рН) в растворах различных солей
Выполнение работы. Подготовить семь пробирок. В каждую пробирку внести 1 каплю индикатора (нейтральный раствор лакмуса). Затем в 1-ю пробирку добавить
5 капель дистиллированной воды (контроль), а в остальные - по 5 капель |
0,5 н |
растворов следующих солей: во 2-ю - ацетат натрия (CH3COONa). в 3-ю - нитрат алюминия (Al(NO3)3), в 4-ю - карбонат натрия (Na2CO3), в 5-ю - карбонат аммония
((NH4)2C03), В 6-ю - хлорид калия (KCI), в 7-ю - ацетат аммония (CH3COONH4).
Все растворы |
тщательно |
перемешать. |
По изменению цвета лакмуса в |
растворах солей по |
сравнению |
с контрольной |
пробиркой сделать вывод о реакции |
среды в растворе каждой соли.
Запись данных опыта. Полученные результаты свести в таблицу:
Номер |
Формула |
Цвет |
Реакция |
рН раствора |
пробирки |
соли |
Лакмуса |
среды |
рН > 7 |
|
|
|
|
рН <7 |
|
|
|
|
рН =7 |
Какие из исследованных солей подвергаются гидролизу? Написать ионные и молекулярные уравнения реакций их гидролиза и указать вид гидролиза каждой соли (простой или сложный ступенчатый).
В случае ступенчатого гидролиза написать уравнение реакции только для первой ступени, так как практически в достаточно концентрированных растворах последующие ступени протекают очень слабо.
Опыт 2. Факторы, влияющие на степень гидролиза солей
а) Влияние силы кислоты и основания, образующих соль, на степень её гидролиза.
Выполнение работы. Подготовить две пробирки, затем в одну пробирку внести несколько кристалликов сульфита натрия (Na2S03), в другую - столько же кристалликов карбоната натрия (Na2C03). В каждую пробирку добавить по 4 капли дистиллированной воды и по 1 капле фенолфталеина.
Написать ионные уравнения гидролиза сульфита натрия и карбоната натрия по первой ступени. В растворе какой соли цвет фенолфталеина интенсивнее? В каком растворе концентрация гидроксид-ионов (ОН-) более высокая? Вычислить константу гидролиза каждой соли. Константа гидролиза какой соли больше? Почему?
Сделать общий вывод о влиянии силы кислоты или основания, образующих соль, на степень её гидролиза.
б) Влияние разбавления раствора на степень гидролиза соли
15
Выполнение работы. В пробирку внести 2 капли раствора 0,5 н хлорида
сурьмы (III) (SbCl3) и постепенно по каплям добавлять дистиллированную воду до |
||||
выпадения осадка хлорида |
оксосурьмы (SbOCl). Этот |
осадок образуется |
на второй |
|
ступени гидролиза |
из |
хлорида дигидроксосурьмы |
(Sb(OH)2Cl) |
вследствие |
отщепления воды. |
|
|
|
|
Запись данных опыта. Написать ионные уравнения первой и второй ступеней гидролиза хлорида сурьмы (III) и общее уравнение её гидролиза до образования
Sb(OH)2Cl. Написать |
формулу для вычисления константы гидролиза хлорида сурьмы |
||
(III) |
для |
первой |
ступени. Показать при помощи этой константы, как влияет |
разбавление на степень гидролиза хлорида сурьмы (III)? Проверить свое заключение опытом. Сделать общий вывод о влиянии разведения на степень гидролиза солей.
Опыт 3. Случаи полного (необратимого) гидролиза солей |
|
Выполнение работы. В две пробирки внести по 2 капли |
0,5 н раствора |
нитрата алюминия (A1(N03)3). Затем в пробирку №1 добавлять |
по каплям 0,5 н |
раствор сульфида нагрия (Na2S), №2 - 0,5 н раствор карбоната натрия (Na2C03) до |
||
выпадения осадка гидроксида алюминия (А1(ОН)3). |
Отметить |
выделение |
сероводорода (H2S) в первой пробирке и диоксида углерода (С02) - во второй.
Запись данных опыта. Написать в ионном виде уравнения реакций гидролиза,
которые привели к образованию гидроксида алюминия в обоих случаях, сероводорода в первом и диоксида углерода - во втором случае. Составить общие уравнения протекающих реакций. Объясните, почему не образуются сульфид и карбонат алюминия.
ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ. БУФЕРНЫЕ РАСТВОРЫ
Большинство реакций, применяемых в анализе, протекают в водных растворах. Вода относится к слабым электролитам и хотя в незначительной степени, но подвергается ионизации:
Процесс |
ионизации |
Н20 ↔ Н+ + ОН-. |
константой |
ионизации |
|
воды |
характеризуется |
||||
(диссоциации): |
[Н+]·[ОН-] / [Н20] = К(Н20). |
|
(1) |
||
|
|
||||
Преобразуем это уравнение: |
|
|
|
|
|
|
[Н+]·[0Н-] = К(Н20)·[Н20]. |
|
(2) |
||
В приведенном уравнении |
[Н20] |
(при постоянной |
температуре) |
можно считать |
|
практически постоянной. Следовательно, правая часть уравнения (2), а значит, и
произведение |
[Н+]·[ОН-] - величина постоянная. |
Её называют |
ионным |
|
произведением воды и обозначают Kw: |
|
|
||
|
|
Kw: = [Н+]·[ОН-]. |
|
(3) |
При температуре |
25° С в чистой воде [Н+] = [ОН-] = |
10-7моль/л, следовательно, |
||
Kw = 10-7·10-7 = |
10-14. При повышении температуры Kw быстро увеличивается. |
|||
Смысл уравнения (3) заключается в следующем: как бы не изменялась концентрация ионов Н+ и ОН-, их произведение [Н+]·[ОН-] в любом водном растворе сохраняет постоянное значение равное 10-14 при 25 °С.
Вместо концентрации [Н+] удобнее пользоваться отрицательным десятичным
логарифмом из этой величины - водородным показателем (рН). |
|
pH = - lg[H+], |
(4) |
16
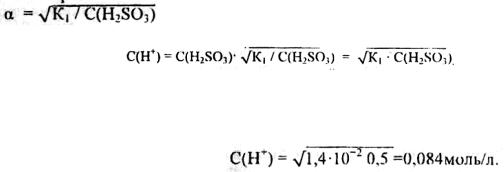
Кроме водородного показателя (рН) при расчетах широко используют и гидроксильный показатель (рОН) и прологарифмированный показатель ионного произведения воды
рОН =-lg[OH-] pKw = -lgKw. pKw = pH + pOH.
В кислых растворах pH <7, в щелочных растворах рН >7, в нейтральных растворах рН = 7.
Пример 1. Вычислить рН и рОН 0,25 М раствора Са(ОН)2 Решение: Запишем уравнение электролитической диссоциации гидроксида
кальция, |
являющегося |
сильным электролитом. Са(ОН)2 |
→ |
Са2+ |
+ |
20Н-. |
||||||
Из уравнения диссоциации видно, что [ОН- ] =2[Са(ОН)2]= 2·0,25 = 5·10-1 моль/л. |
|
|||||||||||
Вычислим рОН по уравнению рОН = - lg [ОН-]; |
|
|
|
|
|
|
|
|||||
|
|
|
|
рОН = - lg 5·10-1 = 1 - lg 5 = 1 - 0,7 = 0,3 |
|
|
|
|
|
|||
Вычислим рН по уравнению рН = 14 - рОН ; рН = 14 - 0,3 = 13,7. |
|
|
|
|
||||||||
Пример |
2. Какова |
концентрация |
гидроксид |
- |
ионов |
в |
растворе, рН |
|||||
которого 10,8? |
|
|
|
|
|
|
|
|
|
|
|
|
Решение. Находим концентрацию ионов водорода в растворе |
|
|
|
|
|
|||||||
|
|
|
|
рН = - lg [Н+] ; [Н+] = 10-pH; |
|
|
|
|
|
|
||
|
|
|
|
[Н+] = 10-10,8 =10-11·100,2 =1,6 ·10-11 моль/л. |
|
|
|
|
||||
|
|
|
|
[Н+] = 1,6 · 10-11 моль/л. |
|
|
|
|
|
|
||
Так |
как |
произведение [Н+]·[ОН-]= |
10-14, то |
[ОН-]= 10-14/ 1,6·10-11= |
6.25·10 4 |
|||||||
моль/л. |
|
|
|
|
|
|
|
|
|
|
|
|
Пример 3. Вычислить рН и рОН 0.5 М раствора сернистой кислоты H2SO3. |
|
|||||||||||
Решение. |
Сернистая |
кислота (H2S03) - электролит |
средней |
силы, |
диссоциирует |
|||||||
по двум ступеням. Для расчета концентрации ионов водорода Н+ будем учитывать |
||||||||||||
диссоциацию сернистой кислоты только по первой ступени — H2S03 |
↔ Н++ HSO3-. |
|||||||||||
Доля (степень диссоциации) молекул, распавшихся на ионы, определяется |
||||||||||||
выражением: а = С(Н+) / C(H2S03), откуда С(Н+) = a C(H2SO3). (1) |
|
|
|
|
|
|||||||
Из выражения закона разбавления Оствальда найдем К1= a2 C(H2S03) (2). |
||||||||||||
откуда |
|
|
|
(3), подставляем в уравнение (1), |
|
|
|
|
|
|||
где К1 - константа |
диссоциации |
сернистой |
кислоты |
по |
первой |
ступени, |
||||||
числовое значение которой переписываем из справочной таблицы. |
|
|
|
|
||||||||
К1= 1,4 10-2. |
|
|
|
|
|
|
|
|
|
|
||
Подставляем числовые значения |
|
|
|
|
|
|
|
|
||||
Вычислим рН |
рН = -lg С(Н+); |
|
|
|
|
|
|
|
|
|||
|
|
|
рН = -lg 8,4·10-2 = 2 - lg 8.4= 2 - 0,92=1.08. |
|
|
|
|
|||||
Вычислим рОН |
рОН = 14 - рН; |
|
|
|
|
|
|
|
|
|||
|
|
|
|
рОН = 14 -1,08 = 12,92. |
|
|
|
|
|
|
|
|
17
Пример 4. В |
каких соотношениях следует |
взять растворы 0,1 н |
СН3СООН и |
||
0,1 н CH3COONa для приготовления буферной смеси с рН = 4,73. |
|
||||
Решение. рН |
буферной |
смеси можно вычислить |
по уравнению буферного |
||
действия. Для ацетатных смесей |
|
|
|
|
|
рН = рКкисл - lg Скисл / Ссоли. |
|
|
|
||
где рКкисл = - lg Ккисл. - силовой показатель кислоты. |
|
||||
Для аммонийных буферных смесей |
|
|
|
||
|
рН = 14 - рКосн. + lg Сосн / Ссоли , |
|
|||
где рКосн = -lg Косн - силовой показатель |
основания. |
Следует |
помнить, что |
||
силовой показатель можно |
вычислить для |
слабых электролитов, |
для которых |
||
справедлив закон действия масс и существуют термодинамические константы диссоциации Кдисс.
Если концентрации растворов, составляющих буферную смесь, одинаковы, то величина рН будет зависеть от объемов растворов
рН = рКкисл - lg Vкисл / Vсоли. Для ацетатного буферного раствора
рКкисл = -lg 1,8 10-5 = 4,73. Отсюда 4,73 = 4,73 - lg Vкисл /Vсоли, т.е.
lg Vкисл / Vсоли = 0.
Следовательно, Vкисл / Vсоли = 1 или Vкисл = Vсоли.
Для приготовления ацетатного буферного раствора с рН = 4,73 надо смешать равные объемы 0,1 н растворов уксусной кислоты и ацетата натрия.
Лабораторная работа № 6 Водородный показатель. Буферные растворы
Опыт 1. Приближенное определение рН в водных растворах при помощи индикатора
а) Окраска некоторых кислотно-основных индикаторов в различных средах
Выполнение работы. Определить окраску кислотной и щелочной форм наиболее часто применяемых кислотно-основных индикаторов: метилового оранжевого, метилового красного, лакмуса и фенолфталеина. Наблюдения провести в
сильнокислой и сильнощелочной среде, чтобы в первом случае |
рН был заведомо |
ниже, а во втором - заведомо выше области перехода указанных |
индикаторов. Для |
чего в четыре пронумерованные пробирки внести по 4 капли 0,1 н раствора
хлороводородной |
(соляной) |
кислоты, а в другие четыре пробирки с теми же номерами |
||
по 4 |
капли 0,1 н |
раствора |
гидроксида натрия. Пробирки в |
штативе поставить в два |
ряда |
таким образом, чтобы в одном ряду стояли только |
пробирки с кислотой, а в |
||
другом - пробирки со щелочью. После этого в обе пробирки №1 добавить по 1 капле индикатора метилового оранжевого, в пробирки №2 - метилового красного, в пробирки №3 - лакмуса, в пробирки №4 - фенолфталеина.
Запись данных опыта. Наблюдения по цвету кислотной и щелочной форм индикаторов записать по прилагаемой ниже схеме, где уже указаны интервалы рН областей перехода каждого индикатора и цвет его в этой области.
18
|
рН |
|
|
Цвет индикатора |
|
|
||
Индикатор |
области |
Номер |
Кислот- |
|
В области |
|
Номер |
Щелоч- |
|
перехода |
проб. |
ной |
|
перехода |
|
проб. |
ной |
|
|
|
формы |
|
|
|
|
формы |
Метиловый |
|
1 |
|
|
|
|
1 |
|
оранжевый |
3,1-4,4 |
НС1 |
|
|
Оранжевый |
|
NaOH |
|
Метиловый |
|
2 |
|
|
|
|
2 |
|
красный |
4,4 - 6,2 |
HCI |
|
|
Оранжевый |
|
NaOH |
|
|
|
3 |
|
|
|
|
3 |
|
Лакмус |
5,0 - 8,0 |
НС1 |
|
|
Фиолетовый |
|
NaOH |
|
|
|
4 |
|
|
|
|
4 |
|
Фенолфталеин |
8,2-10 |
НС1 |
|
|
Розовый |
|
NaOH |
|
Область перехода какого из |
исследованных индикаторов находится ближе |
всего к нейтральной среде? Какие |
индикаторы имеют область перехода в кислой |
среде? В щелочной? Вычислить водородный показатель (рН) 0.002 н раствора хлороводородной кислоты (НСЛ) и 0,01 н раствора гидроксида натрия (NaOH).
Опыт 2. Определение водородного показателя (рН) в водном растворе соли с помощью универсального индикатора
Для приближенного определения рН удобно пользоваться так называемыми универсальными индикаторами, представляющими собой смеси нескольких индикаторов, изменяющими свой цвет в водных растворах различных веществ в широком диапазоне рН. Бумага, пропитанная универсальным индикатором и высушенная, называется универсальной индикаторной бумагой. К пачке такой бумаги прилагается цветная шкала, показывающая, какой цвет принимает индикаторная бумага (значение рН) при нанесении на неё 1 капли исследуемого раствора. Универсальные индикаторы применяют и в виде растворов. В этом случае готовится серия эталонов в герметически закрытых сосудах с указанием на каждом из них рН, соответствующего цвету эталона - раствора.
Выполнение работы. Получить у преподавателя раствор, водородный показатель (рН) которого требуется определить. При помощи пипетки нанести 1 каплю исследуемого раствора на универсальную индикаторную бумагу. Сравнить окраску пятна, образовавшегося на бумаге, с цветной шкалой и выбрать оттенок, наиболее близкий к цвету полученного пятна. На цветной шкале приводятся цвета, соответствующие целым значениям рН, поэтому в случае необходимости можно по промежуточной окраске пятна ориентировочно оценить десятые доли рН. Сделать вывод о рН исследуемого раствора и указать реакцию среды. Проверить правильность своего вывода у преподавателя.
Опыт 3. Буферные растворы
В лабораторной практике и в ряде технологических процессов возникает необходимость применения растворов, в которых водородный показатель (рН) практически не меняется как при их разбавлении растворителем (водой), так и при добавлении к ним небольших количеств сильных кислот или оснований (щелочей).
19
Такие растворы существуют, и они получили название буферных растворов или буферных смесей.
Наиболее часто применяемые буферные растворы представляют собой смесь слабой кислоты с солью, образованной этой кислотой и сильным основанием, например: (СН3СООН + CH3COONa) - ацетатная буферная смесь или смесь слабого основания с солью, образованной этим основанием и сильной кислотой, например: (NH4OH + NH4CI) - аммонийная буферная смесь.
Буферные растворы слабых кислот имеют рН<7, в буферных растворах слабых оснований рН>7.
Выполнение работы. Приготовить ацетатный буферный раствор (СН3СООН + CH3COONa), для чего поместить в небольшой стаканчик по 5 мл 0,1М растворов уксусной кислоты и ацетата натрия, полученный раствор перемешать стеклянной палочкой. В другом стаканчике приготовить таким же образом аммонийную буферную смесь (NH4OH + NH4C1) из 0,1 М растворов аммиака и хлорида аммония.
Определить рН приготовленных растворов с помощью универсального индикатора (см. опыт 2).
Запись данных опыта. Записать способ приготовления буферных смесей и экспериментально установленные в них значения рН.
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Окислительно-восстановительными |
называются |
реакции, |
||
сопровождающиеся |
изменением |
степени окисления атомов элементов, |
входящих в |
|
состав реагирующих |
веществ. |
Под степенью |
окисления понимают тот |
условный |
заряд атома, который вычисляется исходя из предположения, что молекула состоит только из ионов. Окисление и восстановление - это единный, взаимосвязанный процесс. Окисление приводит к повышению степени окисления восстановителя,
восстановление - к её понижению окислителя. |
|
||
Для составления |
уравнений |
окислительно-восстановительных |
реакций |
можно использовать два |
способа подбора коэффициентов. 1. Метод электронного |
||
баланса позволяет подобрать коэффициенты только перед молекулами окислителя и
восстановителя. |
2. |
Метод |
электронно-ионного баланса |
(метод |
полуреакций) |
||||||
позволяет использовать представление |
об |
|
электролитической |
диссоциации. |
|||||||
Участники процесса записываются в ионно-молекулярной форме. |
Метод применим, |
||||||||||
если реакции протекают в водном растворе. |
Вещества |
диссоциируют на ионы, |
|||||||||
реальность существования которых может быть |
обнаружена |
в |
растворе. В этом |
||||||||
случае учитывают процесс диссоциации воды |
Н2О ↔ Н+ |
+ ОН- |
и используют в |
||||||||
качестве компонента реакции молекулы Н2О и ионы Н+ и ОН-. |
подобрать |
коэффициенты |
|||||||||
Пример 1. На основании электронно-ионного |
метода |
||||||||||
и вычислить молярную массу эквивалента восстановителя в реакции: |
|
|
|||||||||
KMnО4 |
+Na2SО3 +H2SО4 → MnSO 4 |
+ Na2SО4 |
+ K2SО4 + H2О. |
||||||||
Решение. 1. |
Это |
уравнение |
необходимо |
записать |
в |
ионном виде, учитывая |
|||||
только те ионы, которые изменили свой первоначальный вид
MnО4- +S032- +2Н+ → Мn2+ + S042- + Н20.
В рассматриваемом примере анион S032- окисляется в анион S042-. Кислород, необходимый для превращения S032- в S042-, берется из воды. При этом образуется
избыток ионов водорода (Н+)
S03 2- + Н20 → SO 42- + 2Н+.
20
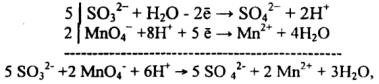
Так как суммы зарядов в левой и правой части уравнения должны равняться друг другу, то из левой части уравнения следует вычесть два электрона. Электронноионное уравнение для процесса окисления будет иметь вид
|
|
S032- + Н20 - 2ё → S042- + 2Н+. |
(1) |
Соответственно для процесса восстановления |
|
||
Ионы |
|
Мn04- +8Н+ + 5 ё → Мn2+ + 4Н20. |
(2) |
водорода нужны для связывания в воду освобождающегося |
кислорода |
||
при переходе |
иона Мn04- в ион Мn2+ . Умножая члены первого уравнения на 5, |
||
второго |
на |
2 и складывая их, получим уравнение данной реакции |
в ионно- |
молекулярном виде
от которого легко перейти к молекулярному:
2KMnO4 +5Na2S03 +3H2S04 → 2MnSO 4 + 5Na2S04 + K2SO4 + 3H20.
2. Восстановителем в этой реакции является сульфит натрия, молярную массу эквивалента которого вычислим по формуле: Mэ(Na2S03) = M(Na2S03) / nё (число электронов, отданных 1 моль восстановителя). M(Na2S03) = 126 г/моль, отсюда
Mэ(Na2S03) = 126 / 2 = 63 г/моль.
Пример 2._Установить направление возможного протекания реакции: 2NaBr +Рb02 + 4HN03 → Pb(N03)2 + Br2 +2NaN03 + 2H20.
Решение. Запишем уравнение реакции в ионно-молекулярной форме: 2Вr- + РЬ02 + 4Н+ → РЬ2+ + Вr2 + 2Н20.
По таблице / Лурье Ю.Ю. Справочник по аналитической химии. М.:Химия,1978.-447с./ находим значения стандартных (нормальных) электродных потенциалов электрохимических систем, участвующих в реакции:
2Вr- -2ё → Вг2, |
Е01 |
= -1,065В; |
Рb02 + 4Н+ +2ё → Рb2+ + 2Н20, |
Е02 |
= 1,449В. |
ЭДС = Е0ок – Е0восст = 1,449 - (-1,065) = 2,514В.
Окислителем всегда служит система с более высоким значением электродного потенциала. Поскольку здесь Е02 значительно больше, чем Е01 то практически при любых концентрациях взаимодействующих веществ бромид ион будет служить восстановителем, а оксид свинца (IV) - окислителем. Реакция будет протекать слева направо, так как ЭДС реакции больше нуля.
Лабораторная работа № 7 Окислительно-восстановительные реакции
Опыт 1. Влияние среды на характер восстановления перманганата калия Выполнение работы. В три пробирки внести по 4 капли раствора
перманганата калия (КМn04). В 1-ю пробирку добавить 2 капли 2 н раствора серной кислоты (H2S04), во 2-ю пробирку - 2 капли дистиллированной воды, в 3-ю 2 капли 2 н раствора щелочи (NaOH). В каждую пробирку внести на кончике микрошпателя несколько кристалликов сульфита натрия (Na2S03) и тщательно перемешать растворы до полного растворения соли. Отметить изменение окраски растворов во всех пробирках. В пробирках протекают следующие реакции:
21
1 .KMn04 + Na2S03+H2S04 → MnSO 4+ Na2S04+ K2S04+H20; |
|
|||
2. KMn04 |
+ Na2S03+ H20 → MnO 2 + Na2S04 +KOH; |
|
||
3. KMn04 |
+ Na2S03 +NaOH → К 2Mn04 + Na2Mn04 + Na2S04+H20. |
восстановления |
||
Запись |
данных опыта. |
Написать |
уравнения реакций |
|
перманганата |
калия сульфитом |
натрия в |
кислой, нейтральной и |
щелочной средах. |
Коэффициенты подобрать методом электронно-ионного баланса. При этом учесть, что соединения марганца в различных степенях его окисления имеют характерные
окраски: Мn2+- слабо-розовую |
окраску, а при малой |
концентрации практически |
||||
бесцветен, Мп02 |
(диоксид марганца) и гидроксид марганца являются трудно |
|||||
растворимыми веществами бурого цвета, |
Мn042-(манганат-ион) |
имеет |
зеленую |
|||
окраску. |
|
|
|
|
|
|
До какой степени окисления восстанавливается перманганат калия в растворах, |
||||||
имеющих рН< 7, рН = 7, рН >7? Вычислите |
молярную массу эквивалента КМп04 в |
|||||
каждом из этих случаев, зная, |
что Мэ = М (КМnО4) / nё (число электронов, |
принятых |
||||
1 моль окислителя). |
|
|
|
|
|
|
Опыт 2. Окислительные и восстановительные свойства атомов |
|
|||||
|
р-элементов в промежуточных степенях окисления |
|
|
|||
а) Соединения серы (+IV)e окислительно-восстановительных реакциях. |
|
|||||
Выполнение работы. В 1-ю пробирку с |
раствором |
дихромата |
калия |
(К2Сr207) и |
||
во 2-ю с раствором сульфида натрия (Na2S) внести по 1 капле 2 н раствора серной кислоты и на кончике шпателя несколько кристалликов сульфита натрия (Na2S03). Как изменилась окраска раствора в 1-й пробирке? Почему помутнел раствор во 2-й пробирке? Окислителем или восстановителем может являться в химических реакциях К2Сг207? Na2S? Окислительные или восстановительные свойства проявляет Na2S03?
Написать уравнения проведенных реакций. Коэффициенты подобрать методом полуреакций.
Опыт 3. Внутримолекулярные окислительно-восстановительные реакции
а) Разложение дихромата калия.
Выполнение работы. В фарфоровую чашку поместить горкой несколько
микрошпателей кристаллического дихромата аммония ((NH4)2Cr207). В вершину горки вставить кусочек ленты магния и зажечь её. Через несколько секунд наблюдать
бурное разложение соли: (NH4)2Cr207 → Cr203 + N2 + 4Н20. |
|
|
|
|
Зеленые окатыши представляют |
собой Сr203 |
- |
оксид хрома (III). |
Атомы |
какого элемента являлись окислителями? |
Восстановителями? Как изменилась степень |
|||
их окисления? |
|
|
|
|
Опыт 4. Окислительные и восстановительные |
|
свойства соединений |
олова |
|
(II) Выполнение работы. Внести в пробирку 3 капли раствора (FeCl3) хлорида железа (III) и 3 капли раствора (K3[Fe(CN)6]) гексацианоферрата (III) калия. Отметить окраску раствора и добавлять к нему по каплям раствор (SnCl2) хлорида олова (II) до образования осадка. Окрашивание раствора в интенсивно синий цвет обусловлено появлением ионов Fe2+, образующих с K3[Fe(CN)6] синий осадок. Хлорид олова (II) при этом переходит в хлорид олова (IV).
FeCl3 + SnCl2 → FeCl 2+ SnCl4 (уравняйте методом электронного баланса); 3FeCl2 + 2K3[Fe(CN)6 ] → Fe 3[Fe(CN)6]2 + 6KC1.
22
Окислителем или восстановителем является ион Sn2+ в этой реакции?
В |
другую пробирку внести кусочек |
цинка и 5 |
капель раствора хлорида |
олова (II), |
наблюдать на поверхности цинка |
образование |
блестящих кристалликов |
олова. Написать уравнение реакции взаимодействия хлорида олова (II) с цинком,
коэффициенты |
подобрать |
методом |
электронного |
баланса. |
Окислителем или восстановителем является ион Sn2+ в этой реакции? |
|
|||
ЭЛЕКТРОЛИЗ
Окислительно-восстановительные процессы, протекающие под действием постоянного электрического тока на электродах, погруженных в раствор или расплав электролита, называют электролизом.
При электролизе следует различать два параллельных процесса: на катоде
происходит |
прием электронов ионами, т.е. |
их восстановление, |
на аноде происходит |
|
отдача электронов ионами, т.е. их окисление. |
|
|
|
|
Электролиз расплавов электролитов (анод инертный) |
|
|
||
Пример. |
В расплаве йодида |
калия при прохождении через него |
||
постоянного электрического тока протекают следующие процессы: |
|
|
||
1. В расплаве йодид калия распадается на ионы: |
|
|
||
|
KI ↔ К++ I-. |
|
|
|
2. Под |
действием постоянного |
электрического тока |
катионы |
будут |
передвигаться к катоду и принимать электроны, а анионы - к аноду и отдавать электроны:
Катод (-)К: К++ е → К ( восстановление) Анод (+)А: 2I--2е → I2 (окисление).
3. Суммируем уравнения процессов, протекающих на электродах. При этом необходимо учитывать, что число электронов, отданных восстановителем, должно равняться числу электронов, принятых окислителем.
|
|
Катод (-)К: К++ е → К | 2 |
||
|
|
Анод (+)А: 2 I--2е → I2 | 1 |
||
|
|
|
2К++ 2 I- → 2К +I2 |
|
4. Перепишем уравнение в молекулярном виде: |
|
|||
|
|
|
2KI → 2К + I2 |
|
|
Электролиз водных растворов электролитов |
|||
При |
электролизе |
водных растворов электролитов катодные и анодные |
||
процессы протекают сложнее, так |
как в этих процессах принимают участие ионы |
|||
воды, которые восстанавливаются на катоде: |
|
|||
|
|
2Н20 + 2е = Н2 + 20Н- |
|
|
и окисляются на аноде: |
2Н20 - 4е = 02 + 4H+. |
окислительно-восстановительных |
||
Для |
определения |
порядка |
протекания |
|
процессов на электродах при электролизе водных растворов электролитов можно руководствоваться следующими правилами.
Для процессов на катоде 1. В первую очередь восстанавливаются катионы металлов, обладающих
электродным потенциалом большим, чем у водорода, в порядке уменьшения стандартного потенциала (Е°). (-)К:Сu2++2е → Сu 0.
23

24

Лабораторная работа № 8 |
|
|
||||
|
Электролиз |
|
|
|
||
Опыт 1. Электролиз водных растворов солей с инертными |
|
|||||
(нерастворимыми) электродами |
|
|
||||
Описанные ниже опыты |
проводят в |
приборе – |
электролизере, |
который |
||
состоит из U-образной трубки, закрепленной на штативе. В качестве электродов |
||||||
служат графитовые стержни, |
вставленные |
в |
каучуковые пробки. |
Пробки в |
||
электролизере вставляются неплотно. |
Во |
всех |
опытах |
элетролизер |
заполняют |
|
элетролитом (раствор соли) на ½ его объема. После чего подключают электролизер к источнику постоянного тока. Электроды перед каждым опытом тщательно промывают дистиллированной водой.
а) Электролиз раствора хлорида натрия
Выполнение работы. Заполнить электролизер раствором хлорида натрия. В оба колена элетролизера вставить графитовые электроды и подключить к источнику постоянного электрического тока. Какие вещества выделяются на катоде и аноде? Отключить электролизер от источника тока, вынуть электроды и в оба колена внести по капле фенолфталеина. Наблюдать появление малинового окрашивания около катода. Окисление или восстановление происходит на катоде? Определить по запаху образование хлора на аноде. Написать уравнения катодного и анодного процессов.
б) Электролиз раствора сульфата натрия
Выполнение работы. Заполнить электролизер раствором сульфата натрия, пропустить через раствор постоянный электрический ток. Какие вещества образуются на катоде и аноде? Вынуть электроды и в оба колена добавить по 2 капли нейтрального раствора лакмуса. Отметить изменение окраски раствора в обоих коленах электролизера.
Написать уравнения катодного и анодного процессов, протекающих при электролизе сульфата натрия. Объяснить изменение цвета лакмуса в катодном и анодном пространствах.
в) Электролиз раствора сульфата меди (с растворимым и нерастворимым анодом)
Выполнение работы. Заполнить электролизер раствором сульфата меди и подключить к источнику постоянного тока. Через несколько минут прекратить электролиз и отметить появление на катоде красного налета меди. Написать уравнения катодного и анодного процессов. Какой газ выделялся на аноде? Затем анод и катод поменять местами, вследствие чего электрод (катод), покрывшийся вначале медью, становится анодом. Снова пропустить электрический ток. Что происходит с медью на аноде? Какое вещество выделяется на катоде? Написать
25
уравнения катодного и анодного процессов, протекающих при электролизе сульфата меди с медным анодом.
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
Комплексные соединения - сложные вещества, в которых можно выделить центральный атом (комплексообразователь) и связанные с ним молекулы или ионы - лиганды или адденды.
В комплексном соединении различают внутреннюю и внешнюю сферы.
Внутреннюю сферу составляют комплексообразователь |
(центральный |
ион или атом) |
и лиганды. |
|
|
Внешнесферная диссоциация комплексных |
соединений |
происходит в |
водных растворах практически полностью. Эта диссоциация называется первичной. Обратимый распад внутренней сферы комплексного соединения называют вторичной диссоциацией. Диссоциация комплексного иона характеризуется константой
равновесия, которая называется константой нестойкости комплексного |
иона |
и |
||||||||||
служит мерой устойчивости комплекса. |
|
|
|
|
|
|
|
|||||
Пример. |
Укажите |
в |
нижеприведенных |
комплексных |
соединениях |
|||||||
комплексообразователь, его степень окисления, координационное число, |
лиганды, |
|||||||||||
заряд комплексного иона. |
|
|
|
|
|
|
|
|
|
|||
Решение. |
l.[Cr (Н20)6]С13, 2.K[Cu(CN)2], 3.[Pt(NH3)4Cl2]Cl2. |
|
являются |
|||||||||
В |
указанных |
соединениях |
комплексообразователями |
|||||||||
ионы Cr3+, Cu+, Pt4+, координационные числа |
соответственно равны 6, |
2, 6. |
Лигандами |
|||||||||
в первом |
соединении являются |
шесть молекул |
воды, во втором - два иона CN- и в |
|||||||||
третьем - четыре молекулы аммиака и два иона СI-. |
|
|
|
|
|
|
||||||
Заряд комплексного |
иона равен |
сумме зарядов |
комлексообразователя |
и |
||||||||
лигандов. |
В первом |
соединении заряд комплексного |
иона |
равен: +3+6·0 =+3, |
во |
|||||||
втором: +1+(-2) = -1, в третьем: 4+4·0 +(-2) = +2.
При растворении в воде эти комплексные соединения диссоциируют с
отщеплением комплексного иона: 1.[Сr(Н20)6]С13↔[Сr(Н20)6]3+ + ЗСl-;
2.K[Cu(CN)2] ↔ K++ [Cu(CN)2]-; 3.[Pt(NH3)4Cl2]Cl2↔[Pt(NH3)4Cl2]2++2Cl-.
Комплексные ионы в большей или меньшей степени диссоциируют: 1 .[Сr(Н20)6]3+↔Сr3++6Н20;
2.[Cu(CN)2] ↔ Cu++2CN- 3.[Pt(NH3)4Cl2]2+ ↔ Pt4++ 4NH3+2Cl-.
Константы нестойкости соответственно принимают следующий вид:
К1= [Сг3+][Н20]6/[Сг(Н20)63+]; К2 = [Cu+][CN-]2/ [Cu(CN)2-];
К3= [Pt4+][NH3]4[Cl-]2/ [Pt(NH3)4Cl22+].
Лабораторная работа № 9 Комплексные соединения
Опыт 1. Комплексные соединения в реакциях обмена
а) Взаимодействие гексацианоферрата (II) калия с сульфатом меди.
Выполнение работы. В пробирку к 3 каплям 0,5 н раствора сульфата меди (II) добавить 3 капли 0,5 н раствора комплексной соли K4[Fe(CN)6] (гексацианоферрат (II)
26
калия). Отметить цвет образовавшегося осадка гексацианоферрата (II) меди. Написать молекулярное и ионное уравнения реакции.
Опыт 3 . Разрушение комплекса при осаждении комплексообразователя Выполнение работы. В две пробирки с 0,5 н раствором сульфата меди
добавить: в одну раствор 0,5 н ((NH4)2C204) оксалата аммония, в другую - 0,5 н раствор ((NH4)2S) сульфида аммония. Написать уравнения реакций и отметить цвета выпавших осадков. В двух других пробирках получить комплексное соединение меди, добавив к 2 каплям 0,5 н раствора (CuS04) сульфата меди 2 н раствор аммиака (NH3·H20) до растворения выпадающего вначале осадка основной соли ((Cu0H)2S04). Отметить цвет полученного комплексного соединения [Cu(NH3)4]S04. Написать уравнение реакции взаимодействия сульфата меди с аммиаком, учитывая, что координационное число меди равно четырем.
Испытать действие растворов оксалата аммония и сульфида аммония на полученный раствор комплексной соли меди. От действия какого реактива выпадает осадок? На присутствие каких ионов в растворе комплексной соли указывает появление этого осадка?
Запись данных опыта. Описать наблюдаемые явления. Ответить на поставленные по ходу опыта вопросы. Написать уравнения проведенных реакций, уравнение электролитической диссоциации комплексной соли меди и её комплексного иона. Как влияет добавление (NН4)2S на диссоциацию комплексного иона? Сравнить табличные значения произведения растворимости соответствующих
солей меди
(ПР(СuС204)= 3 · 10-8; ПP(CuS) = 6·10-36 ) и объяснить, почему одна из солей не выпадает в осадок из комплексного соединения.
Опыт 4. Двойные соли.
Выполнение работы. В трех пробирках приготовить раствор двойной соли (NH4)2S04·FeS04·6H20 (соль Мора), внеся в каждую пробирку по нескольку кристалликов соли и по 4 капли дистиллированной воды. Затем в 1-ю пробирку к раствору соли Мора добавить 2 капли 0,5 н раствора сульфида аммония ((NH4)2S), во 2-ю пробирку 2 капли 0,5 н раствора хлорида бария (ВаС12). Отметить цвет осадков и написать ионные уравнения реакций их образования. На присутствие каких ионов в растворе двойной соли указывают эти реакции? В 3-ю пробирку добавить 3 капли 2 н раствора едкого натра (NaOH) и подогреть на водяной бане. Подержать над пробиркой полоску универсальной индикаторной бумаги, предварительно смоченную дистиллированной водой. По изменению окраски индикаторной бумаги и по запаху определить, какой газ выделяется из пробирки. На присутствие, каких ионов в растворе двойной соли указывают эта реакция? Учитывая результаты опыта, написать уравнение электролитической диссоциации соли Мора.
СПОСОБЫ ВЫРАЖЕНИЯ СОСТАВА РАСТВОРОВ
Вхимии применяются следующие способы выражения состава растворов:
массовая доля, молярная, молярная концентрация эквивалента (нормальная), моляльная концентрация, а также мольная доля и титр.
Массовой долей называется отношение массы растворенного вещества к массе раствора.
27

28
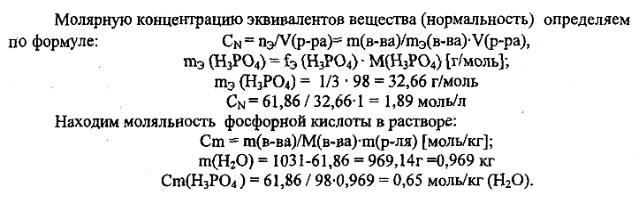
Лабораторная работа № 10 Приготовление раствора с заданной массовой долей вещества (в %)
Выполнение работы. Получите у преподавателя задание на приготовление водного раствора хлорида натрия или хлорида аммония. Массовую долю раствора и массу раствора запишите в тетрадь. Рассчитайте массу соли и массу растворителя (воды), которые необходимы для приготовления раствора. Покажите расчеты преподавателю и приступайте к приготовлению раствора. Для этого соль необходимо взвесить на технохимических весах, дистиллированную воду отмерить мерным цилиндром. Воду из цилиндра перенести в стакан, затем высыпать соль и тщательно перемешать стеклянной палочкой до полного растворения соли.
Приготовленный раствор перенести в узкий цилиндр и, осторожно погрузив в него ареометр, произвести отсчет по шкале, т.е. определить плотность раствора.
Показание шкалы ареометра на уровне поверхности жидкости (нижний край мениска) соответствует плотности этой жидкости (раствора). Ареометр позволяет определить плотность с точностью до третьего десятичного знака.
Запись данных опыта и расчет. Запишите полученный результат, сравните его с табличным значением, рассчитайте абсолютную и относительную погрешности.
Вычислите молярную, молярную концентрацию эквивалента (нормальную), моляльную концентрации, титр, мольные (молярные) доли растворенного вещества и растворителя в приготовленном растворе.
Лабораторная работа № 11
Свойства азота Опыт 1. Равновесие в водном растворе аммиака.
Выполнение работы. В две пробирки внести по 4 капли раствора аммиака (NH3·H2O). В 1-ю пробирку добавить 1 каплю фенолфталеина. Отметить окраску раствора. На присутствие каких ионов она указывает? Добавить в раствор несколько кристалликов хлорида аммония (NH4Cl), и тщательно перемешать раствор. Как изменилась окраска раствора? Почему?
К раствору аммиака во 2-й пробирке добавить 5 капель нитрата алюминия
(Al(NO3)3 + 3NH3·H2O → Al(OH)3↓ + 3(NH4)NO3). Отметить исчезновение запаха аммиака.
Запись данных опыта. Написать:
1) Схему равновесия в водном растворе аммиака;
29
2) Молекулярное |
и ионное уравнения |
реакций взаимодействия |
нитрата |
алюминия с водным раствором аммиака. |
|
|
|
Указать, в каком |
направлении смещается |
равновесие в водном |
растворе |
аммиака при добавлении к нему хлорида аммония? Нитрата алюминия? Как при этом
изменяется концентрация компонентов данной равновесной |
системы: ОН- - иона, |
|||
NH4+- иона, NH3? В каком направлении сместится равновесие данной системы при |
||||
добавлении хлороводородной кислоты (НСl)? Почему? |
|
|
||
|
Опыт 2. Восстановительные свойства аммиака |
|
||
Выполнение работы. В три пробирки |
внести раздельно |
по 4 капли растворов: |
||
в 1-ю – бромной воды(Вr2+Н20), во 2-ю – перманганата |
калия (КМn04), в 3-ю - |
|||
дихромата |
калия (К2Сr207). В каждую из пробирок добавить по 4 капли 25%-ного |
|||
раствора аммиака. В каждом случае растворы слегка подогреть до изменения окраски. |
||||
Запись |
данных опыта. Написать |
соответствующие |
уравнения |
реакций, |
учитывая, |
что в каждом случае аммиак в основном окисляется до молекулярного |
азота (N2), |
перманганат калия (КМn04) восстанавливается до Мn02, а дихромат калия |
(К2Сr207) - |
до оксида хрома (III) (Сr203). Во всех случаях отметить изменение |
окраски растворов.
Опыт 3. Оксид азота. (III) и соли азотистой кислоты.
а) Получение оксида азота (III) и его разложение
Выполнение работы. Внести в пробирку несколько кристалликов нитрита натрия (NaN02) и добавить 4 капли 2 н раствора серной кислоты (H2S04). Отметить появление в растворе голубой окраски оксида азота (III) (N203), который является ангидридом неустойчивой азотистой кислоты. Объяснить образование над раствором бурого газа.
Запись данных опыта. Написать уравнения реакций взаимодействия нитрита натрия с серной кислотой, протекающего с образованием N203 и распадом образовавшегося оксида на N0 и N02 (реакция диспропорционирования).
б) Восстановительные и окислительные свойства нитритов
Выполнение работы. В три пробирки внести по 3 капли: в 1-ю - йодида калия (KI), во 2-ю - перманганата калия (КМn04), в 3-ю –дихромата калия (К2Сr207). В 1- ю и 2-ю пробирки добавить по 2 капли 2 н раствора серной кислоты, в 3-ю пробирку - 1 каплю концентрированной серной кислоты. В каждую пробирку добавить несколько кристалликов нитрита натрия (NaN02) и тщательно перемешать.
Запись данных опыта. Отметить изменение окраски раствора в каждом случае. Написать уравнения реакций, с учетом того, что в 1-й пробирке нитрит натрия
восстановился до оксида азота (II) |
(N0), |
во |
2-й пробирке |
КМn04 |
переходит в |
|
сульфат марганца(II) (MnS04), в 3-й |
пробирке |
К2Сr207 |
- в |
сульфат |
хрома (III) |
|
(Cr2(S04)3. |
при |
этом |
нитрит |
натрия? Указать, в каком |
||
В какое соединение переходит |
||||||
случае он является окислителем, в каком - восстановителем? Почему нитриты могут обладать окислительно-восстановительной двойственностью? Любой из указанных выше опытов можно использовать в качестве реакции для открытия иона N02- в присутствии иона N03- (в отсутствие других восстановителей и окислителей).
30
Опыт 4. Качественная реакция на NH+- ион
Выполнение работы. В пробирку внести 4 капли раствора хлорида аммония (NH4C1) и добавить столько же капель 2 н раствора едкого натра (NaOH) или едкого кали (КОН). Слегка нагреть пробирку и над её отверстием подержать предварительно смоченную дистиллированной водой универсальную индикаторную бумажку. По запаху и по изменению цвета индикаторной бумажки убедиться в выделении аммиака и
образовании ОН- - иона. В какую сторону сдвигается равновесие: NH3 + H20 ↔ NH3·H20 ↔ NH4++ ОН-.
Запись данных опыта. Написать в молекулярной и ионной форме уравнение реакции хлорида аммония со щелочью. Эта реакция является качественной реакцией для обнаружения иона аммония.
Лабораторная работа № 12 Свойства серы
Опыт 1. Получение малорастворимых сульфидов Выполнение работы. В две пробирки внести раздельно по 3 капли растворов
сульфата |
марганца (MnS04) и |
нитрата свинца |
(II) (Pb(N03)2). |
В |
каждый |
раствор |
|||
добавить по 2 капли раствора сульфида |
аммония ((NH4)2S). |
Наблюдать выпадение |
|||||||
осадков сульфида марганца и |
сульфида свинца. |
К полученным |
осадкам |
прибавить по |
|||||
3 капли 2 н раствора азотной кислоты |
(HN03). |
Какой |
сульфид |
растворился? |
|||||
Возможно ли его образование в кислой среде? |
|
|
|
|
|
|
|
||
В две |
другие пробирки с |
растворами |
сульфата |
марганца и |
нитрата |
свинца |
|||
добавить по 4 капли сероводородной воды. В каком случае образование осадка не
наблюдалось? Почему? |
|
|
|
|
|
|
|
||
Запись |
данных опыта. |
Написать в молекулярном |
и ионном |
виде уравнения |
|||||
реакций получения |
сульфидов |
марганца и |
свинца. |
Указать |
их |
цвет. |
Написать |
||
уравнение реакции растворения MnS в растворе азотной кислоты. |
Пользуясь |
||||||||
правилом |
произведения растворимости (ПР(MnS) = |
2,5·10-10; |
ПР(PbS) |
= 1·10-27), |
|||||
объяснить: |
|
|
|
|
|
|
|
|
|
а) различные результаты действия H2S и (NH4)2S на соль марганца; б) |
|||||||||
образование |
осадка |
PbS в обои х случаях. (Реакция образования черного осадка PbS, |
|||||||
может служить для обнаружения сульфид иона (S2-). |
|
|
|
|
|||||
Опыт 2. Окислительные и восстановительные свойства серы (IV) |
|
||||||||
а) Восстановительные свойства SО3-2 - иона |
содержащую |
3 капли |
раствора |
||||||
Выполнение |
работы. |
В |
пробирку, |
||||||
пермангадага калия (КМn04) и 1 каплю 2 н раствора хлороводородной кислоты (HCI), |
|||||||||||
прибавить |
несколько |
|
кристалликов |
сульфита |
натрия |
(Na2S03). |
|
Отметьте |
|||
обесцвечивание |
раствора |
в связи |
с |
переходом иона Мn04- в ион Мn2+.(Данная |
|||||||
реакция может |
служить |
реакцией |
открытия |
S032- в |
отсутствие |
других |
|||||
восстановителей). В какое соединение |
перешёл при этом сульфит |
натрия? |
|
Учитывая, |
|||||||
что сульфит бария (BaS03) растворим |
в |
азотной кислоте (HN03), а сульфат бария |
|||||||||
(BaS04) нерастворим, |
убедиться в переходе иона |
S032- в |
ион |
S042-, |
для чего в |
||||||
полученный |
раствор |
добавить 1-2 |
капли азотной |
кислоты и |
столько же капель |
||||||
раствора хлорида бария(ВаС12). Какое соединение выпало в осадок? Отметить наблюдаемые явления и написать уравнения всех протекающих реакций.
31
Опыт 3. Различная растворимость сульфита и сульфата бария в кислоте Выполнение работы. В двух пробирках получить обменной реакцией
сульфат(ВаС12 + Na2S04 = BaS04 + 2NaCl) и сульфит бария (ВаС12+ Na2S03 = BaS03 + 2NaCl), для чего в две пробирки внести по 2 капли раствора хлорида бария, затем в пробирку №1 добавить 2 капли сульфата натрия, а в пробирку №2 несколько кристалликов сульфита натрия. Наблюдать образование осадков в обеих пробирках. Сравнить растворимость сульфита и сульфата бария в кислоте, добавив в обе пробирки по 2 капли 2 н раствора азотной кислоты. Что наблюдается?
Запись данных опыта.
Написать уравнение реакции растворения сульфита бария в азотной кислоте. Почему не растворился в азотной кислоте сульфат бария?
Опыт 4.Тиосульфат натрия и его свойства.
а) Неустойчивость тиосульфата в кислой среде.
Выполнение работы. Внести в пробирку 5 капель тиосульфата натрия (Na2S203) и 1 каплю 2 н раствора серной кислоты (H2S04).
Запись |
данных опыта. Отметить выпадение серы. По |
запаху |
определить, |
какой газ |
выделился. Привести графическую (структурную) |
формулу |
тиосульфата |
натрия. Написать уравнение реакции взаимодействия тиосульфата натрия с серной кислотой. Указать окислитель и восстановитель.
б) Восстановительные свойства тиосульфата натрия.
Выполнение работы. В 1-ю пробирку внести 5 капель бромной воды (Вr2+Н20), во вторую 5 капель йодной воды (I2+Н20). В обе пробирки добавлять по каплям тиосульфат натрия до обесцвечивания растворов.
Запись данных опыта. Написать уравнения протекающих реакций, учитывая, что бром окисляет тиосульфат до сульфата натрия, при этом в реакции участвует вода. (Выделяющаяся сера является продуктом побочной реакции). Йод окисляет тиосульфат до тетратионата натрия (Na2S406). В какую степень окисления переходят при этом бром и йод?
Лабораторная работа № 13 Свойства фосфора
Опыт 1. Ортофосфаты некоторых металлов a) Получение % гидрофосфата кальция.
Выполнение работы. Внести в пробирку по 4 капли растворов хлорида кальция (СаС12) и гидрофосфата натрия Na2HP04.
Запись данных опыта. Отметить цвет выпавшего осадка. Написать уравнение реакции в молекулярной и ионной форме.
б) Осаждение фосфатов железа и алюминия в присутствии ацетата натрия.
Выполнение работы. Возьмите две пробирки. В первую внесите 3 капли раствора хлорида железа (III) (FeCl3), во вторую пробирку - 3 капли раствора нитрата алюминия (A1(N03)3), добавить в каждую пробирку по 2 капли раствора ацетата натрия (СН3СООNa) и по каплям раствор гидрофосфата натрия (Na2HP04) до выпадения осадков. Отметить цвета выпавших осадков.
Запись данных опыта. В данном опыте в растворах алюминия и железа (III), буферированных ацетатом натрия, получаются средние фосфаты этих металлов, не
растворимые в уксусной кислоте:
Ме2++ НР042-+ СН3СОО- → МеРО 4 + СН3СООН.
32
Написать уравнения реакций в молекулярной и ионной формах.
Опыт 2. Гидролиз некоторых соединений фосфора
а) Гидролиз ортофосфатов натрия.
Выполнение работы. В три пробирки внести по 1 капле раствора нейтрального лакмуса. Первую пробирку оставить как контрольную, во 2-ю добавить
несколько кристалликов ортофосфата натрия (Na3P04), в 3-ю - столько же дигидрофосфата натрия (NaH2P04). Затем в каждую пробирку добавить по 5 капель дистиллированной воды. Содержимое пробирок тщательно перемешать до полного растворения солей. Отметить изменение цвета лакмуса по сравнению с его окраской в контрольной пробирке.
Запись данных опыта. На увеличение концентрации каких ионов указывает изменение цвета лакмуса при растворении ортофосфата натрия и дигидрофосфата натрия? Написать уравнение первой ступени гидролиза ортофосфата натрия в ионной и
молекулярной форме. |
|
|
|
|
|
|
|
|
||
Кислотность |
раствора |
дигидрофосфата |
натрия |
(NaH2P04) |
обусловлена |
тем, что |
||||
из двух реакций: |
|
|
|
|
|
|
|
|
|
|
1. H2P04- = H+ + HPO42- |
|
|
|
|
|
|
|
|||
2. Н2Р04 |
+ Н20 = Н3Р04 + ОН- |
|
|
|
|
|
|
|
||
первая |
- диссоциация |
Н2Р04- |
иона - протекает более интенсивно, чем |
|||||||
гидролиз этого иона, так как |
сопровождается |
образованием |
более |
слабого |
||||||
электролита НР042- по сравнению |
с Н3Р04 |
(Кдисс.(НР04 2-) |
= |
4,5·10-12; К1 (Н3Р04) = |
||||||
7,9·10-3). |
|
|
|
|
|
|
|
|
|
|
|
|
|
Лабораторная работа № 14 |
|
|
|
|
|||
|
|
|
Свойства галогенов |
|
|
|
|
|
||
Опыт |
1. |
Окислительные |
свойства галогенов |
и |
их |
сравнительная |
||||
активность |
|
|
|
|
|
|
|
|
|
|
а) Сравнение окислительных свойств галогенов |
|
|
|
|
|
|||||
Выполнение работы. |
В одну пробирку |
внести 3 капли раствора бромида калия |
||||||||
(КВr) и в две другие - по 3 капли раствора йодида калия (KI) . Во все три пробирки добавить по 2 капли органического растворителя (бензол). В пробирки с растворами йодида и бромида калия внести по 3 капли хлорной воды (С12+Н20), в последнюю пробирку с раствором йодида калия - 3 капли бромной воды (Вr2+Н20). Содержимое пробирок перемешать и по окраске полученного слоя органического растворителя установить, какой галоген выделяется в свободном виде в каждой из пробирок.
Запись данных опыта. Написать уравнения реакций в молекулярной и ионной форме. В каждом случае указать окислитель и восстановитель. Расположить галогены в ряд по убыванию их окислительной активности. Объяснить последовательность расположения.
б) Окисление сульфата железа (II)
Выполнение работы. В две пробирки раздельно внести по 4 капли бромной и йодной воды. Добавить в каждую пробирку несколько кристалликов сульфата железа (II)
[соли Мора (NH4)2S04·FeS04·6H20].
Запись данных опыта. Что наблюдалось? Написать уравнение протекающей
реакции. В |
каком |
случае |
реакция окисления Fe2+ нe |
протекала? Выписав из |
справочной |
таблицы |
значения стандартных электродных |
потенциалов систем: |
|
33
С12/2С1-, Br2/2Br-, I2/2I- Fe3+/Fe2+ вычислите Э.Д.С. и укажите, в каком случае реакция окисления FeS04 невозможна. Подтверждалось ли это опытом?
Опыт 2. Сравнение восстановительных свойств галогенов
а) Восстановление хлорида железа (III)
Выполнение работы. Внести в три пробирки раздельно по 3 капли раствора хлорида железа (III) и но 1 капле 2 н раствора серной кислоты, перемешать. Затем добавить в пробирку №1 3 капли раствора йодида калия, №2 -3 капли раствора бромида калия, №3 -3 капли раствора хлорида калия. Растворы тщательно перемешать.
Запись данных опыта. Что наблюдали? В каком случае произошло восстановление FeCl3 и соответственно окисление галогена? Согласуются ли результаты опыта с относительными значениями стандартных электродных потенциалов соответствующих окислительно-восстановительных систем (опыт 1б)? Как изменяется восстановительная способность галогенидов (отрицательных ионов галогенов)? Расположите их в ряд по возрастающей восстановительной активности.
Раздел 2. АНАЛИТИЧЕСКАЯ ХИМИЯ
КОЛИЧЕСТВЕННЫЙ АНАЛИЗ
Количественный анализ - совокупность экспериментальных методов, позволяющих определить в образце анализируемого материала количественное содержание (концентрацию) отдельных компонентов. Количественный анализ (вместе с качественным анализом) служит для установления химического состава анализируемого объекта. Эти определения можно выполнять химическими, физикохимическими, физическими и другими методами.
ХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
Классические методы анализа основаны на использовании химических реакций, протекающих в растворах и расплавах веществ (реакции нейтрализации, комплексообразования, осаждения, окисления - восстановления и др.). Химические реакции - это один из самых старых источников получения аналитической информации, который служит основой для градуировки и сравнения с другими методами анализа. Химическими методами измеряют массу, объём, время и другие величины. Главные методы: гравиметрия, титриметрия отличаются высокой точностью, но относительно невысокими пределами обнаружения, а гравиметрический метод количественного анализа ещё и длительностью выполнения определений.
1.Гравиметрический (весовой) анализ
Гравиметрия основана на точном измерении массы определяемого вещества или его составных частей, полученных в результате аналитической реакции и выделенных в виде соответствующих соединений.
34
Лабораторная работа № 1 Установление формул кристаллогидратов
Кристаллогидраты - это вещества, кристаллизующиеся с одной или несколькими молекулами воды (кристаллизационная вода). Некоторые кристаллогидраты при нагревании до определенной температуры теряют только воду, а разложение вещества происходит при более высокой температуре. Например, кристаллогидрат сульфата меди (CuS04·5H20) теряет полностью кристаллизационную воду при температуре 258°С, превращаясь в безводную соль, разложение безводного сульфата меди начинается при температуре 653оС.
Выполнение работы. Записать номер тигля. Прокалить фарфоровый тигель, охладить его в эксикаторе, взвесить на электронных технических весах с точностью до 0,01 г. Взвесить в тигле 0,5-1 г растертого в порошок кристаллогидрата. Поставить тигель с солью в сушильный шкаф или на песочную баню и нагревать в течение 30-40 мин при температуре 240-260°С. При работе с кристаллогидратом наблюдать за изменением цвета соли. По окончании обезвоживания (кристаллогидрат изменит свой цвет) поместить тигель с помощью тигельных щипцов в эксикатор и оставить на 10-20 мин до полного охлаждения.
Почему тигель с безводной солью нельзя охлаждать на воздухе?
Остывший тигель вынуть из эксикатора и взвесить. Повторять нагревание, охлаждение и взвешивание тигля до тех пор, пока разница показаний между предыдущим и последующим взвешиванием не составит 0,01 г.
Запись данных опыта и расчет. Результаты всех измерений записать в лабораторный журнал.
Номер тигля – Масса тигля,rri1, г =
Масса тигля + масса кристаллогидрата, m2 ,г = Масса кристаллогидрата, m3 = (m2 – m1), г =
Масса тигля с безводной солью после прокаливания, m4, г = Масса безводной соли m5 = ( m4 – m1 ),г =
Масса удаленной воды m6 = (m3- m5),г =
Рассчитать число молей воды, приходящееся на 1 моль безводной соли, и составить химическую формулу кристаллогидрата.
Найдите в химическом справочнике истинную формулу исследуемого кристаллогидрата и вычислите абсолютную и относительную погрешности.
|
3. Титриметрический (объемный) анализ |
|
|
|
||||
Сущность |
титриметрического |
анализа заключается |
в |
точном |
измерении |
|||
объема реагента, затраченного на взаимодействие с определяемым компонентом. |
||||||||
Раствор реагента, |
имеющий |
точно известную |
концентрацию, |
называется |
||||
рабочим титрованным раствором (титрантом). |
|
|
|
|
|
|||
Основной |
операцией титриметрического |
анализа |
является |
титрование, |
||||
которое заключается в |
постепенном приливании |
из |
бюретки |
точно |
измеренного |
|||
объема титранта (стандартизированного рабочего раствора) к точно измеренному пипеткой объему титруемого (исследуемого) раствора с целью определить его
концентрацию. |
|
|
|
|
|
Концентрацию |
стандартных |
растворов |
выражают |
через |
титр, |
нормальность (молярная |
концентрация |
эквивалентов вещества), |
поправочный |
||
35
коэффициент. Эти величины называют характеристиками раствора. Концентрацию раствора можно выразить титром по определяемому веществу.
Пример. Рассчитать нормальность (молярная концентрация эквивалентов
вещества), поправочный коэффициент и титр по H2S04 |
0,1 н раствора NaOH, если |
T(NaOH) = 0,004040 г/см3. |
|
Решение. Нормальность и титр раствора связывает соотношение: |
|
N = T·1000/г-экв. |
(1) |
Поправочный коэффициент: |
|
К = Nпракт / Nтeop. |
(2) |
Титр по определяемому веществу означает, какому количеству граммов определяемого вещества соответствует 1 см3 (1 мл) стандартизированного рабочего раствора (титранта).
1). N(NaOH) = T(NaOH) · 1000/ г-экв (NaOH)
N(NaOH) = 0,004040 · 1000 / 40 = 0,1010 н
2). К (NaOH) = N(NaOH)пpaкт / N(NaOH)тeop
|
|
|
К (NaOH) = 0,1010 / 0,1 = 1,010 |
|
|
|
|
|
|
|||||
|
3). T(NaOH / H2S04) = T(NaOH) · г-экв(H2S04) / г-экв(NaOH) |
|
|
|
|
|||||||||
|
|
T(NaOH / H2S04) = 0,004040 · 49/40 = 0,004953 г/см3 |
|
|
|
|
||||||||
4).T(NaOH) / H2S04) также можно вычислить по формуле (1);. |
|
|
|
|
|
|||||||||
|
|
T(NaOH / H2S04) = N(NaOH) · г-экв (H2S04) / 1000, |
|
|
|
|
|
|||||||
|
T(NaOH / H2S04) = 0,1010 · 49 / 1000 = 0,004953 г/см3. |
на |
группы |
в |
||||||||||
Титриметрические |
методы |
|
анализа |
подразделяют |
||||||||||
зависимости от типа реакций, лежащих в основе метода. |
|
|
|
|
|
|
||||||||
Во |
всех |
методах |
титриметрического |
анализа |
могут |
быть |
использованы |
|||||||
три способа объемно-аналитических определений: |
|
|
|
|
|
|
||||||||
1) |
прямое |
титрование |
- |
раствор |
определяемого |
вещества |
А |
|||||||
непосредственно |
титруют |
стандартизированным |
рабочим раствором |
(титрантом) |
||||||||||
вещества В; |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2) обратное титрование (титрование по остатку) - |
|
к |
раствору |
|||||||||||
определяемого |
вещества |
А приливают избыточное |
количество |
(1:2) |
рабочего |
|||||||||
раствора |
вещества В, |
остаток |
вещества |
В |
титруют |
стандартным |
раствором |
|||||||
вещества С;
3)титрование заместителя (метод замещения) - к раствору определяемого
вещества |
А прибавляют какой-либо |
вспомогательный |
реагент, |
реагирующий с |
||||
веществом А с |
выделением |
эквивалентного количества нового |
вещества С, |
|||||
которое титруют титрованным рабочим раствором вещества В |
|
|||||||
При |
изучении |
каждого |
титриметрического |
метода |
рекомендуется |
|||
руководствоваться следующим: |
|
|
|
|
|
|||
1. |
Реакция, положенная в основу метода. |
|
|
|||||
2. |
Рабочие |
растворы, |
их |
приготовление и |
хранение, |
установочные |
||
вещества.
3.Способы определения точки эквивалентности (индикаторные и безындикаторные).
4.Кривые титрования.
5.Вещества, определяемые по данному методу.
36
Для выполнения вычислений и расчетов в титриметрических методах анализа необходимо знать, как вычисляют молярные массы эквивалентов веществ, участвующих в различных реакциях. В реакциях нейтрализации молярная масса эквивалентов (эквивалентная масса) определяется по числу замещенных или присоединенных катионов водорода, в реакциях окисления-восстановления по числу отданных восстановителем или присоединенных окислителем электронов. Величина молярной массы эквивалентов может выражаться в граммах (грамм-эквивалент) или миллиграммах (миллиграмм-эквивалент).
|
|
Количество грамм-эквивалентов вещества (nэ) может быть вычислено из |
||||||
условий задания, исходя из следующих соотношений: |
|
|
|
|
|
|||
|
|
nэ=.g / Мэ = N·V/ 1000 = T V/Мэ = V·p · ω% / 100 · Мэ, |
вещества, г/моль; |
|||||
|
|
где g – масса вещества, |
г, Мэ -молярная масса |
эквивалентов |
||||
N |
- |
нормальность раствора, |
г-экв/дм3, мг-экв/см3; |
V |
- объем |
раствора, дм3, |
см3; |
|
Т |
- |
титр раствора, г/см3; |
р - плотность раствора, |
г/см3; |
ω% |
- массовая |
доля |
|
(процентное содержание вещества, г в 100 г раствора). Следует иметь в виду:
1)в процессе растворения вещества или разбавления раствора количество вещества, а следовательно, и число его эквивалентов, не изменяется;
2)в любой реакции вещества реагируют в эквивалентных количествах, т.е. число эквивалентов одного из реагирующих веществ равно числу эквивалентов другого вещества и равно числу эквивалентов каждого из веществ, получившихся в результате реакции.
Основная расчетная формула титрования исходит из закона эквивалентов,
произведение N·V постоянно, т.е. чем больше нормальность (молярная концентрация эквивалентов) раствора, тем меньше его объем, содержащий определенное количество эквивалентов вещества.
Реакции, применяемые в титриметрическом анализе, должны отвечать следующим требованиям: стехиометричность, быстрота протекания, возможность фиксирования точки эквивалентности.
Лабораторная работа № 2 Калибровка. Проверка ёмкости мерной посуды
Калибровку мерной посуды проводят на заводе-изготовителе. При этом допускаются некоторые ошибки, максимальная величина которых предусмотрена техническими условиями. Во избежание ошибок при использовании мерной посуды для точного измерения объемов жидкостей необходимо проверять вместимость мерной посуды. Емкость мерной посуды - колбы, пипетки, бюретки - проверяют перед работой. Если погрешность не превышает стандартную, то в расчетах её не учитывают. При большой погрешности в расчетах следует использовать истинный объем посуды.
Проверка ёмкости мерной колбы
Мерная колба предназначена для приготовления растворов точной концентрации (рабочих растворов или растворов установочных веществ), а также для разбавления исследуемых растворов до нужной концентрации.
Проверка вместимости мерной колбы заключается в том, что ее тщательно моют, сушат и взвешивают на технохимических весах с точностью до 0,01 г. Затем мерную колбу заполняют дистиллированной водой, точно устанавливая нижний край мениска на метку. Колбу с водой снова взвешивают на тех же весах и по разности
37

находят массу воды в колбе. Затем измеряют температуру воды и, пользуясь таблицей зависимости плотности воды от ее температуры, вычисляют истинный объем (вместимость) колбы.
Пример. Масса воды в мерной колбе вместимостью 500 мл равняется 499,85 г, при температуре воды 18°С плотность воды равна 0,99758 г/см3. Исходя из этого, истинная вместимость (объем) колбы составляет:
Vист = m (Н20)/р [мл], 499,75/0,99758 =500,96мл.
1.Проверка ёмкости мерной колбы
|
Температура воды, °С |
|
|
|
|
|
|
|
|
|
Масса пустой колбы, г |
|
|
|
|
|
|
|
|
|
Масса колбы с водой, г |
|
|
|
|
||||
|
Практическая масса воды - mпр , г |
|
|
|
|
||||
|
Теоретическая масса воды-mтеор, г |
|
|
|
|
||||
|
Абсолютная погрешность-(mтеор- mпр ), г |
|
0,13 / v100 |
||||||
|
Стандартная погрешность мерной колбы |
|
|||||||
|
Истинный объем мерной колбы, мл |
|
|
|
|
||||
|
|
|
2.Проверка ёмкости пипетки |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
Температура воды, °С |
|
|
|
|
|
|
|
|
|
Масса пустого бюкса на технохимических весах, г |
|
|
|
|||||
|
Масса бюкса на аналитических весах, г |
|
|
|
|||||
|
1) |
|
2) |
|
|
|
3) |
|
|
|
Масса бюкса с водой на |
аналитических весах, г |
|
|
|
||||
|
1) |
|
2) |
|
|
|
3) |
|
|
|
Масса воды (пр) г |
|
|
|
|
|
|
|
|
|
1) |
|
2) |
|
|
|
3) |
|
|
|
Средняя масса воды —mср , г |
|
|
|
|||||
|
Теоретическая масса воды - mтеор при toC. Г |
|
|
|
|||||
|
Абсолютная погрешность (mпр - mтеор), г |
|
0,5 / vV(пипетки) |
||||||
|
Стандартная погрешность пипетки |
|
|||||||
|
Истинный объем пипетки, мл |
|
|
|
|||||
|
|
Зависимость массы воды от температуры |
|||||||
|
|
|
|
|
|
|
|
||
|
Температура, oС |
|
|
Теоретическая масса воды, |
|
Теоретическая масса воды, |
|||
|
|
|
|
V=10 мл |
|
|
V=100 мл |
|
|
|
15 |
|
|
9,9793 |
|
|
99,793 |
|
|
|
16 |
|
|
9,9780 |
|
|
99,780 |
|
|
|
17 |
|
|
9,9765 |
|
|
99,765 |
|
|
|
18 |
|
|
9,9751 |
|
|
99,751 |
|
|
|
19 |
|
|
9,9734 |
|
|
99,734 |
|
|
|
20 |
|
|
9,9718 |
|
|
99,718 |
|
|
|
21 |
|
|
9,9700 |
|
|
99,700 |
|
|
|
22 |
|
|
9,9680 |
|
|
99,680 |
|
|
|
23 |
|
|
9,9661 |
|
|
99,661 |
|
|
38

Лабораторная работа № 3 МЕТОДЫ КИСЛОТНО-ОСНОВНОГО ТИТРОВАНИЯ
(Метод нейтрализации) (Протолитометрия)
Рабочие растворы метода - 0,1 н растворы НС1 и H2S04 (метод ацидиметрии) и 0,1 н растворы КОН и NaOH (метод алкалиметрии).
Установочные вещества - Na2C03, Na2B407 · 10Н20, Н2С204 · 2Н20.
1 .Алкалиметрия
Рабочий раствор метода 0,1 н раствор NaOH. Установочное вещество Н2С204 · 2Н20.
1. Приготовление рабочего раствора 0,1 н NaOH (гидроксид натрия).
0,1 н раствор NaOH в объеме 200 мл готовят разбавлением 2 н раствора или из раствора гидроксида натрия любой другой концентрации (исходный раствор). Необходимый объем исходного раствора вычисляют по формуле:
V исх. р-ра= N paб р-ра·V paб. р-ра / N исх. р-ра
V исх. р-ра = 200·0,1/2 = 10мл.
V(H20) = 200 - 10= 190 мл.
Раствор готовят в плоскодонных колбах вместимостью 300-500 мл. Мерным цилиндром отмеривают 10 мл 2 н раствора NaOH, 190 мл дистиллированной воды, переносят в колбу и тщательно перемешивают.
2.Приготовлеиие раствора установочного вещества 0,1 н Н2С204 · 2Н20 (щавелевая кислота).
Раствор готовят точной концентрации по навеске установочного (исходного) вещества в объеме 100 мл. Навеску исходного вещества вычисляют по формуле:
а = N · г-экв.·V[г],
г-экв. (Н2С204 · 2Н20 ) = М(Н2С204 · 2Н20) / n (основность кислоты),
г-экв. (Н2С204 · 2Н20) = 120,06 / 2 = 63,03 г а = 0,1·63,03·0,1=0,6303 г.
В сухой стакан, предварительно взвешенный сначала на технических весах, затем на аналитических весах, берут навеску щавелевой кислоты в пределах 0,6 -0,7 г.
Показатель |
На технических |
На аналитических |
|
весах |
весах |
Масса пустого стакана, г Масса стакана + масса кислоты, г ά, реальная навеска кислоты, г
Навеску растворяют в стакане в небольшом объеме дистиллированной воды, количественно переносят в мерную колбу вместимостью 100 мл, доводят до метки и, закрыв пробкой, тщательно перемешивают.
Вычисляют титр и нормальность щавелевой кислоты по формулам:
Т(Н2С204 · 2Н20) = ά / V [г/мл]; N(H2C204 · 2Н20) = Т 1000 /г-экв. [н].
3. Определение нормальности рабочего раствора щелочи по щавелевой кислоте
Нормальность щёлочи определяют титрованием. Бюретку укрепляют в штативе, ополаскивают сначала дистиллированной водой, затем рабочим раствором щелочи. Наливают в бюретку раствор щелочи, заполняют им носик бюретки, затем устанавливают уровень раствора щелочи в бюретке на 1-2 см выше нулевого
39
деления, открыв зажим, совмещают нижний край мениска с нулевым делением. Каждое новое титрование начинают с установки уровня жидкости в бюретке на нуле.
С помощью пипетки отмеряют и переносят в колбу для титрования 10,00 мл раствора щавелевой кислоты, предварительно ополоснув пипетку сначала дистиллированной водой, затем раствором щавелевой кислоты. В колбу для титрования вносят 1-2 капли фенолфталеина. Устанавливают колбу с раствором щавелевой кислоты под бюретку на лист белой бумаги и добавляют из бюретки по каплям раствор щелочи, непрерывно перемешивая раствор в колбе. Для этого колбу берут под горлышко правой рукой. Следует избегать попадания капель щелочи на стенки колбы.
Титрование заканчивают в тот момент, когда от одной избыточной капли рабочего раствора щелочи появляется розовое окрашивание, не исчезающее в течение
30 с.
Первое титрование проводят быстро, определяя объем, при котором окраска раствора стала розовой. Отсчет по бюретке производят с точностью до 0,05 мл, при этом глаз наблюдателя должен находится на уровне нижнего края мениска.
Например: на титрование пошло 10,40 мл щелочи. Второе и последующие титрования проводят следующим образом: установив уровень щелочи в бюретке на нуле, в колбу с 10,00 мл щавелевой кислоты добавляют первые 9-10 мл щелочи по каплям быстро при непрерывном перемешивании, последние порции рабочего раствора до точки эквивалентности добавляют по каплям медленно, также при перемешивании.
Титрование проводят до трех сходящихся результатов.
Запись результатов титрования |
и |
расчет |
молярной |
концентрации |
|
эквивалента (нормальности) щелочи производится в следующем порядке: |
|
||||
V (Н2С2O4),мл |
V(NaOH), мл |
|
|
|
|
10,00 |
10,40 |
|
|
|
|
10,00 |
10,05 V |
|
|
|
|
10,00 |
10,00 V |
|
|
|
|
10,00 |
10,05 V |
|
|
|
|
VCP (NaOH) = 10,05+10,00+10,05/3 =10,03мл |
|
||||
N(NaOH)= N(H2C204·2H20) V(H2C204·2H20) / VCP.(NaOH) [н]; |
|
||||
N(NaOH) = 0,1 · 10,00/10,03 =0,09970 н. |
|
|
|||
|
(Расчеты даны для примера) |
|
|
||
Все вычисления |
делают в рабочем |
журнале |
(тетради). |
Записывают |
|
результаты измерений и вычислений четким и разборчивым почерком, с точностью, отвечающей точности измерительных приборов (весов) и посуды и точности вычислений, т.е. до четырех значащих цифр.
Контрольная задача
Определение количества серной кислоты (H2S04) в растворе
В мерную колбу вместимостью 100 мл получают у преподавателя или инженера-химика контрольный раствор серной кислоты. Раствор в колбе доводят до метки дистиллированной водой комнатной температуры и, плотно закрыв пробкой, тщательно перемешивают.
40
Бюретку заполняют рабочим раствором щелочи, нормальность которого определена. Устанавливают уровень титрованного раствора щелочи на нуле, предварительно заполнив этим раствором носик бюретки.
Мерную пипетку ополоснуть контрольным раствором серной кислоты. Затем в колбу для титрования отмеряют пипеткой 10,00 мл раствора кислоты, добавляют 1-2 капли раствора фенолфталеина и титруют раствором щелочи до появления розовой окраски. Получают не менее трех сходящихся результатов.
Запись результатов титрования и вычисления проводят по следующей
форме:
Объем мерной колбы 100 мл Объем пипетки 10 мл
V(H2S04), мл V(NаОН),мл 10,00 10,00 10,00 10,00
VCP(NaOH) =;
N(H2S04) = N(NaOH) · VCP (NaOH) / V(H2S04) [н];
Q(H2S04) = N(H2S04) · 49·100/ 1000 [г]
г-экв. (H2S04)=98/2 = 49 г.
Определив практическую массу серной кислоты, покажите свои расчеты преподавателю. После чего получите у преподавателя или инженера-химика теоретический результат и вычислите погрешности.
Примеры решения типовых задач
Задача 1. Рассчитайте нормальность и титр раствора NaOH, если ни титрование 20,00 см3 этого раствора израсходовано 22,30 см раствора 0,1225 н H2S04.
Решение. 1) Задача на метод кислотно-основного титрования (ацидиметрия).
Уравнение реакции: 2NaOH + H2S04 → Na2S04 + 2Н20.
2)Способ прямого титрования: В точке эквивалентности nэ1 = nэ2,
отсюда
N1 –V1=N2-V2;
N(NaOH) = N(H2S04) · V(H2S04) / V(NaOH);
N(NaOH) = 22,30 · 0,1225/20,00 = 0,1378 н.
T(NaOH) = N(NaOH) · г-экв. (NaOH) / 1000;
г-экв.(NaOH) = M(NaOH) /1 = 40 г.
T(NaOH) = 0,1378 · 40 / 1000 = 0,0005512 г/см3.
Задача 2. На титрование навески Na2C03, равной 0,1325 г израсходовано 25 см3 соляной кислоты. Чему равна нормальность соляной кислоты?
Решение. 1) Задача на метод кислотно-основного титрования. Определение концентрации рабочего раствора по стандартному раствору установочного вещества.
Уравнение реакции:
Na2C03 + 2НС1 → 2 NaCl + С02 + Н20. 2) Способ прямого титрования.
nэ1 = nэ2; n э1 = g /г-экв.; пэ2 = N·V /1000; N = g · 1000 /г-экв. · V;
г-экв.(Na2C03) = M(Na2C03) / 2 = 53.
41
3) Вычисляем нормальность соляной кислоты: N(HC1) = g(Na2СO3) · 1000 / г-экв.(Nа2С03) • V(HC1)
N(HC1) = 0,1235 · 1000 / 53 · 25,00 = 0,1 н.
Задача 3. Сколько граммов H2S04 содержится в исследуемом растворе, если на титрование его израсходовано 15,15 см3 раствора NaOH, титр гидроксида натрия по серной кислоте Т (NaOH / H2S04).= 0,004904 г/см3.
Решение Задача на метод кислотно-основного титрования (алкалиметрия). Уравнение реакции:
H2S04 + 2NaOH → Na 2S04 + 2H20. g(H2S04) = T(NaOH / H2S04) · V(NaOH)[г], g(H2S04) = 0,004904 · 15,15 = 0,07429 г.
МЕТОДЫ ОКИСЛЕНИЯ-ВОССТАНОВЛЕНИЯ
(РЕДОКСИМЕТРИЯ)
В основе методов окислительно-восстановительного титрования лежат различные окислительно-восстановительные реакции. Если в качестве рабочего раствора (титранта) применяют раствор окислителя, метод называется оксидиметрия, восстановителя - редуктометрия.
|
Лабораторная работа № 4 |
|
||
|
Перманганатометрия (оксидиметрия) |
|
||
Рабочий раствор - 0,02 н КМn04 |
(перманганат калия). |
|
||
Установочные вещества |
- |
0,02 н Н2С204·2Н20 (щавелевая |
кислота); |
|
Na2C204 (оксалат натрия). |
устанавливается безындикаторным |
методом по |
||
Точка |
эквивалентности |
|||
появлению слабо-розового окрашивания от одной избыточной капли КМn04 Перманганат калия (КМn04) является сильным окислителем, окислительная
способность его зависит от реакции среды. В кислой среде φ°(Мn04- / Мn2+) = + 1,51В. и реакция протекает по схеме: 5Fe2+ + Mn04- + 8Н+ → Mn 2+ + 5Fe3+ + 4Н20
МnО4- + 8Н+ + 5ё → Мn2+ + 4Н20
В кислой среде перманганат-ион присоединяет 5 электронов, следовательно, грамм-эквивалент г-экв( КМn04) = М (КМn04)/nё (число электронов, принятых 1
молем окислителя);
г-экв (КМn04) =158,03/5 =31,61 г.
В нейтральной или щелочной среде окислительная способность перманганат - иона ниже, чем в кислой:
φ°(Мn04-/Мn02) = +0.59В, реакция протекает по схеме:
МnО-4 + 3Н20 + Зё → МnО(ОН)2 + 4OH-. г-экв (КМn04) =158,03/3 =52,68 г.
1. Приготовление рабочего раствора перманганата калия
0,02 н раствор КМn04 в объеме 200 мл готовят из приблизительно 0,1 н раствора, выдержанного в течение 7-10 дней. Объем исходного раствора КМn04 вычисляют по формуле: Vисх = 200·0.02/0,1 = 40 мл.
V(H20) = 200 - 40= 160 мл.
Проверив концентрацию исходного раствора и вычислив его объем, мерным цилиндром отмеряют 40 мл этого раствора и разбавляют до 200 мл
42
дистиллированной водой в плоскодонной колбе ёмкостью 300-500 мл. Приготовленный раствор тщательно перемешивают.
2. Приготовление раствора установочного вещества
0,02 н раствор щавелевой кислоты (Н2С204·2H2O) готовят в мерной колбе вместимостью 100 мл. Расчет навески щавелевой кислоты делается по формуле:
а = 0.02·63.03·0.1 =0.12606 г.
Навеску кислоты берут в сухой чистый стакан емкостью 50-100 мл. предварительно взвешенный сначала на технических, затем-аналитических весах. Навеска берется в пределах от 120 до 130 мг (0,12-0,13 г).
Показатель |
|
На технических |
|
На аналитических |
|
|
весах |
|
весах |
Масса пустого стакана, г |
|
|
|
|
Масса стакана + масса кислоты, г |
|
|
|
|
ά, реальная навеска кислоты, г |
|
|
|
|
Навеску Н2С204 · 2Н20 |
растворяют в небольшом |
объеме дистиллированной |
||
воды и количественно (без потерь) переносят в мерную колбу на 100 мл, доводят до
метки и, плотно закрыв пробкой, тщательно перемешивают. Вычисляют титр и нормальность раствора Н2С204 · 2Н2О по формулам:
Т(Н2С204 · 2Н20) = ά / Vколбы [г/мл]; (а -реальная навеска кислоты, г)
N(H2C204 · 2Н20) = Т·1000 /г-э [н].
3. Определение нормальности перманганата калия по щавелевой кислоте
Реакция между перманганатом калия и щавелевой кислотой протекает по
уравнению: |
|
|
|
|
|
2KMn04 |
+ 5Н2С204 + 3H2S04 |
= 2MnS04 |
+ K2S04 + 10С02 |
+ 8Н20. |
|
Реакция |
автокаталитическая, катализатором являются ионы Мn2+, поэтому |
||||
для ускорения реакции смесь необходимо подогреть до температуры 80-90°С. |
|||||
Бюретку |
заполняют |
рабочим |
раствором |
КМn04, |
предварительно |
ополоснув ее |
дистиллированной водой и рабочим раствором КМn04. Уровень |
||||
жидкости в бюретке устанавливают на нуле по верхнему краю мениска ввиду темной
окраски раствора. |
|
|
|
||
Мерную |
пипетку вместимостью 10 мл |
промыть |
дистиллированной |
водой |
|
и ополоснуть раствором щавелевой кислоты. В колбу |
для титрования отмеряют |
||||
пипеткой |
10 |
мл раствора щавелевой кислоты, |
добавляют цилиндром 7-10 |
мл 2н |
|
раствора |
H2SO4 |
и подогревают до 80-90o С на асбестовой сетке над газовой горелкой |
|||
или на электрической плитке с закрытой спиралью. Доводить до кипения раствор в
колбе нельзя. Горячий раствор Н2С204 титруют раствором перманганата калия при постоянном перемешивании, добавляют очередную каплю КМn04 после обесцвечивания раствора. Скорость реакции постепенно увеличивается. Титрование
оканчивают в тот момент, когда бледно-розовая окраска раствора в колбе появляется от |
||
одной избыточной капли раствора КМn04 и не исчезает в течение 1-2 мин. |
|
|
Раствор титруют до получения не менее грех сходящихся результатов. |
|
|
Запись |
результатов титрования и вычисление нормальности и |
титра |
перманганата калия по железу выполняют в следующей последовательности:
43
V (И2С204),мл |
V(KMn04), мл |
10.00 |
|
10.00 |
|
10.00 |
|
10.00 |
|
VCp(KMn04)= г-экв.(Fe2+) =1 · 55,85 =55,85 г
N(KMn04) = N(H2C204)·V(H2C204) / Vср(КМn04)[н]; T (KMnО4/ Fe2+) = N(KMn04)·55,85 / 1000 [г/мл]
Контрольная задача
Определение количества железа (II) в растворе соли Мора
(NH4),Fe(S04)2 · 6Н20
Реакция |
между |
солью двухвалентного |
железа и перманганатом |
калия |
в |
||||
кислой среде протекает по уравнению: |
|
|
|
|
|
|
|||
2KMn04 |
+ 10FeS04 |
+ 8H2S04 = 2MnS04 + 5Fe2(S04)3 |
+ K,S04 |
+ 8H20. |
|
или |
|||
В мерную |
колбу вместимостью |
100 мл |
получают |
у преподавателя |
|||||
инженера-химика |
контрольный |
раствор |
соли |
Мора. |
Доводят |
до метки |
|||
дистиллированной водой и, плотно закрыв колбу пробкой, тщательно перемешивают . Устанавливают бюретку, вставляют в неё воронку и промывают сначала
дистиллированной водой, затем ополаскивают рабочим раствором КМn04. Бюретку наполняют рабочим раствором перманганата калия, предварительно заполнив носик.
Уровень жидкости на нуле устанавливают по верхнему краю мениска. |
|
|||
Пипетку емкостью |
10 мл |
промывают |
дистиллированной |
водой, |
ополаскивают раствором соли |
Мора. В колбу для титрования отмеряют пипеткой 10 |
|||
мл раствора соли Мора, добавляют цилиндром 5 - 7 мл 2 н раствора H2S04 |
и титруют |
|||
раствором КМn04 до появления не исчезающей в течение 1-2 мин бледно-розовой окраски, |
||||
появившейся от одной избыточной капли раствора КМn04. |
|
Титрование проводят до получения не менее трех сходящихся результатов. |
|
Запись результатов титрования и вычисления проводят в следующей |
|
последовательности: |
|
V10,00(FeSO4), мл |
V(KMn04), мл |
10.00 |
|
10,00 |
|
10,00 |
|
Vср.(KMn04)=
Q(Fe) = Vср(KMn04) · Т (КМn04/ Fе2+)·Vколбы / Vпипетки [г].
Определив практическую массу железа в контрольном растворе соли Мора, возьмите у инженера-химика теоретическое значение и вычислите погрешности определения.
Примеры решения типовых задач
Задача 4. Вычислить нормальность и титр перманганата калия (КМn04) по железу, зная, что на титрование раствора щавелевой кислоты, содержащего 0,01399 г Н2С204 · 2H2O, израсходовано 12,44 см3 раствора перманганата калия.
44
Решение. 1) Задача на метод окислительно-восстановительною титрования -
перманганатометрия. |
|
Уравнение реакции |
|
2КМn04 + 5Н2С204 + 3H2S04 → 2MnSO |
4 + СО2 + K2S04 + Н20: |
2 | Мп04- + 8Н+ +5ё → Мn2+ + 4Н20 |
|
5 |С2042- - 2ё → 2С02. |
|
2) Метод прямого титрования |
|
nэ1 = nэ2; nэ1 = g /г-экв; |
nэ2 = N·V /1000: |
g / г-экв = N·V /1000; |
|
N = g · 1000 / г-экв · V;
Т( KMn04/Fe) = N(KMn04) · г-экв (Fe) / 1000:
г-экв (H2C204) = М(Н2С204) / 2 = 126,06 / 2 = 63.03 г; г-экв (Fe) = 55,85 г.
3) N(KMnO4) = 0,01399 · 1000/63,03 · 12.44 = 0.01784 н.
Т( KMnО4/Fe) = 0.01784 · 55.85 / 1000 = 0,0009962 г/см3.
Задача 5. Вычислить количество меди, содержащееся в 250 см3 раствора медного купороса, если на титрование 25,00 см3 этого раствора израсходовано 27,75
см3 0,01848 н раствора тиосульфата натрия.
Решение. 1) Задача на метод окисления-восстановления - йодометрия. Уравнение реакции
2CuS04 + 4KI → ↓ 2CuI + 2K2S04 + I2
2 | Cu2+ + ё → Cu+
1 | 2I- - 2ё→ I2°
I2 + 2Na2S203 → 2NaI + Na 2S406
1 | 2S2032- - 2ё →S4062-
1 │ I2 + 2ё → 2I-
2) Титрование по методу замещения
nэ(CuS04) = nэ(I2) = nэ (Na2S203); nэ (CuS04) = nэ (Na2S2O3);
nэ (CuSO4) =g(CuS04) / г-экв(CuS04) = N(CuS04)·V(CuS04) / 1000;
nэ (Na2S203) = N(Na2S203) · V(Na2S203) / 1000 ;
N(CuS04) · V(CuS04) = N(Na2S203) · V(Na2S203):
N(CuS04) = N(Na2S203) · V(Na2S203) / V(CuS04);
N(CuS04) = 0,01848 · 27,75 / 25,00 = 0,02051 н. g(Cu) = N(CuS04) · V(CuSО4) г-экв(Сu) / 1000 g(Cu) = 0,02051 · 250 · 63.55 / 1000 = 0,3259 г
МЕТОДЫ КОМПЛЕКСООБРАЗОВАНИЯ
Воснове методов лежат реакции образования комплексных соединений, в результате которых определяемый ион количественно выводится из раствора.
1.Комплексонометрическое титрование
Воснове методов комплексонометрического титрования лежат реакции образования прочных внутрикомплексных соединений. Широкое применение комплексонометрия получила с введением в практику аналитической химии
аминополикарбоновых |
кислот |
и их |
солей, |
называемых |
комплексонами. |
Наибольшее распространение |
получила |
динатриевая соль |
этилендиамин- |
||
45
тетрауксусной кислоты (ЭДТА), называемая комплексоном III или трилоном Б.
Комплексон |
III |
образует |
растворимые |
внутрикомплексные соединения |
с |
различными |
металлами строго |
определенного |
состава, а именно: отношение |
||
катионов металла к лиганду равно 1:1. |
|
|
|||
Вкачестве индикаторов в комплексонометрии используют
металлоиндикаторы. Это органические красители, образующие с металлами окрашенные комплексы, менее прочные, чем комплексы катиона этого металла с комплексоном.
Лабораторная работа № 5 Определение суммарной жесткости водопроводной воды
Рабочий раствор |
- 0,05 |
н Nа2С10Н14N208·2Н20 |
(комплексон |
III, |
трилон |
|||
Б, динатриевая соль этилендиаминтетрауксусной кислоты). |
|
|
|
|
||||
Установочные вещества - MgS04·7H20, СаС03 и др. |
|
хром |
темно-синий |
|||||
Индикаторы - |
эриохром |
черный |
Т, |
мурексид, |
||||
кислотный и др. |
|
|
|
|
|
|
|
|
1. Приготовление раствора ЭДТА (трилона Б) |
|
|
|
|
|
|||
Молекулярная масса трилона Б: |
М = 372.2. |
В реакциях |
с катионами |
|||||
двухвалентных металлов г-э ЭДТА = М/2. Трилон |
Б |
не вполне |
отвечает |
|||||
требованиям, предъявляемым к исходным |
веществам. |
Поэтому |
приготовляют |
|||||
сначала приблизительно |
0,1 н раствор трилона Б |
в расчете |
на 100 |
мл раствора, |
||||
вычисляют навеску по формуле: а = 0.1·186.1·0,1=1,861г, (г-э ЭДТА= 186,1 г).
Навеску трилона Б около 1.9 г берут на технических весах и растворяют в 100 мл
дистиллированной воды. |
|
|
|
|
|
|
|
|||
2. Приготовление раствора установочного вещества |
|
|
||||||||
В |
качестве |
установочного |
вещества |
берется |
перекристаллизованный |
|||||
MgSO4·7Н2O, раствор которого готовят но навеске в мерной колбе на 100 мл. |
||||||||||
|
|
|
а =0,1 · 123.24 · 0,1= 1,2324 г. |
|
|
|
||||
В |
сухой |
чистый |
стакан |
вместимостью |
50-100 мл, предварительно |
|||||
взвешенный |
на технических, |
затем на аналитических |
весах берут навеску сульфата |
|||||||
магния около 1,2-1,3 г. |
|
|
|
|
|
|
|
|||
|
|
Показатель |
|
|
На технических |
|
На аналитических |
|||
|
|
|
|
|
|
|
весах |
|
|
весах |
Масса пустого стакана, г |
|
|
|
|
|
|
|
|||
Масса стакана+масса сульфата магния, г |
|
|
|
|
|
|
||||
ά, реальная навеска MgS04·7H20, г |
|
|
|
|
|
|
||||
Навеску |
растворяют |
в небольшом |
количестве |
дистиллированной воды, |
||||||
переносят количественно в мерную колбу на 100 мл, доводят раствор до метки и, плотно закрыв пробкой, тщательно перемешивают.
Вычисляют титр и нормальность раствора сульфата магния по формулам:
Т (MgS04) = ά / V колбы [г/мл]; (ά -реальная навеска MgS04·7H20, г) N(MgS04) = Т (MgS04)·1000 /г-экв (MgS04)[н]. г-
экв(MgS04)= 123,24г.
46
3.Определение нормальности раствора трилона Б по раствору сульфата
магния |
|
|
Бюретку промывают дистиллированной водой, |
затем |
ополаскивают |
рабочим раствором трилона Б и заполняют до нулевого деления. |
|
|
В колбу для титрования вносят мерной пипеткой |
10.00 |
мл раствора |
сульфата магния, 5 мл аммиачного буфера, 5-7 капель индикатора хром-темносинего и медленно титруют, добавляя раствор трилона Б до перехода окраски от одной капли рабочего раствора из розовой в сине-фиолетовую.
Титрование проводят до трех сходящихся результатов.
Запись результатов титрования и вычисления производятся в следующем
порядке: |
|
V (МgSO4),мл |
V(трилона Б), мл |
10,00 |
|
10,00 |
|
10,00
10,00
VСР(трилона Б)=
N(трилона Б) = N(MgS04) · V(MgS04) / VcР(трилона Б)[н];
Жесткость воды и методы её уст ранения
Примеси, растворенные в воде, оказывают существенное влияние на её свойства. Эти примеси весьма необходимы для жизни человека, животных и растений, но часто оказываются очень вредными для применения воды в технике, так как эти примеси при высокой температуре образуют плотный осадок на стенках котлов, осаждаются на стенках труб в системах водяного охлаждения, что приводит к
выходу этих систем из строя. |
|
|
|
|
4.Определение жесткости водопроводной и кипяченой воды |
|
|||
В коническую колбу вместимостью 200-250 мл налить |
100 мл |
|||
водопроводной |
воды; добавить 5 мл аммиачной |
буферной |
смеси и |
7-8 капель |
индикатора хром-темносинего. Раствор тщательно перемешать. |
Обратить внимание |
|||
на цвет раствора, который должен стать розовым. |
|
|
|
|
Бюретку |
промыть дистиллированной водой, |
затем, ополоснув |
раствором |
|
трилона Б, установить уровень рабочего раствора в бюретке на нуле. Титруют раствор и колбе до появления сине-фиолетового окрашивания, тщательно перемешивая содержимое колбы. Раствор трилона Б приливать медленно по каплям и при приближении к точке конца титрования перемешивать особенно тщательно.
Изменение окраски раствора означает, что трилон Б полностью связал ионы
Са2+ и Mg 2+.
Записать объем трилона Б, пошедшего на титрование. Титрование проводят до трех сходящихся результатов.
5.0пределение жесткости кипяченой (умягченной) воды
Получить три сходящихся результата, взяв для определения прокипяченную воду. Подготовку кипяченой воды к титрованию и титрование её проводят аналогично водопроводной воде. Результаты определений записывают в таблицу.
47
Форма записи. |
|
|
|
|
|
Титрование |
Объем |
|
Объем трилона Б, |
VCp (трилон Б), |
Жесткость |
|
воды, мл |
|
мл |
мл |
воды, мг-экв/л |
1. |
100.00 |
|
|
|
|
2. |
100.00 |
|
|
|
|
3. |
100,00 |
|
|
|
|
4. |
100,00 |
|
|
|
|
|
|
Кипяченая (умягченная) вода |
|
||
1 |
100,00 |
|
|
|
|
2 |
100.00 |
|
|
|
|
3 |
100,00 |
|
|
|
|
4 |
100,00 |
|
|
|
|
Вычисляют общую, постоянную и временную жесткость воды по формуле:
Ж = V1 · N1 · К · 1000 / Vводы [мг-экв/л],
где N1 - нормальность трилона Б (0,05 н); V1 - средний объем трилона Б, пошедшего на титрование, мл; К - поправочный коэффициент нормальности раствора трилона Б (К=1 );Vводы - объем воды, мл; N1 · К - истинная нормальность раствора трилона Б.
Вопросы
1.Какая жесткость устраняется кипячением?
2.Какие способы устранения жесткости воды вам известны?
(ответ мотивируйте, составив соответствующие химические уравнения).
Примеры решении типовых задач Пример 1. Сколько граммов хлорида кальция содержится в 500 л воды, если
жесткость, обусловленная присутствием этой соли, равна 4 ммоль?
Решение. Молярная масса М(СаСl2) = 111 г/моль, молярная масса эквивалента
хлорида кальция Мэ(СаСl2) = fэкв·М(СаС12); Мэ (СаСl2) - 1/2·111 =55.5 г/моль.
В 500 л воды с жесткостью, равной 4 ммоль/л, содержится 500 · 4 = 2000 ммоль СаСl2 или 2000 · 55,5 = 111 000 мг или 111 г хлорида кальция.
ФИЗИКО-ХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
ПОТЕНЦИОМЕТРИЧЕСКИЙ АНАЛИЗ 1.СУЩНОСТЬ МЕТОДА, ОБЛАСТЬ ЕГО ПРИМЕНЕНИЯ
Потенциометрический анализ — это один из электрохимических методов анализа, основанный на измерении потенциала электрода, погруженного в анализируемый раствор, или, иначе говоря, на определении концентрации иона по электродвижущей силе (ЭДС) гальванического элемента.
Гальванический элемент состоит из двух электродов, а ЭДС его представляет собой разность потенциалов этих электродов. Для потенциометрического анализа используют гальванические элементы, состоящие из индикаторного электрода и электрода сравнения. Потенциал первого зависит от концентрации определяемого иона в растворе, а потенциал второго не чувствителен к концентрации этого иона. Поэтому ЭДС гальванического элемента зависит только от концентрации определяемого (потенциалопределяющего) иона в растворе.
48
В потенциометрическом анализе |
различают |
метод прямой |
потенциометрии |
|
и метод потенциометрического титрования. |
|
|
||
Прямая |
потенциометрия |
предполагает |
измерение |
электродного |
потенциала (точнее, ЭДС гальванического элемента), по которому можно определить концентрацию (или активность) потенциалопределяющего иона в растворе. Предварительно, пользуясь растворами с известной концентрацией, калибруют (настраивают) электрод, т.е. опытным путем определяют зависимость его потенциала от
концентрации потенциалопределяющего иона. |
|
|
|
||
Прямая |
потенциометрия |
широко |
применяется |
для |
определения |
концентрации |
водородных ионов или рН (водородный показатель) |
растворов. Появле- |
|||
ние ионоселективных мембран, пропускающих ионы только одного вида, привело к
разработке |
методов потенциометрического |
определения |
других ионов, |
например |
||||||||
катионов натрия, калия, |
аммония, |
а также хлорид-, бромид- |
и |
нитрат-анионов с |
||||||||
помощью специальных приборов - иономеров. |
|
|
|
|
|
|
|
|||||
Ионоселективные электроды позволяют измерять концентрации 398 ионов в |
||||||||||||
пределах |
от |
нескольких |
моль/л |
до |
10-6 моль/л. При |
этом |
необходимый |
для |
||||
определения объем раствора составляет всего 0,05- 0,1 мл. |
|
|
|
|
|
|
||||||
К |
преимуществам |
прямой |
потенциометрии |
относится |
то, |
что |
при |
|||||
определении |
концентрация анализируемого |
раствора |
не |
изменяется, имеется |
||||||||
возможность |
работать с |
малыми |
объемами |
разбавленных |
растворов, определения |
|||||||
легко поддаются автоматизации, что используется в агрохимической службе, при
контроле технологических процессов и при изучении биологических систем. |
|
|||
Прямая потенциометрия |
широко |
применяется в |
агрохимических |
и |
почвенных лабораториях для определения рН мутных и окрашенных растворов. |
|
|||
Потенциометрия незаменима |
также |
в технохимическом |
контроле пищевых |
|
производств. На использовании потенциометрии основаны приборы автоматического контроля и регулирования процессов химической технологии. Кроме того, потенциометрический анализ необходим для биологических и медицинских исследований.
2.ПРИМЕНЯЕМАЯ АППАРАТУРА, ЭЛЕКТРОДЫ И ПОТЕНЦИОМЕТРЫ Измерить потенциал отдельно взятого электрода невозможно, поэтому для
измерения электродного |
потенциала используют |
гальванический элемент, т.е. |
|
систему, состоящую из |
двух электродов. |
Один из них, электрод сравнения, должен |
|
быть нечувствительным к ионам раствора, |
потенциал |
его постоянен, заранее известен |
|
и не зависит от состава раствора. Чаще других электродов сравнения используют
насыщенный хлорсеребряный электрод. |
|
|
|
|
||
Второй |
электрод |
гальванического |
элемента называют |
индикаторным |
||
электродом. |
Потенциал |
его, зависящий от |
концентрации |
определяемого иона, |
||
измеряется |
относительно |
электрода |
сравнения. Материал |
для индикаторного |
||
электрода зависит от |
природы |
ионов, |
концентрацию |
которых |
в растворе |
|
предполагается определить. При прямой потенциометрии для каждого вида ионов
подбирают свой индикаторный электрод. |
|
|
|
|
В качестве |
индикаторного |
электрода |
обычно применяют |
стеклянный |
электрод. |
|
|
|
|
Насыщенный |
хлорсеребряный |
электрод |
сравнения - это |
металлическое |
серебро, покрытое тонким слоем хлорида серебра и погруженное в насыщенный раствор хлоридов калия и серебра.
49
Стеклянный индикаторный электрод имеет вид трубки с тонкостенным шариком из специального стекла на конце. Внутри этого шарика находится буферный раствор и погруженный в него металлический контакт. Стеклянный индикаторный
электрод погружают шариком в анализируемый раствор. |
|
|
|
Для |
определения электродного потенциала, |
т.е. |
ЭДС гальваническою |
элемента, |
чаще всего применяют компенсационную |
схему, |
в которой измеряемая |
ЭДС уравновешивается известной ЭДС источника постоянного тока (стандартного элемента). Приборы, основанные на использовании компенсационной схемы, называют потенциометрами (так как они служат для измерения разности потенциалов).
Измерительные приборы, работающие по компенсационной схеме, не потребляют тока, ч то исключает возможность ошибок, связанных с сопротивлением системы или с поляризацией. Помимо этого, ток, возникающий в электродной цепи компенсационной схемы, весьма незначителен. Поэтому его обычно усиливают с помощью специальных усилителей.
Для определения рН растворов широко используют потенциометры различных конструкций, например рН-метры — милливольтметры: рН-150, рН-121, рН-340, рН-метр "63А", а также универсальные иономеры: ЭВ-74, Е-340, И-130 и более
сложные. |
|
|
|
|
|
Для |
измерения на |
иономере |
концентрации |
(активности) |
ионов водорода |
применяют |
стеклянные |
электроды |
ЭСЛ-43-07 и |
ЭСЛ-63-07, |
т.е. электроды с |
водородной функцией. До начала работы их вымачивают 8—10 ч в 0,1 М растворе хлороводородной кислоты (НС1), несколько раз промывают дистиллированной водой, сушат фильтровальной бумагой и опускают в буферный раствор.
Если погрузить в раствор стеклянный электрод, представляющий собой тонкостенный шарик из литиевого стекла, то происходит обмен ионами между раствором и поверхностью шарика, т.е. ионы лития проникают из стекла в раствор, а ионы водорода — из раствора в стекло. Поэтому на поверхности стеклянного электрода устанавливается потенциал, величина которого определяется концентрацией водородных ионов. В действительности свойства внешней и внутренней поверхностей стеклянного шарика неодинаковы и возникающие на них потенциалы несколько отличаются; разность между ними, именуемая потенциалом асимметрии, может искажать результаты измерения потенциала. Чтобы исключить эти погрешности, показания электрода обычно проверяют по буферным растворам, корректируют шкалу рН-прибора.
Работа на иономере ЭВ-74 требует определенной последовательности операций. Штекер на конце датчика включают в гнездо "Изм." на задней стенке прибора, вспомогательный электрод сравнения заполняют насыщенным раствором хлорида калия. Включив прибор в сеть, прогревают его 50—60 мин и корректируют нуль гальванометра.
Затем настраивают иономер по буферным растворам. Наливают в сухой стаканчик буферный раствор с рН 1.68, опускают в него электроды, температурный корректор устанавливают против отметки, отвечающей температуре раствора. После этого ручку потенциометра настройки ставят в среднее положение, переключатель "Размах" переводят в положение "-1—19 рН" потенциометром "Еи" и грубо корректируют стрелку гальванометра в положение "1,68 рН"; более плавно подводят стрелку к этой точке потенциометром "Еи".
50
Ополоснув электроды водой и осушив фильтровальной бумагой, опускают их в буферный раствор с рН 4.58. переключают кнопку диапазона в положение "4—9 рН", корректируют рН.
Точно так же проверяют рН по стандартным буферным растворам с рН 6.88 (в диапазоне 4—9 рН) и рН 9,22 (в диапазоне 8—11 рН). Если при проверке во всех диапазонах отклонения рН не превышают 0.05, заканчивают настройку. После этого можно измерять рН исследуемого раствора.
Настраивает |
иономер |
по |
буферным |
растворам |
преподаватель (или |
||
инженер-химик) перед выполнением работы. |
|
|
|
|
|||
Стеклянный электрод оберегают от высыхания, так как |
это может изменять |
||||||
его характеристики: по окончании работы его погружают в воду. |
|
|
|
||||
Вспомогательный электрод |
заполняют |
насыщенным |
раствором |
хлорида |
|||
калия и периодически доливают раствор. |
|
|
|
|
|||
|
ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ (рН) |
|
|
|
|||
Водородный |
показатель |
среды |
водного |
раствора электролита |
рН |
равен |
|
взятому с обратным знаком десятичному логарифму концентрации |
(активности) |
||||||
ионов водорода в этом растворе: |
|
|
|
|
|
|
|
|
рН = - lg См (Н+) |
Наряду с показателем рН используется показатель рОН (гидроксильный |
|
показатель). |
рОН = - lg См(ОН-) |
Среда водного |
раствора электролита может быть кислой, нейтральной или |
щелочной. Носителями кислотных свойств являются ионы водорода (Н+). а основных
гидроксид |
ионы |
(ОН-). Известно, |
что |
в кислых |
растворах |
электролитов |
||||
См(Н+)>См(ОН-), |
в |
нейтральных |
- |
См(Н+)=См(ОН-), |
а |
в |
щелочных |
- |
||
См(Н+)<См(ОН-). |
|
водородного показателя |
среды водных |
растворов сильных |
||||||
При |
расчете |
|||||||||
кислот и |
оснований следует |
учитывать |
необратимость |
процесса |
их |
|||||
электролитической диссоциации (а =1). Поэтому концентрация ионов Н+ в растворах сильных кислот и концентрация ОН- ионов в растворах сильных оснований численно равны исходной молярной концентрации раствора кислоты или основания.
|
Концентрация ионов Н+ в |
растворах слабых кислот |
и концентрация ОН- |
||||
ионов |
в |
растворах |
слабых |
оснований |
численно |
равны |
концентрации |
продиссоциировавших молекул электролита (произведению степени диссоциации на исходную молярную концентрацию раствора электролита):
См(Н+) = а · См ;
См(ОН-) = а · См, где а - степень диссоциации электролита; См - исходная молярная
концентрация электролита, моль/л
Пример 1: Вычислите рН 0,01 М раствора HCI.
Решение. НС1-сильная кислота, степень диссоциации ее равна единице. Откуда
См(Н+) = См (HCI) См(Н+)= 0,01 М=1·10 -2 моль/л;
рН = - lg См(Н+) рН = - lg10-2 = 2
51
Пример 2: Какова концентрация гидроксид-ионов в растворе, водородный показатель которого 5,2.
Решение. Вычисляем концентрацию ионов водорода в этом растворе рН = - lg См(Н+); См(Н+) = 10 -рН;
См (Н+) = 10-5,2: = 10-6 · 100,8= 6,3·10-6 моль/л.
Так как ионное произведение воды [Н+]·[OH-] = 10-14,
то См(ОН-)= 10-14 / См(Н+), См(ОН-) = 10-14 / 6,3·10-6= 1.6·10-9 моль/л.
Лабораторная работа № 6
1. ОПРЕДЕЛЕНИЕ ВОДОРОДНОГО ПОКАЗАТЕЛЯ (рН) РАСТВОРА НА
|
|
ИОНОМЕРЕ ЭВ-74 |
|
|
||
До начала измерения |
переключатели |
иономера установите в положения "t" |
||||
и "-1—19". Включите иономер в сеть и прогрейте его 30 мин. |
|
|
||||
Слегка |
приподнимите |
стаканчик |
с |
электродами, |
отодвиньте |
столик, |
промойте электроды дистиллированной водой из промывалки. Остатки |
воды с |
|||||
электродов удалите кусочками фильтровальной бумаги. |
|
|
||||
Ход определения. Получите у преподавателя испытуемый раствор, |
налейте |
|||||
его в стаканчик (до половины объема) и погрузите в него электроды. |
|
|
||||
После этого последовательно нажмите |
кнопки прибора |
"Катионы, |
анионы". |
|||
"рХ" и "-1-19". |
|
|
|
|
|
|
Заметьте |
положение стрелки на шкале |
"-1—19" показывающего прибора и |
||||
нажмите кнопку соответствующего диапазона. Если показание по шкале "-1 —19" оказалось между цифрами 8—9, то следует нажать кнопку диапазона 4—9.
Запишите показание стрелки иономера по шкале "0—5" и прибавьте к нему
начальную цифру выбранного диапазона. На |
этом определение величины рН |
|
испытуемого раствора закончено. |
|
|
Электроды |
до следующего определения оставьте в дистиллированной воде. |
|
Выключите иономер из сети. |
|
|
Вычислите |
по величине рН значение |
рОН, а также молярные |
концентрации ионов водорода и ионов гидроксила в испытуемом растворе. Укажите реакцию среды.
2. ОПРЕДЕЛЕНИЕ ВОДОРОДНОГО ПОКАЗАТЕЛЯ (РН) ВЫТЯЖКИ ИЗ
|
ПОЧВЫ |
|
В |
агрохимических и почвенных лабораториях |
определяют как рН водной |
вытяжки из почвы (актуальную кислотность), так и рН |
вытяжки на 1 М растворе |
|
хлорида |
калия (обменную кислотность). Но рН водной вытяжки из почвы – |
|
величина |
неустойчивая, меняющаяся в течение вегетационного периода. Поэтому |
|
чаще определяют рН солевой вытяжки (КСl-вытяжки) из почвы, значение которого обычно ниже, чем в водной вытяжке из той же почвы. По рН солевой вытяжки из почвы судят о степени ее кислотности и необходимости известкования. Считают, что при рН 3-4 почва сильнокислая, 4-5 кислая, 5-6 слабокислая, 7 нейтральная, 7-8 слабощелочная, 8-9 щелочная, 9-11 сильнощелочная. Почвы с рН солевой вытяжки меньше 4,5 нуждаются в известковании.
52
