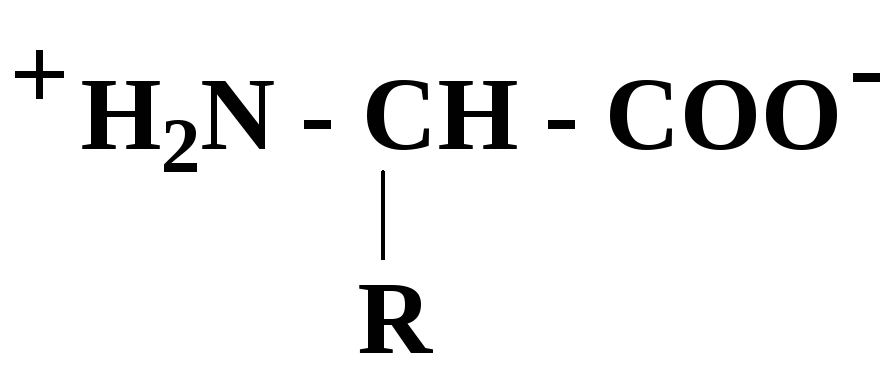- •Основы биологической химии предисловие
- •Введение Предмет и задачи биохимии
- •Основные признаки живой материи
- •Глава 1. Химический состав организмов
- •Глава 2. Структура и свойства белков
- •2.1. Роль и определение белков.
- •2.2. Функции белков в организме
- •2.3. Элементный состав белков. Содержание белков в органах и тканях
- •2.4. Аминокислотный состав белков
- •2.5. Кислотно-основные свойства аминокислот
- •2.6. Стереохимия аминокислот
- •2.7. Строение белков
- •2.8. Уровни структурной организации белков
- •Первичная структура
- •Вторичная структура белков
- •Третичная структура белков
- •Четвертичная структура белков
- •2.9. Физико-химические свойства белков
- •Кислотно-основные свойства белков
- •Растворимость белков
- •Денатурация и ренатурация
- •2.10. Классификация белков
- •2.11. Методы выделения и очистки белков
- •Очистка белков
- •Глава 3. Углеводы
- •3.1. Понятие об углеводах и их классификация
- •3.2. Моносахариды
- •Оптические свойства моносахаридов
- •Структура моносахаридов
- •3.3. Химические свойства моносахаридов Реакции с участием карбонильной группы
- •Реакции с участием гидроксильных групп
- •3.4. Сложные углеводы
- •Олигосахариды
- •Полисахариды
- •Гомополисахариды
- •Гетерополисахариды
- •3.5. Биологические функции углеводов
- •Глава 4. Нуклеиновые кислоты
- •4.1. Общая характеристика нуклеиновых кислот
- •4.2. Химический состав и строение нуклеиновых кислот
- •4.3. Уровни структурной организации нуклеиновых кислот
- •Первичная структура нуклеиновых кислот
- •Вторичная структура днк
- •Вторичная структура рнк
- •Третичная структура рнк и днк
- •Глава 5. Липиды
- •5.1. Общая характеристика и классификация липидов
- •5.2. Липидные мономеры
- •5.3. Многокомпонентные липиды
- •5.4. Биологические функции липидов
- •Глава 6. Ферменты
- •6.2. Химическая природа и структура ферментов
- •6.3. Кофакторы ферментов Ионы металлов как кофакторы ферментов
- •Коферменты
- •6.4. Механизм действия ферментов
- •6.5. Свойства ферментов
- •6.6. Специфичность действия ферментов
- •6.7. Факторы, влияющие на скорость ферментативного катализа
- •Влияние температуры на активность ферментов
- •Влияние рН на активность ферментов
- •Влияние концентраций субстрата и фермента на скорость ферментативной реакции
- •Зависимость скорости реакции от времени
- •6.8. Регуляция активности ферментов
- •Активация ферментов
- •Ингибирование ферментов
- •Аллостерическая регуляций действия ферментов
- •6.9. Определение активности ферментов
- •6.10. Номенклатура и классификация ферментов
- •6.11. Локализация ферментов в организме и клетке
- •6.12. Применение ферментов
- •Глава 7. Витамины
- •7.1.Понятие о витаминах
- •7.2. Классификация витаминов
- •7.3. Жирорастворимые витамины
- •7.4. Водорастворимые витамины
- •7.5. Витаминоподобные вещества
- •Глава 8. Общие закономерности обмена веществ и энергии в организме
- •8.1. Обмен веществ
- •8.2. Обмен энергии
- •Глава 9. Биологическое окисление
- •9.2. Дыхательная цепь
- •9.3. Окислительное фосфорилирование
- •Глава 10. Обмен углеводов
- •10.1. Переваривание углеводов
- •10.2. Метаболизм глюкозы
- •10.3. Биосинтез гликогена
- •10.4. Распад гликогена
- •10.5. Анаэробный гликолиз
- •10.6. Аэробный распад глюкозы
- •Аэробный распад глюкозы в мозге
- •10.7. Пентозофосфатный цикл
- •10.8. Биосинтез глюкозы (глюконеогенез)
- •10.10. Регуляция обмена углеводов
- •Глава 11. Обмен липидов
- •11.1. Переваривание липидов
- •11.2. Метаболизм глицерина
- •11.3. Метаболизм жирных кислот
- •11.4. Биосинтез жиров
- •11.5. Регуляция обмена липидов
- •Глава 12. Обмен нуклеиновых кислот
- •12.1. Пути распада рнк и днк
- •12.2. Распад пуриновых и пиримидиновых оснований
- •12.3. Биосинтез нуклеотидов
- •Биосинтез пурииовых нуклеотидов
- •Биосинтез пиримидиновых нуклеотидов
- •Биосинтез дезоксирибонуклеотидов
- •12.4. Биосинтез нуклеиновых кислот
- •Биосинтез днк (репликация)
- •Биосинтез рнк (транскрипция)
- •Безматричный синтез рнк
- •12.5. Путь информации от генотипа к фенотипу
- •Глава 13. Обмен белков
- •13.1. Понятие об обмене белков
- •13.2. Переваривание белков пищи и распад белков тканей Переваривание белков
- •Распад белков в тканях
- •13.3. Метаболизм аминокислот
- •Трансаминирование аминокислот
- •Дезамииирование аминокислот
- •Превращение углеродных скелетов аминокислот. Реакции декарбоксилирования
- •13.4. Удаление аммиака из организма. Орнитиновый цикл
- •13.5. Синтез аминокислот
- •13.6. Биосинтез белков (трансляция)
- •Глава 14. Водно-солевой и минеральный обмен
- •14.1. Водно-солевой обмен Содержание воды в организме и клетке
- •Роль и функции воды в процессе жизнедеятельности
- •14.2. Регуляция водно-солевого обмена
- •Регуляция рН
- •14.3. Минеральный обмен Минеральные вещества
- •Функции минеральных веществ
- •Минеральные вещества и обмен нуклеиновых кислот
- •Минеральные вещества и обмен белков
- •Минеральные вещества и обмен углеводов и липидов
- •14.4. Регуляция минерального обмена
- •Глава 15. Взаимосвязь обмена белков, жиров, углеводов и нуклеиновых кислот
- •Глава 16. Гормоны, нервно-гормональная регуляция обмена веществ
- •16.1. Понятие о гормонах. Основные принципы регуляции обмена веществ
- •16.2. Классификация гормонов
- •16.3. Общие представления о действии гормонов
- •16.4. Гормоны щитовидной и паращитовидных желез Гормоны щитовидной железы
- •Гормоны паращитовидных желез
- •16.5. Гормоны поджелудочной железы
- •16.6. Гормоны надпочечников
- •16.7. Гормоны половых желез
- •16.8. Гормоны гипоталамо-гипофизарной системы
- •16.9. Гормоны тимуса и эпифиза
- •16.10. Простагландины
- •16.11. Биохимическая адаптация
- •Рекомендуемая литература
- •Оглавление
2.5. Кислотно-основные свойства аминокислот
α-Аминокислоты в силу своего химического строения проявляют кислотно-основные (амфотерные) свойства, которые определяют многие физико-химические и биологические свойства белков. На этих свойствах основаны, почти все методы выделения и идентификации аминокислот и белков.
При нейтральном значении рН аминокислоты в растворах находятся в виде биполярного иона (цвиттер-иона), при этом аминогруппа протонирована (-NH3+), а карбоксильная группа - диссоциирована (-СОО-):
-

(рН ≈7)
Ионизация аминокислоты зависит от рН среды: в кислых растворах ионизирована аминогруппа, а в щелочных - карбоксильная группа:
|
|
|
|
(рН=1) |
(рН=11) |
В кислой среде α-аминокислоты выступают как основания (по аминогруппе), а в щелочной - как кислоты (по карбоксильной группе). У некоторых аминокислот может ионизироваться также радикал (R), в связи, с чем все аминокислоты можно разделить на заряженные и незаряженные (при физиологическом значении рН=6,0 - 8,0) (см. табл. 4). В качестве примера первых можно привести аспарагиновую кислоту и лизин:
|
|
|
|
Аспарагиновая кислота (отрицательно заряженная кислота, проявляет кислотные свойства) |
Лизин (положительно заряженная кислота, проявляет основные свойства) |
Если радикалы аминокислот нейтральные, то они не оказывают влияния на диссоциацию α-карбоксильной или α-аминогруппы, и величины рК (отрицательный логарифм, показывающий значение рН, при котором эти группы наполовину диссоциированы) остаются относительно постоянными.
Величины рК для α-карбоксилыюй (pK1) и α-аминогруппы (рК2) сильно различаются. При рН < pK1 почти все молекулы аминокислоты протежированы и заряжены положительно. Напротив, при рН > рК2 практически все молекулы аминокислоты являются отрицательно заряженными, так как α-карбоксильная группа находится в диссоциированном состоянии.
Следовательно, в зависимости от рН среды аминокислоты имеют суммарный нулевой положительный или отрицательный заряд. Значение рН, при котором суммарный заряд молекулы равен нулю, и она не перемещается в электрическом поле ни к катоду, ни к аноду, называется изоэлектрической точкой и обозначается pI.
Для нейтральных α-аминокислот значение pI находят как среднее арифметическое между двумя значениями рК:
![]()
При рН раствора меньше pI аминокислоты протонируются и, заряжаясь положительно, перемещаются в электрическом поле к катоду. Обратная картина наблюдается при рН > pI.
Для аминокислот, содержащих заряженные (кислотные или основные) радикалы, изоэлектрическая точка зависит от кислотности или основности этих радикалов и их рК (рК3). Значение pI для них находят по следующим формулам:
для кислых аминокислот:
![]()
для основных аминокислот:
![]()
В клетках и межклеточной жидкости организма человека и животных рН среды близко к нейтральному, поэтому основные аминокислоты (лизин, аргинин) имеют положительный заряд (катионы), кислые аминокислоты (аспарагиновая, глутаминовая) имеют отрицательный заряд (анионы), а остальные существуют в виде биполярного цвиттер-иона.