
pervye_20_voprosov_1_razdela
.docxВОПРОС 1.
Эквивалент. Эквивалентная масса. Эквивалентный объём. Закон эквивалентов.
Эквивалентом вещества называется условная частица, в целое число раз меньшая (или равная), чем соответствующая ей структурная или формульная единица вещества (атом, молекула, ион), участвующая в конкретной реакции.
Эквивалентная масса равна отношению молярной массы элемента к его окислительному числу.
Эквивалентная масса оксида равна сумме эквивалентных масс данного элемента и кислорода.
Эквивалентная масса соли равна отношению молярной массы соли к произведению числа атомов металла на его валентность.
Эквивалентная масса основания равна отношению молярной массы основания к числу замещенных гидроксогрупп.
Эквивалентная масса кислоты равна отношению молярной массы кислоты к числу замещенных атомов водорода.
 Эквивалентный
объём
Эквивалентный
объём
Объём, который занимает эквивалент вещества С, называется эквивалентным. Он может быть найден делением эквивалентной массы вещества на плотность или делением объема на число эквивалентов этого числа.
Закон эквивалентов.
Согласно закону эквивалентов, вещества взаимодействуют и образуются в эквивалентных количествах.
ВОПРОС 2.
Примеры расчёта эквивалента элемента, оксида, основания, соли, кислоты, окислителя, восстановителя.
-
ЭЛЕМЕНТА. Определим эквивалентную массу серы в молекуле серной кислоты. Окислительное число серы в молекуле серной кислоты равно 6. По формуле эквивалентная масса серы равна M/B = 32/6 = 5,33 г/моль.
-
ОКСИДА. Определим эквивалентную массу оксида серы. Окислительное число серы в молекуле оксида серы равно 4. По формуле эквивалентная масса серы рана М/В=32/4=8г/моль. Эквивалентная масса оксида по формуле равна ЭS+ЭO=8+8=16г/моль.
-
ОСНОВАНИЯ. Определим эквивалентную массу молекулы оксида алюминия. По формуле ЭAl(OH)3=78/3=26г/моль.
-
СОЛИ. Определим эквивалентную массу молекулы хлорида алюминия. В молекуле AlCl3 число атомов металла равно 1, а валентность равна 3. По формуле ЭAlCl3=133,5/(1*3)=44,5г/моль.
-
КИСЛОТЫ. Определим эквивалентную массу молекулы серной кислоты. Серная кислота двуосновная. По формуле эквивалентная масса серной кислоты равна М/(чз Н)=98/2=49г/моль.
-
ОКИСЛИТЕЛЯ.
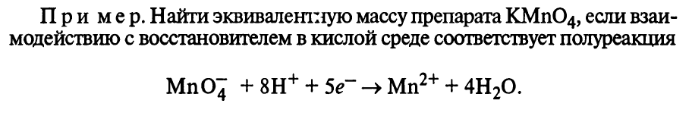

-
ВОССТАНОВИТЕЛЯ. Найти эквивалентную массу Zn для данной реакции:
Zn + CuSO4 = ZnSO4 + Cu
Zn -2e → Zn2+-восстановитель
Cu2+ + 2e → Cu-окислитель
ЭZn=M/z=65/2=33
ВОПРОС 3.

ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ.
Количество теплоты, переданное системе, идет на изменение внутренней энергии системы и на совершаемую системой работу против внешних сил.
Q = ΔU + W (4.4)
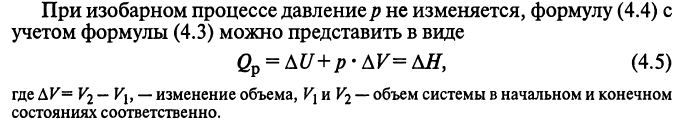

ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ.
Характеризует направленность реальных, необратимых процессов теплообмена: Невозможен процесс, единственным результатом которого является передача энергии в форме теплоты от тела менее нагретого к телу более нагретому.


ТРЕТИЙ ЗАКОН ТЕРМОДИНАМИКИ.
В конденсированных системах при абсолютном нуле и вблизи него процесс протекает без изменения энтропии.
ВОПРОС 4.
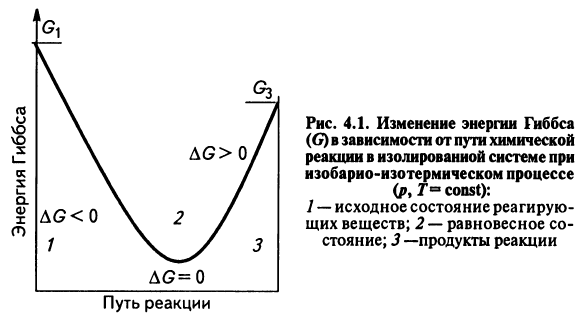
Энергия Гиббса. Направленность самопроизвольных химических реакций.
Энергия Гиббса - это величина, показывающая изменение энергии в ходе химической реакции и дающая таким образом ответ на принципиальную возможность химической реакции.
![]()



ВОПРОС 5.
Термохимический закон Гесса. Тепловой эффект реакции.
Закон Гесса: тепловой эффект химической реакции не зависит от пути реакции, а зависит только от вида и начального и конечного состояния веществ.

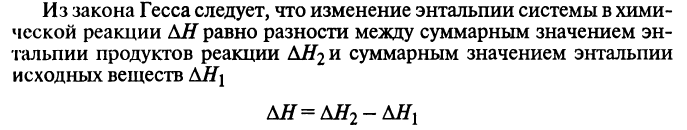
![]()
Тепловой эфффект реакции.


![]()

ВОПРОС 6.
Скорость химической реакции. Закон действия масс.
Скорость химической реакции – это изменение концентрации исходного или образовавшегося в реакции вещества в единицу времени.

Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ.

ВОПРОС 7.
Зависимость скорости химической реакции от температуры. Температурный коэффициент. Закон Вант-Гоффа. Теория активации.
Закон Вант-Гоффа: при повышении температуры на каждые 10 К скорость химической реакции возрастает в 2-4 раза.
![]()
![]()
Уравнение Аррениуса:
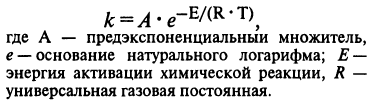

ВОПРОС 8.
Явление катализа. Катализаторы, принцип действия. Теория переходного состояния и образования активированных комплексов. Биокатализаторы.




ВОПРОС 9.
Химическое равновесие с точки зрения термодинамики. Константа равновесия.



ВОПРОС 10.
Смещение химического равновесия. Принцип Ле Шателье.

ВОПРОС 11.
Агрегатные состояния. Растворы: понятие, теория. Растворы насыщенные, ненасыщенные, пересыщенные.
Состояние одного и того же вещества, переходы между которыми сопровождаются скачкообразными изменениями объема и физических свойств вещества, называются агрегатными. Вещества могут существовать в твердом, жидком и газообразном состоянии. Переходы вещества из одного состояния в другое обусловлены изменением характера теплового движения частиц и их взаимодействия. Газом называют состояние вещества, из которого без понижения температуры не может быть получено твердое или жидкое состояния. Переход вещества из жидкого состояния в газообразное при температурах ниже критической называется парообразованием. Пар можно получить также сублимацией твердого вещества. Обратные процессы перехода пара в жидкое и твердое состояние называется конденсацией. В основе изучения газообразного состояния лежит понятие об идеальном газе. К состоянию идеального газа приближаются газы при низких давлениях, когда расстояния между молекулами настолько велики, что можно принебречь силами притяжения между ними. Уравнение Менделеева-Клапейрона pV=n*RT
Перход твердого вещества в жидкое называется плавлением. Обратный процесс –кристаллизацией. Температура, при которой существуют три фазы вещества называется тройной точкой.



ПОНЯТИЕ О РАСТВОРАХ

В гомогенных системах частицы растворенного вещества раздроблены до молекулярных размеров. Такие системы называются истинными растворами и просто растворами и являются весьма устойчивыми. В истинных растворах


ВОПРОС 12.
Способы выражения состава растворов.



ВОПРОС 13.
Осмос. Закон Вант-Гоффа. Роль осмоса в биологических явлениях.




Закон Вант-Гоффа:

Осмос играет важную роль во многих биологических процессах. Мембрана, окружающая нормальную клетку крови, проницаема лишь для молекул воды, кислорода, некоторых из растворенных в крови питательных веществ и продуктов клеточной жизнедеятельности; для больших белковых молекул, находящихся в растворенном состоянии внутри клетки, она непроницаема. Поэтому белки, столь важные для биологических процессов, остаются внутри клетки.
ВОПРОС 14.
Давление пара растворителя над раствором. Закон Рауля.
Если стакан закрыт крышкой, то над поверхностью воды образуется насыщенный пар. Его давление – это давление насыщенного пара над чистым растворителем.
Закон Рауля.
При
постоянной температуре относительное
понижение давления насыщенного пара
растворителя над раствором равно
молярной доле растворенного вещества
N.
![]()
ВОПРОС 15.
Кипение и замерзание растворов неэлектролитов.
Раствор кипит при более высокой температуре, чем растворитель. Увеличение концентрации ведет к дополнительному уменьшению давления насыщенного пара и к соответственному повышению температуры кипения раствора при атмосферном давлении.
Раствор замерзает при более низкой температуре, чем растворитель. При температуре замерзания (кристаллизации) жидкость находится в равновесии с твердой фазой.

Первое следствие закона Рауля: повышение температуры кипения раствора (Δtк) прямо пропорционально концентрации вещества в растворе:

Второе следствие закона Рауля: понижение температуры замерзания раствора (Δtз) прямо пропорционально концентрации раствора:
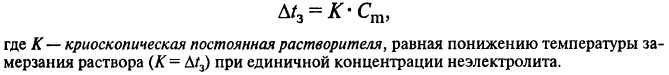

ВОПРОС 16.
Отклонение поведения растворов электролитов и неэлектролитов. Изотонический коэффициент.
Электролитами называются вещества, растворы и расплавы которых проводят электрический ток. Причины прохождения электрического тока в растворах и расплавах связаны с наличием в них ионов.
Распад молекул растворенного вещества на ионы приводит к увеличению общего числа частиц в растворе электролита, что обусловливает существенное различие между свойствами растворов электролитов и неэлектролитов. В математических выражениях эксперементальных законов Вант-Гоффа и Рауля, связывающих свойства идеальных растворов с концентраций растворенного вещества, особенности растворов элеткролитов учитываются сомножителем i, который называется изотоническим коэффициентом Вант-Гоффа.

ВОПРОС 17.
Слабые электролиты. Степень диссоциации. Константа диссоциации.


ВОПРОС 18.
Зависимость степени диссоциации слабого электролита от концентрации раствора. Закон разбавления Оствальда.

ВОПРОС 19.
Равновесие в растворах слабых электролитов. Влияние одноименного и связывающего ионов.


ВОПРОС 20.
Амфотерные гидроксиды с точки зрения теории электролитической диссоциации.

