
Pervye_20_voprosov_2_razdela
.docxII. Химия неорганических соединений, биологическая роль, применение в ветеринарии.
-
Общая характеристика подгруппы галогенов.


2. Способы получения галогенов. Применение.
В лаборатории:
-
Получение хлора. Хлор получают действием соляной кислоты на окислители: MnO2, KMnO4, PbO2, K2Cr2O7 и другие:
16HCl + 2KMnO4 = 5Cl2 + 2MnCl2 + 2KCl + 8H2O.
-
Бром и йод получают действием окислителя на бромиды или йодиды в кислой среде:
MnO2 + 2KBr + 2H2SO4 = Br2 + MnSO4 + K2SO4 + 2H2O;
2NaNO2 + 2NaI + 2H2SO4 = I2 + 2NO + 2NaHSO4 + 2H2O.
В промышленности:
-
Важнейший способ получения фтора – электролиз расплавов фторидов. В качестве основного источника используется гидрофторид калия KHF2, фтор выделяется на аноде.
-
Хлор в промышленности получают электролизом раствора хлорида натрия. Газообразный хлор выделяется на аноде:
2NaCl + 2H2O = 2NaOH + H2 + Cl2.
-
Для получения брома используют реакцию его замещения в бромидах:
2KBr + Cl2 = 2KCl + Br2.
-
Основные источники получения йода – морские водоросли и нефтяные буровые воды:
2NaI + MnO2 + 3H2SO4 = I2 + 2NaHSO4 + MnSO4 + 2H2O.
Применение: галогены используются в химической промышленности, для очистки воды и отходов, в производстве пластмасс, фармацевтических препаратов, целлюлозы и бумаги, тканей, смазочных материалов. Бром, хлор, фтор и йод служат химическими промежуточными звеньями, отбеливающими и дезинфицирующими средствами. Бром и хлор применяются в текстильной промышленности для отбеливания и предотвращения усадки шерсти. Бром также используется в процессах экстракции золота и при бурении нефтяных и газовых скважин. Он применяется как антипирен в производстве пластмасс и как промежуточное звено в производстве гидравлических жидкостей, хладагентов, влагопоглотителей и средств для завивки волос. Бром входит в состав боевых отравляющих газов и огнегасящих жидкостей.
3. Водородные соединения галогенов. Свойства, применение.







HF + H2SO4 ≠ реакция не идёт
HCl + H2SO4 ≠ реакция не идёт
2HBr + H2SO4 = Br2 + SO2 + 2H2O
8HI + H2SO4 = 4I2 + H2S + 4H2O
Йодоводород является сильным восстановителем и используется как восстановитель во многих органических синтезах. При стоянии, раствор HI вследствие постепенного окисления HI кислородом воздуха и выделения йода, принимает бурую окраску:
4HI + O2 → 2H2O + 2I2
Растворы галогенов — сильные кислоты, в которых ион H+ выступает в качестве окислителя. Галогеноводородные кислоты реагируют с металлами, потенциал которых < 0, но так как ионы I−(в меньшей степени Br−) хорошие комплекообразователи, HI может реагировать даже с серебром (+0,8).
2Ag + 4HI = 2H[AgI2] + H2
4. Хлорная вода. Получение, свойства, применение.
Получение:
![]()
Химические
свойства:
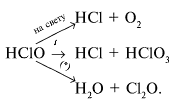
Применение: Используется для обеззараживания воды в бассейнах способом хлорирования, очень слабый раствор хлора в питьевой воде обеспечивает ее обеззараживания без нанесения большого ущерба здоровью.
5. Хлорная известь. Получение, свойства, применение.
Получение:
![]()
Получают взаимодействием хлора с гашеной известью (гидроксидом кальция).
Химические свойства:
На воздухе хлорная известь медленно разлагается по схеме:
![]() .
.
![]() , термическое
разложение
, термическое
разложение
![]()
![]()
Применение: Широко используется для отбеливания и дезинфекции.
6. Кислородсодержащие кислоты галогенов. Изменение их силы и окислительной способности. Соли кислородсодержащих кислот. Применение.
7. Общая характеристика подгруппы кислорода.
Подгруппа кислорода, или халькогенов – 6-я группа периодической системы Д.И. Менделлева.

Сверху вниз, с нарастанием внешнего энергетического уровня закономерно изменяются физические и химические свойства халькогенов: радиус атома элементов увеличивается, энергия ионизации и сродства к электрону, а также электроотрицательность уменьшаются; уменьшаются неметаллические свойства, металлические увеличиваются (кислород, сера, селен, теллур – неметаллы), у полония имеется металлический блеск и электропроводимость. Водородные соединения халькогенов соответствуют формуле: H2R: H2О, H2S, H2Sе, H2Те – хальководороды.
8. Вода. Физические и химические свойства. Вода как растворитель. Биологическая роль воды.
Физические свойства: вода – бесцветная жидкость, без вкуса и запаха, плотность – 1 г/см3; температура замерзания – 0 °C (лед), кипения – 100 °C (пар). При 100 °C и нормальном давлении водородные связи рвутся и вода переходит в газообразное состояние – пар. У воды плохая тепло-и электропроводность, но хорошая растворимость.
Химические свойства: вода незначительно диссоциирует:
![]()
В присутствии воды идет гидролиз солей – разложение их водой с образованием слабого электролита:
![]()
Взаимодействует со многими основными оксидами, металлами:
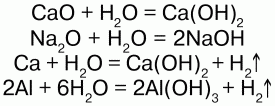
С кислотными оксидами:
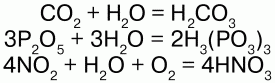
Вода - превосходный растворитель для полярных веществ. К ним относятся ионные соединения, такие как соли, у которых заряженные частицы (ионы) диссоцииируют в воде, когда вещество растворяется, а также некоторые неионные соединения, например сахара и простые спирты, в молекуле которых присутствуют заряженные (полярные) группы (-OH).
Биологическая роль воды:
Вода играет уникальную роль как вещество, определяющее возможность существования и саму жизнь всех существ на Земле. Она выполняет роль универсального растворителя, в котором происходят основные биохимические процессы живых организмов. Уникальность воды состоит в том, что она достаточно хорошо растворяет как органические, так и неорганические вещества, обеспечивая высокую скорость протекания химических реакций и в то же время — достаточную сложность образующихся комплексных соединений. Благодаря водородной связи, вода остаётся жидкой в широком диапазоне температур, причём именно в том, который широко представлен на планете Земля в настоящее время.












9. Сероводород, получение и свойства. Сероводородная кислота. 1-я и 2-я константы диссоциации. Роль в окислительно-восстановительных процессах. Соли сероводородной кислоты.
Получение: 1) прямой синтез из элементов, при температуре 600 °C; 2) воздействием на сульфиды натрия и железа соляной кислотой.
![]()


10. Серная кислота. Роль в окислительно-восстановительных процессах. Соли серной кислоты. Применение.

Оксид SO2 и серная кислота проявляют только окислительные свойства, что обусловлено высшей степенью окисления серы (+6)


11. Соединения серы в степени окисления +4. Роль в окислительно-восстановительных процессах (примеры). Применение.



12. Общая характеристика подгруппы азота.

Могут проявлять в соединениях степени окисления от −3 до +5.
13. Аммиак. Получение, химические свойства, применение.

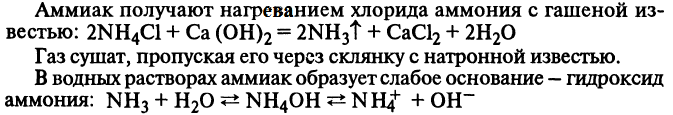

14. Азотная кислота. Химические свойства. Взаимодействие с металлами. Нитраты. Обнаружение.



![]()
![]()

![]()

![]()
![]()
![]()

![]()
![]()
Обнаружение:
В колбу, соединенную с холодильником, конец которого опускают в колбу с водой, помещают исследуемую жидкость и медные опилки. Колбу нагревают на бане с минеральным маслом или на песчаной бане и жидкость выпаривают почти досуха. При достаточной концентрации азотной кислоты происходит восстановление ее медью в окись азота, которая с кислородом воздуха образует двуокись азота (оранжевые пары). Последняя, растворяясь в воде, дает азотную и азотистую кислоты, которые и обнаруживаются химическими реакциями:
3Сu + 2HNO3 = ЗСuО + 2NO + Н2O
3СuО + 6HNO3 = 3Cu(NO3)2 + 3H2O
2NO + O2 = 2NO2; 2NO2 + H2O = HNO2 + HNO3
15. Азотистая кислота и ее соли. Роль в окислительно-восстановительных процессах. Применение.
- HNO2. Соли азотистой кислоты (нитриты) получают восстановлением нитратов:
NaNO2+HCI = NaCI+HNO2.
-Азотистая кислота проявляет как окислительные, так и восстановительные свойства. При действии более сильных окислителей (Н2О2, KMnO4) окисляется в HNO3:
2HNO2 + 2HI → 2NO↑ + I2↓ + 2H2O;
5HNO2 + 2HMnO4 → 2Mn(NO3)2 + HNO3 + 3H2O;
HNO2 + Cl2 + H2O → HNO3 + 2HCl.



![]()
![]()
![]()

![]()


![]()
![]()

![]()
![]()
16. Биологическая роль азота и фосфора. Применение.

- Азот входит в состав хлорофилла, гемоглобина и др.
![]()
Фосфор присутствует в живых клетках в виде орто- и пирофосфорной кислот, входит в состав нуклеотидов, нуклеиновых кислот, фосфопротеидов, фосфолипидов, коферментов, ферментов. Кости человека состоят из гидроксилапатита 3Са3(РО4)3·Ca(OH)2. В состав зубной эмали входит фторапатит.
17. Мышьяк и его соединения. Обнаружение. Влияние на живой организм. Применение.




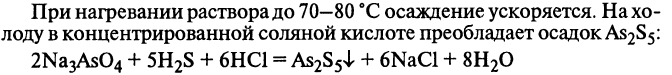


Из неорганических соединений мышьяка мышьяковистый ангидрид может применяться в медицине для приготовления пилюль и в зубоврачебной практике в виде пасты как некротизирующее лекарственное средство.
18. Общая характеристика элементов подгруппы углерода. Влияние на живой организм.
Применение.

- Круговорот углерода в природе включает биологический цикл, выделение СО2(=> фотосинтез).
Соединения кремния относительно нетоксичны. Но очень опасно вдыхание высокодисперсных частиц как силикатов, так и диоксида кремния, попадая в лёгкие, кристаллизующихся в них, а возникающие кристаллики разрушают лёгочную ткань и вызывают тяжёлую болезнь — силикоз.
Малые количества германия не оказывают физиологического действия на растения, но токсичны в больших количествах. Германий нетоксичен для плесневых грибков.
Олово входит в состав желудочного фермента гастрина.
Свинец и его соединения токсичны. Попадая в организм, свинец накапливается в костях, вызывая их разрушение.
Широкого применения в медицине свинец не получил из-за своей высокой токсичности. Используется только Pb(CH3COO)2·3H2O, или свинцовая вода, для примочек от ссадин
В настоящее время олово в медицине не используется.
19. Кислородсодержащие соединения углерода. Цианиды.



![]()

20. Кремний¸ строение атома. Важнейшие соединения, их свойства, применение.
-Si +14 )2 )8 )4.



