
- •ЛЕКЦИЯ 3. ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
- •Термодинамика – это раздел физики, занимающийся изучением общих свойств вещества, связанных с тепловым
- •Температурой называется физическая величина, определяющая «степень нагретости» тел и характеризующая состояние термодинамического равновесия
- •В физике наиболее часто используется
- •Температура по шкале Цельсия t С связана с термодинамической температурой T соотношением,
- •Температура,
- •ЛЕКЦИЯ 3. ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
- •Равновесным состоянием термодинамической системы называется состояние, при котором все параметры, характеризующие систему, определены
- •Термодинамическим процессом называется изменение хотя бы одного из параметров состояния термодинамической системы.
- •Состояния
- •ЛЕКЦИЯ 3. ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
- •При бесконечном малом изменении объема термодинамической системы на величину dV совершается элементарная работа
- •Работа численно равна площади на pV- диаграмме состояний, ограниченной осью V, вертикальными линиями,
- •Важной физической величиной, характеризующей равновесное состояние термодинамической системы, является внутренняя энергия U –
- •Внутренняя энергия определена с точностью до произвольной постоянной. Поскольку в термодинамических системах внутримолекулярная
- •Внутренняя энергия смеси идеальных газов находится по формуле
- •При приведении в соприкосновение двух термодинамических систем их внутренняя энергия изменяется. Такой процесс
- •Циклическим (круговым) процессом называется процесс, в результате которого термодинамическая система возвращается в исходное
- •ЛЕКЦИЯ 3. ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
- •Первое начало термодинамики представляет собой закон сохранения энергии для тепловых процессов и устанавливает
- •В дифференциальной форме первое начало термодинамики имеет следующий вид:
- •Бесконечно малые величины (не приращения!) A и Q представляют
- •Применительно к вечному двигателю первое начало термодинамики формулируется так: вечный двигатель первого рода
- •ЛЕКЦИЯ 3. ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
- •Теплоемкостью тела Стела называется количество теплоты, которое нужно сообщить телу, чтобы повысить его
- •Удельной теплоемкостью с называется теплоемкость единицы массы вещества (количество теплоты, которое нужно сообщить
- •Найдем количество теплоты Q, которое нужно сообщить телу массы m для того, чтобы
- •Наибольший интерес представляют теплоемкости процессов, в которых объем или давления являются постоянными (V
- •Молярная теплоемкость газа при постоянном давлении
- •Таким образом, получаем уравнение Майера, из которого определим физический смысл универсальной газовой постоянной:
- •Молярные теплоемкости CV и Cp идеального газа выражаются через число степеней свободы молекул
- •ЛЕКЦИЯ 3. ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
- •Работа идеального газа при изохорном процессе равна нулю (поскольку объем газа не изменяется):
- •Работа идеального газа при изобарном процессе:
- •Работа идеального газа при изотермическом процессе:
- •ЛЕКЦИЯ 3. ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
- •Получим уравнение адиабатического процесса, рассмотрев уравнение Менделеева – Клапейрона и уравнение первого начала
- •Выражая из уравнения Менделеева – Клапейрона давление p, получим уравнение адиабаты в переменных
- •Для вычисления работы, совершаемой идеальным газом в адиабатическом процессе, используем уравнение первого начал
- •ЛЕКЦИЯ 3. ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
- •Найдем теплоемкость при политропическом процессе. Согласно определению теплоемкости
- •Найдем выражение для работы газа при политропическом процессе. Из уравнения политропы найдем:

Молярная теплоемкость газа при постоянном давлении
|
Qмол |
CV dT pdV |
dV |
||||
Cp |
|
|
|
dT |
|
CV p |
|
|
|||||||
|
dT p |
|
p |
dT p |
|||
Разность теплоемкостей: |
|
|
|
|
|||
|
|
|
|
dV |
|
|
|
|
|
Cp CV p |
|
|
|
||
|
|
|
|
dT p |
|
|
|
Из уравнения состояния идеального газа получим:
dV |
|
R |
||
pdV RdT при p const |
|
|
|
|
p |
||||
dT p |
|
|||
31

Таким образом, получаем уравнение Майера, из которого определим физический смысл универсальной газовой постоянной:
Cp CV R
Универсальная газовая постоянная R численно равна работе, совершаемой одним молем идеального газа при повышении его температуры на один кельвин при постоянном давлении.
dV |
|
Ap |
||
Cp CV R p |
|
|
|
|
dT |
||||
dT p |
|
|||
32

Молярные теплоемкости CV и Cp идеального газа выражаются через число степеней свободы молекул i:
CV 2i R; Сp CV R i 22 R
Отношение теплоемкостей
Cp i 2
CV i
является характерной для каждого идеального газа величиной и называется показателем адиабаты.
33

CV R1; Cp R1
U C T RT |
|
pV |
|
|
|
||||
V |
1 |
|
1 |
|
|
|
|||
34

ЛЕКЦИЯ 3. ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
35
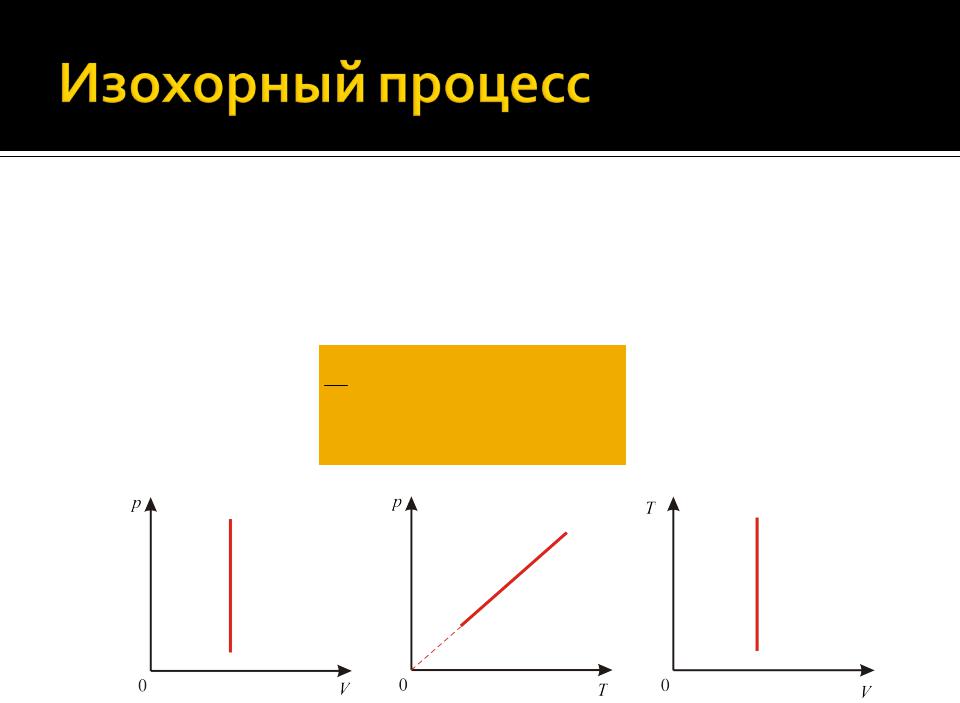
Изохорным называется процесс, происходящий при постоянном объеме (V = сonst)
Уравнение изохорного процесса имеет вид
Tp const
(V const и m const)
36

Работа идеального газа при изохорном процессе равна нулю (поскольку объем газа не изменяется):
( A)V ( pdV )V 0,
(A12 )V A 0
Уравнение первого начала термодинамики для изохорного процесса имеет вид:
|
Q U , |
|
Т.е. все сообщаемое газу |
Q dU |
увеличение его внутренней |
|
энергии.
Теплоемкость при изохорном процессе:
CV iR 2
2
37
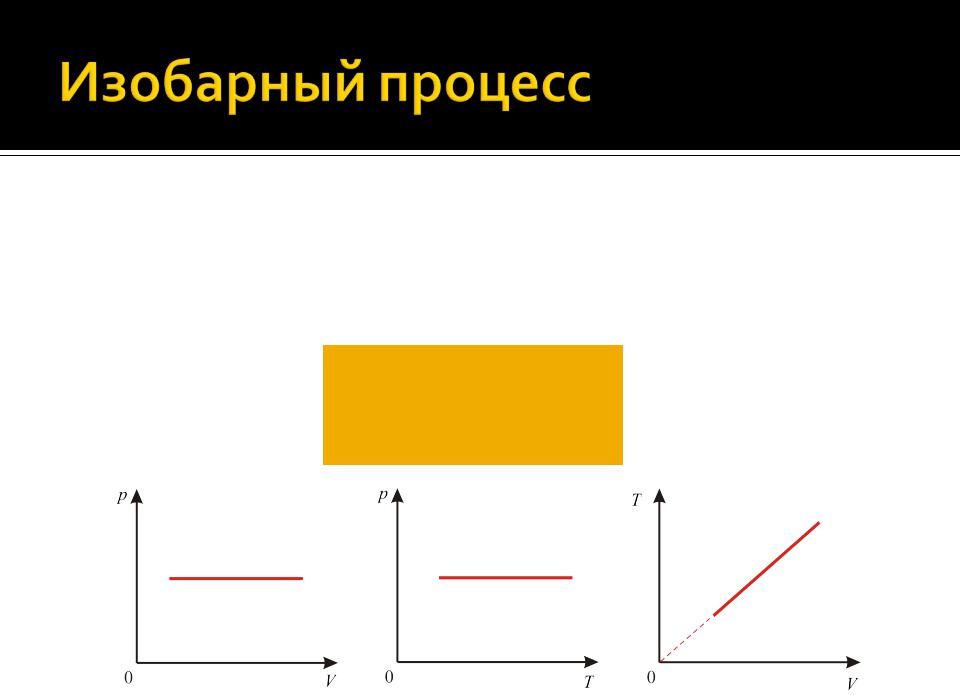
Изобарным называется процесс, происходящий при постоянном давлении (p= сonst)
Уравнение изобарного процесса имеет вид
VT const
( p const и m const)
38

Работа идеального газа при изобарном процессе:
V2 |
V2 |
(A12 ) p pdV p dV p(V2 V1) p V |
|
V1 |
V1 |
Уравнение первого начала термодинамики для изобарного процесса сохраняет свой вид:
Q U A
Q dU A
Теплоемкость при изохорном процессе:
C |
p |
C |
R i 2 R |
|
|
V |
2 |
|
|
|
|
|
39 |
|
|
|
|
|
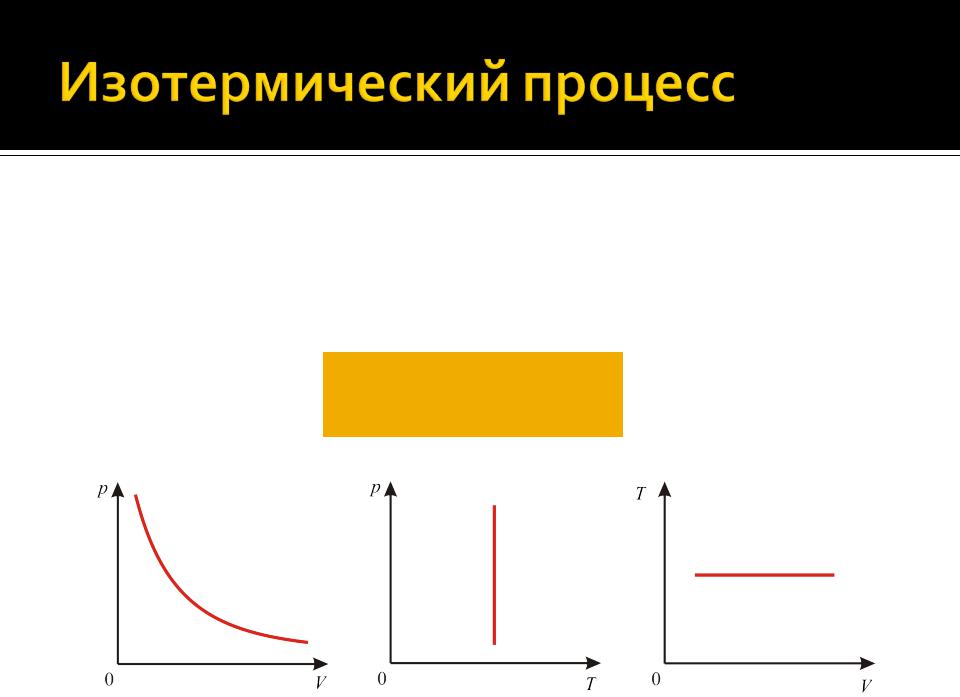
Изотермическим называется процесс, происходящий при постоянной температуре (T= сonst)
Уравнение изобарного процесса имеет вид
pV const
(T const и m const)
40
