
- •Курс лекций
- •Основные понятия Определение и классификация коррозии
- •Пассивность металлов
- •Химическая коррозия металлов
- •Характеристика коррозионных процессов
- •Факторы, влияющие на коррозию
- •Методы определения противокоррозионных свойств покрытий
- •Общие сведения о полимерах
- •Особенности свойств полимерных материалов
- •Растворы высокомолекулярных соединений
- •Свойства и выбор растворителей
- •Пластификация полимеров
- •Процессы пленкообразования
- •Процессы старения и деструкции полимеров
- •Неорганические пигменты
- •Классификация пигментов
- •Свойства поверхности пигментов.
- •Регулирование свойств поверхности пигментов.
- •Атмосферная и коррозионная стойкость
- •Общие сведения о наполнителях
- •Общие сведения об органических пигментах
- •Классификация лакокрасочных материалов
- •1. Условные обозначения групп лакокрасочных материалов
- •2. Условные обозначения групп лакокрасочных материалов по назначению
- •Классификация лакокрасочных покрытия
- •I. Классификация покрытий по внешнему виду
- •Системы покрытий
- •Системы покрытий для изделий из черных металлов
- •Определение декоративных свойств покрытий
- •Склеивание металлов и неметаллических материалов конструкционными клеями склеивание металлов
- •Основные операции технологического процесса склеивания металлов
- •Влияние способа обработки поверхности дуралюмина на прочность при сдвиге клеевых соединений на клеях бф-2 и пу-2
- •Влияние способа обработки поверхности дуралюмина на прочность при сдвиге клеевых соединений
- •Влияние способа обработки поверхности алюминиевого сплава д16т на прочность при сдвиге клеевых соединений на клее вк-24
- •Влияние способа обработки поверхности алюминиевого сплава д16т на прочность при неравномерном отрыве клеевых соединений на клее вк-24
- •Влияние адгезионных грунтов на свойства клеевых соединений алюминиевого сплава д16 на клеях вк-24 и вк-31
- •Соединений дуралюмина и стали на клеях вк-13 и бф-2
- •Сотовые клееные конструкции
- •Слоистые клееные конструкции
- •Клеесварные соединения
- •Жесткости из дуралюмина
- •Дефекты склеивания
- •Склеивание неметаллических материалов
- •Склеивание древесины
- •Без нагревания
- •Контактными нагревателями при склеивании древесных деталей фенолоформальдегидными клеями (температура в клеевом соединении 50—60 °с)
- •Склеивание пластмасс
- •Склеивание пластмасс на основе термореактивных полимеров
- •Склеивание пластмасс на основе термопластичных полимеров
- •Пленки с металлами и неметаллическими материалами, выполненных клеем на основе каучука скт
- •Склеивание композиционных материалов
- •Склеивание пластмасс и других неметаллических материалов с металлами
- •Склеивание силикатного стекла, керамики, фарфора, асбеста, стекловолокнистых, теплоизоляционных и других неметаллических материалов
- •Склеивание резин
- •Методы испытания механической прочности
- •Методы неразрушающего контроля качества клеевых соединений
Факторы, влияющие на коррозию
Коррозия, как любой физико-химический процесс, подвержена влиянию многих факторов — и внешних, и внутренних. К ним относятся: природа металла, его структура, состояние поверхности, температура, давление, скорость движения и рН среды и др.
Металлы разных групп периодической системы элементов Д. И. Менделеева ведут себя по-разному. Самыми неустойчивыми в коррозионном отношении являются металлы главной подгруппы I и II групп — щелочные и щелочноземельные. Металлы побочной подгруппы I группы (Ag, Au) и VIII группы (Os, Ir, Pt) представляют противоположный полюс, это наиболее коррозионностойкие металлы. Металлы других групп занимают промежуточное положение между ними. Большинство из них, в том числе такие технически (важные металлы, как А1, Сг, Fe, Co, Ni, способны пассивироваться и тем самым оказывать заметное сопротивление воздействию различных сред. На рис. показано поведение различных металлов в растворах в зависимости от их рН (от 0 до 14). Отчетливо выделяются 5 групп в отношении коррозионной стойкости.
Коррозионная стойкость металлов возрастает при легировании — введении в их состав элементов, обеспечивающих повышение термодинамической устойчивости, или образование на поверхности защитной (оксидной) пленки. Примером может служить легирование железа с помощью Ni, Cr, Ti, Mo и других металлов.
Тщательная обработка поверхности, например шлифование или полирование, повышает стойкость против коррозии, особенно в атмосферных условиях. Коррозионная стойкость металлов,

Рис. 5.9,5 Зависимость скорости коррозии от рН среды


Рис. 5.9,6.Зависимость скорости коррозии стали от температуры (а) и скорости движения воды (б):
1 — закрытая система; 2 — открытая система
находящихся под нагрузкой, меньше чем ненапряженных. С повышением температуры сопротивление металлов коррозии, как правило, уменьшается, однако возможна и экстремальная зависимость (рис. 5.9,а), когда коррозия протекает с кислородной деполяризацией. Неоднозначный характер имеет и зависимость скорости коррозии от интенсивности перемешивания раствора. В электролитах, исключающих образование пассивного состояния металла (например, в морской воде), скорость коррозии с повышением интенсивности движения воды возрастает. В случае пассивации металла после ускорения возможно торможение коррозионного процесса, однако при очень больших скоростях {обычно более 20 м/с) кривая коррозии снова идет вверх, наблюдается коррозионно-эрозионный износ (рис. 5.9,6).
А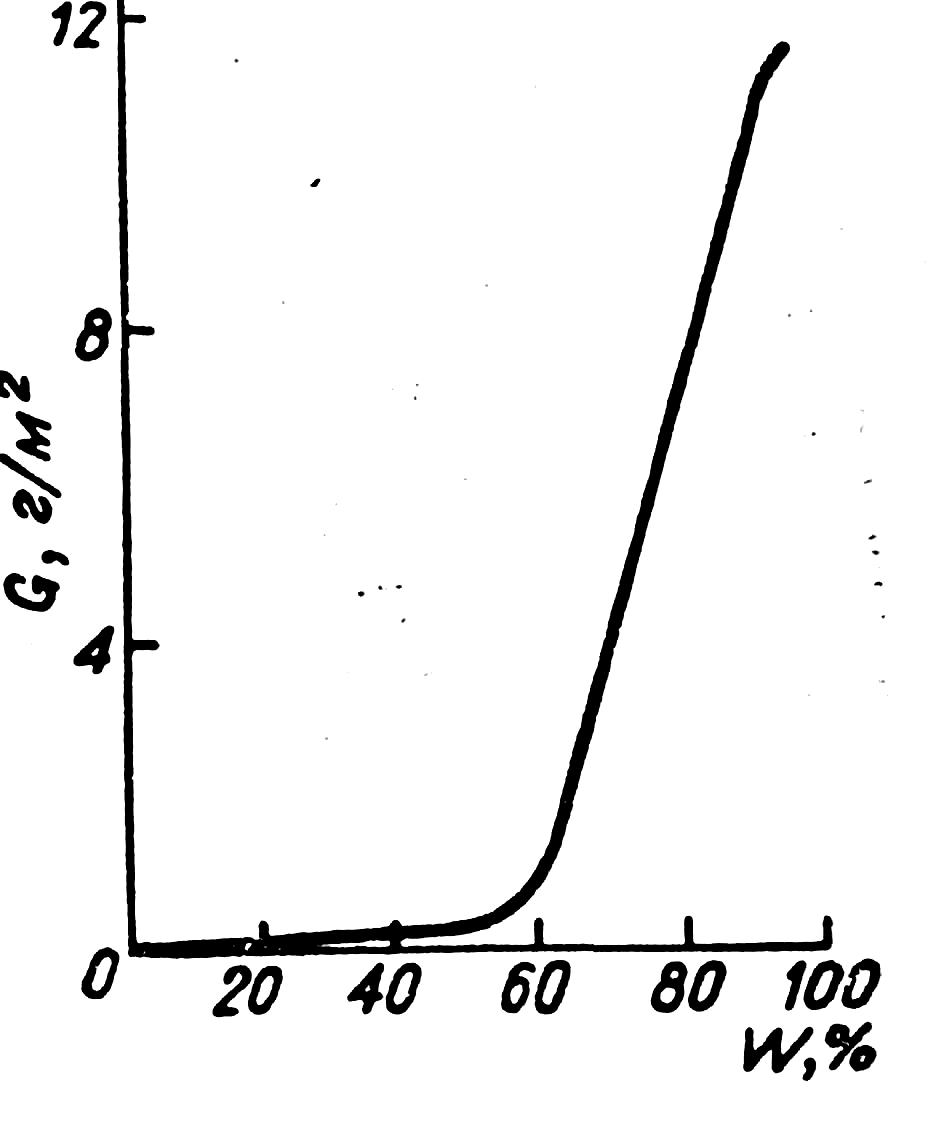 тмосферная
коррозия —
наиболее распространенный вид разрушения
металлов. Примерно 80% металлических
конструкций (строительные сооружения,
машины, транспортные средства)
эксплуатируются на открытом воздухе.
Коррозия в атмосферных условиях
обусловливается воздействием воды,
адсорбирующейся из воздуха, и кислорода,
беспрепятственно проникающего в
адсорбционный слой. Электрическое
сопротивление слоя воды и соответственно
скорость коррозионного процесса
непосредственно связаны с его толщиной,
которая является функцией влажности
окружающего воздуха. Таким образом,
скорость коррозии оказывается тем
больше, чем выше влажность. Особенно
быстро коррозия развивается при влажности
атмосферного воздуха 'более 60% (рис.).
тмосферная
коррозия —
наиболее распространенный вид разрушения
металлов. Примерно 80% металлических
конструкций (строительные сооружения,
машины, транспортные средства)
эксплуатируются на открытом воздухе.
Коррозия в атмосферных условиях
обусловливается воздействием воды,
адсорбирующейся из воздуха, и кислорода,
беспрепятственно проникающего в
адсорбционный слой. Электрическое
сопротивление слоя воды и соответственно
скорость коррозионного процесса
непосредственно связаны с его толщиной,
которая является функцией влажности
окружающего воздуха. Таким образом,
скорость коррозии оказывается тем
больше, чем выше влажность. Особенно
быстро коррозия развивается при влажности
атмосферного воздуха 'более 60% (рис.).
Рис. Зависимость коррозии стали от влажности
воздуха, содержащего 0,01% SO2
Ниже приведены значения скорости коррозии железа (в мкм/год) для различных климатических районов страны (сельская местность):
-
Ленинградская область
43
Московская область
28
Сибирь
13—20
Средняя Азия
9—10
Коррозия усугубляется присутствием в воздухе примесей агрессивных газов и механических загрязнений. Если принять скорость коррозии в атмосфере чистого сухого воздуха (континентальный климат) за единицу, то в сильно загрязненной атмосфере индустриальных районов она достигает 100.
Об относительном поведении различных металлов в атмосфере города можно судить по следующим данным:
Металл Pb Al Cu Ni Zn Fe
Скорость коррозии, 4 8 12 32 50 200
мкм/год
Уменьшая влажность контактирующего с металлом воздуха (осушая его) и применяя различные способы изоляции и пассивации поверхности, можно значительно уменьшить неблагоприятное воздействие атмосферы на металлы и уменьшить вред, причиняемый коррозией.
Подземная коррозия вызывается действием грунтовых вод и растворенных в них солей и газов, а также действием блуждающих токов. Она протекает с кислородной деполяризацией и лимитируется доступом кислорода к металлу. В наибольшей степени подземной коррозии подвержены металлические трубопроводы, кабельные сети, подземные хранилища, тюбинги метро, сваи и другие конструкции, соприкасающиеся с почвой или грунтом. Вред, который причиняет подземная коррозия, достаточно велик: ежегодно в нашей стране выходит из строя 2—3% подземных сооружений, что в пересчете на металл составляет около 1 млн. т. Поэтому защита металла, эксплуатируемого в этих условиях, крайне необходима. Существующие способы борьбы с подземной коррозией сводятся к применению различных изолирующих покрытий и электрохимической защиты.
Морская коррозия, аналогично почвенной, протекает как электрохимический процесс с кислородной деполяризацией. Вода различных морских водоемов содержит от 1 до 3,8% легкодиссоциирующих солей и поэтому обладает высокой электрической проводимостью. Морская вода, кроме того, хорошо аэрирована и содержит до 0,04 г/л кислорода. Это делает ее достаточно активной в коррозионном отношении. Разрушение металлов нередко усугубляется влиянием механического и биологического факторов (эрозия и кавитация, обрастание 'конструкций морскими растительными и животными организмами). Особенно усиливается коррозия кор'пусов судов вблизи ватерлинии в связи с легким доступом кислорода к металлу и ухудшением условий для образования и сохранения защитных пленок из продуктов коррозии. На скорость коррозии в морской воде сильное влияние оказывает окалина: создавая катодные участки, она может в десятки раз увеличивать обычную для морских условий скорость коррозии.
Основным средством защиты конструкций в морской воде, а также от воздействия брызг и морского тумана является применение лакокрасочных покрытий. Не случайно при окраске строящихся судов потребляется свыше 4,5 кг лакокрасочных материалов на 1 т грузоподъемности. В морской воде также эффективно используется протекторная защита.
Коррозия в сильноагрессивных средах — растворах неорганических и органических кислот, солей, щелочей, атмосфере влажных агрессивных газов и паров (оксиды азота и серы, галогены, галогенводороды и др.) — наиболее часто встречается при эксплуатации химического оборудования, вытяжных шкафов, а также емкостей, трубопроводов, насосов и вентиляторов, используемых для хранения и транспортирования указанных веществ. Коррозия в этих средах протекает большей частью с водородной деполяризацией и высокой скоростью. Бороться с этим видом коррозии особенно затруднительно. Применяемые способы сводятся к понижению активности среды и надежной изоляции поверхности материалами, более стойкими в химическом отношении, чем защищаемый металл.
СПОСОБЫ ЗАЩИТЫ МЕТАЛЛОВ ОТ КОРРОЗИИ
Классификация и характеристика способов защиты
Существующие способы борьбы с коррозией металлов весьма разнообразны. По принципу воздействия на коррозионный процесс различают следующие группы защитных мероприятий:
1) изоляция поверхности металла от коррозионноактивной среды;
2) дезактивирующая обработка среды с целью уменьшения ее активности;
3) поддержание металла в термодинамически неактивном состоянии.
По механизму защитного действия применяемые мероприятия сводятся к трем группам:
1) повышение анодного контроля коррозионной системы — легирование сплавов пассивирующими компонентами, введение в раствор анодных ингибиторов коррозии, применение анодной электрохимической защиты;
2) повышение катодного контроля — уменьшение содержания катодных компонентов в металле, снижение концентрации деполяризаторов катодного процесса, введение в раствор катодных ингибиторов, применение катодной электрохимической защиты;
3) повышение электрического сопротивления системы — коррозионной среды, применяемых защитных покрытий или образующихся на поверхности продуктов коррозии.
Наибольший технический и экономический эффект в борьбе с коррозией достигается при изоляции металлов с помощью различных защитных покрытий — металлических, неорганических неметаллических, органических. Независимо от вида материала покрытия должны иметь хорошую адгезию, быть беспористыми и стойкими в среде, в которой эксплуатируется изделие.
Металлические покрытия подразделяются на катодные (более электроположительные, чем основной металл) и анодные (более электроотрицательные, при этом покрытие защищает основной металл электрохимически). Их наносят горячим способом, погружая изделие в ванну с расплавленным металлом, гальваническим (электроосаждение), термодиффузионным и механотермическим (плакирование) способами.
Неорганические неметаллические покрытия — силикатные, цементные, оксидные, фосфатные, хроматные и другие — применяют или самостоятельно, или в комбинации с лакокрасочными и другими покрытиями обычно в качестве подслоя. Их основное достоинство — повышенная термостойкость.
К органическим покрытиям относят все виды полимерных покрытий, включая лакокрасочные и наносимые способами экструзии расплавов и плакирования, а также разного рода футеровочные покрытия — обмазки, обкладки тонколистовым материалом, гуммирование резиной. Из органических защитных материалов достаточно широко применяют защитные смазки и пленкообразующие ингибированные нефтяные составы (ПИНС) — разные по консистенции вещества, изготовляемые на основе продуктов переработки нефти, невысыхающих растительных масел, кремнийорганических и других олигомеров.
Уменьшение активности коррозионной среды обычно достигается введением в нее ингибиторов коррозии, а также деаэрацией (удалением растворенных и окклюдированных газов). И в том, и в другом случае достигается торможение электрохимического процесса за счет подавления анодной или катодной реакции или обеих одновременно.
К способам, снижающим термодинамическую активность металлов, относят их легирование, катодную (наложение внешнего тока) и анодную (пассивация) защиту.
С целью сохранения металлов все шире практикуется их замена при изготовлении изделий, конструкций и механизмов на неметаллические материалы — пластмассы, бетон, керамику, углеграфитные и другие материалы. Однако, когда требуются высокие значения теплопроводности и электрической проводимости в сочетании с хорошей механической прочностью и тепло-
стойкостью, наиболее оправданным является применение металлов. Из способов их защиты особое внимание уделяется лакокрасочным покрытиям и ингибиторам коррозии.
Защита металлов лакокрасочными покрытиями
По представлениям, развитым в работах Ю. Эванса, В. А. Каргина, Я. М. Колотыркина, И. Л. Розенфельда, Д. Е. Майна и других ученых, противокоррозионное действие лакокрасочных покрытий обусловливается торможением коррозионных процессов на границе раздела металл — пленка. Это торможение может быть связано с ограниченной скоростью поступления веществ, необходимых для развития коррозионного процесса, повышенным электрическим сопротивлением материала пленки, специфическим влиянием адгезии, химическим или электрохимическим воздействием материала пленки на подложку. Таким образом, факторами, определяющими защитные свойства покрытий, являются: проницаемость, электрическое сопротивление, эффект ингибирования, адгезионное взаимодействие с подложкой.
Влияние проницаемости. По данным Ю. Н. Михайловского, торможение процесса коррозии металла под покрытием Q может быть представлено суммой обратных величин: проницаемости Р по отношению к коррозионному агенту, его адсорбции Vадс на поверхности металла и скорости анодной реакции va:
Ω=![]()
В зависимости от активности среды лимитирующей оказывается та или иная стадия. В случае высокоактивных сред (растворы кислот, другие агрессивные жидкости и газы), когда практически отсутствует торможение анодного процесса ионизации металла, а степень адсорбции коррозионного агента велика, защитная способность покрытий в основном определяется проницаемостью пленки. При этом скорость коррозии vкорр ориентировочно может быть оценена следующим образом:
υкорр=KPΔC/δ,
где К — постоянная, зависящая от природы металла; ΔС — градиент концентрации коррозионноактивного агента; δ — толщина покрытия.
В таких условиях все факторы, обусловливающие уменьшение проницаемости покрытий — устранение пористости, кристаллизация и структурирование пленкообразователей, введение наполнителей и компонентов, реагирующих со средой, — благоприятно сказываются на защитной способности покрытий. В частности, в химическом машиностроении оправдало себя применение покрытий на основе химически стойких полимеров с низкой проницаемостью — фторопластов, пентапласта, полиэтилена, полипропилена, поливинилхлорида, при изоляции труб — битумных покрытий. Вследствие низких коэффициентов диффузии электролитов и достаточно большой толщины покрытий (3 мм и более) нередко обеспечивается эффективная их барьерная защита в самых разных средах, в том числе и агрессивных.
В условиях воздействия слабых электролитов (содержащаяся в воздухе вода, атмосферные осадки) существенное влияние на коррозию оказывает способность электролита инициировать анодную реакцию. При доступе электролита подавление анодной реакции за счет поддержания металла в пассивном состоянии может явиться решающим фактором его защиты. Практика показывает, что тонкие пленки, к которым относится большинство лакокрасочных покрытий, проницаемы по отношению к агентам, вызывающим коррозию, в частности, к кислороду воздуха и содержащейся в нем воде. Скорость проникновения воды и кислорода через различные полимерные пленки, по данным И. Л. Ро-зенфельда и Ф. И. Рубинштейн, составляет [в г/(см2«год)]:
Н2O 1,122—1,190
O2 0,004—0,050
Необходимое количество этих агентов для протекания коррозии стали со средней скоростью 0,070 г/(см2-год), согласно реакции
4Fe+3O2+2H2O=2Fe2O3H2O,
составляет [в г/(см2«год)]:
Н2O 0,011
O2 0,030
Сопоставляя эти данные можно заключить, что в преобладающем числе случаев лакокрасочные покрытия, в том числе и пигментированные, не представляют серьезного препятствия для диффузии агентов, необходимых для развития коррозионного процесса.
Имеются данные о том, что через год эксплуатации покрытий (масляные, алкидные, эпоксидные) в водных средах содержание Н2О и О2 под пленкой достигает значений, в несколько раз превосходящих их количества, необходимые для эффективного протекания процесса коррозии. Иначе говоря, барьерный принцип защиты тонких покрытий, какие обычно используются в лакокрасочной технологии, не является определяющим. Барьерный эффект полимерных покрытий, как показывает опыт, проявляется в большей степени по отношению к продуктам коррозии, чем к агентам, ее вызывающим. Так, проницаемость ионов железа — продуктов анодной реакции — на 1—2 порядка меньше, чем например, воды, ионов хлора и других анионов. Таким образом, в отношении проницаемости защитные функции полимерных покрытий в первую очередь проявляются в замедлении отвода продуктов коррозии с поверхности металла, поскольку ионная проводимость полимеров, особенно к катионам металлов, невысока.
Роль электрических свойств покрытий. Электрическое сопротивление покрытий в среде электролитов является суммой двух слагаемых — омического и поляризационного сопротивлений. Первое составляет меньшую долю общего сопротивления, однако оно является основным в защитном действии покрытий. При высоком омическом сопротивлении электрохимический процесс может не наступить. Отмечается определенная зависимость между электрическим сопротивлением пленок и их защитными функциями. В частности, хорошую защиту в морской воде обеспечивают покрытия, имеющие электрическое сопротивление не менее 108 Ом∙см2. При погружении пленок в раствор электролита их электрическое сопротивление заметно падает. Так, в 0,5 н. растворе Na2SO4 через 15 сут его значение для полимерных пленок составило (в % от исходного):
Эпоксидные 87
Перхлорвиниловые 55
Поливинилбутиральные 25
Нитратцеллюлозные 18
Электрическое сопротивление покрытий в растворах электролитов и в воде неуклонно снижается, хотя и с меньшей скоростью, чем в случае свободных пленок (рис.). Конечное значение сопротивления зависит от присутствия в пленкообразователе гидрофильных групп, особенно групп, способных к ионному обмену. Например, в растворе хлорида натрия электрическое сопротивление масляных и алкидных пленок вследствие гидролизующего действия электролита падает на 4—5 порядков. В таких условиях роль покрытия как электрического барьера сводится к нулю.
В отличие от гидрофильных пленок, покрытия, образованные гидрофобными пленкообразователями, способны более длительное время сохранять высокое электрическое сопротивление и тем самым в большей степени препятствовать развитию коррозионного процесса. Проводимость таких покрытий, однако, может возникать в результате присутствия сквозных пор, заполняемых электролитом, или появления других дефектов. Поскольку электрическое сопротивление покрытий уменьшается с повышением температуры, их защитная способность также падает.
Таким образом, электрические свойства покрытий, имея важное значение в электрохимических процессах, не являются определяющими при обеспечении защитных свойств покрытий. Нередко покрытия с низкими значениями электрической проводимости и емкости, причем мало изменяющимися во времени, проявляют низкие защитные свойства.
Р ис.
а Зависимость электрического сопротивления
полиакрилатного покрытия (1) и свободной
пленки (2) от продолжительности выдержки
в воде при 20 °С
ис.
а Зависимость электрического сопротивления
полиакрилатного покрытия (1) и свободной
пленки (2) от продолжительности выдержки
в воде при 20 °С
Рис. б Анодные потенциодинамические кривые стали Ст. 3 в контакте с водоразбавляеиыи полиэфируретаном (1) и 0,1 н. раствором Na2S04 (2)
Роль адгезии. Противокоррозионные свойства покрытий в большой степени зависят от адгезии. Благодаря адгезионному взаимодействию достигаются: 1) пассивация поверхности металла, 2) торможение анодной реакции, 3) замедление отвода продуктов коррозии. Если рассматривать коррозию металла как процесс адсорбции молекул коррозионноактивного вещества на вакантных участках его поверхности, то становится очевидным, что чем выше адгезия, тем меньше остается таких вакантных участков и соответственно меньше появляется возможностей для развития коррозионного процесса.
При высокой прочности адгезионных связей изменяется и характер энергетического состояния поверхности металла под покрытием: происходит его пассивация, которая обусловлена адсорбционными процессами. Об этом свидетельствует, в частности, сдвиг стационарного потенциала металла в положительную сторону, плотность тока анодной поляризации снижается (рис.). Особенно благоприятное влияние на повышение стационарного потенциала (пассивацию металла) оказывают пленкообразователи (полиуретаны, карбоксилсрдержащие водоразбавляемые и др.), способные химически взаимодействовать с металлом с образованием нерастворимых соединений. Высокая адгезия покрытий может явиться существенным препятствием в развитии коррозионного процесса благодаря замедлению отвода продуктов коррозии. Их объем всегда больше объема прокорродировавшего металла, отвод же вследствие малой диффузионной активности ионов сильно затруднен. Напротив, низкая адгезия является одной из причин нарушения покрытия и появления подпленочной коррозии. Поэтому все факторы, способствующие получению покрытий с высокой и стабильной в условиях эксплуатации адгезионной прочностью, благоприятно сказываются на защитной способности покрытий.
М. И. Карякиной предложена условная классификация покрытий по механизму их защитного действия. При этом выделены три механизма защиты: адгезионный, барьерный и смешанный.
К покрытиям, защищающим по адгезионному механизму, относят покрытия с высокой адгезией к металлам, причем адгезия в процессе эксплуатации длительно сохраняется или даже возрастает. Это покрытия на основе полиуретанов, эпоксидных, фуриловых, алкидных, феноло- и мочевиноформальдегидных и других пленкообразователей. Для таких покрытий толщина пленки не играет существенной роли. Нередко тонкие, но сплошные покрытия защищают металл так же эффективно, как и толстые.
Барьерный механизм защиты свойственен покрытиям, получаемым на основе инертных полимерных пленкообразователей; полиолефинов, полифторолефинов, пентапласта, полимеров и сополимеров винилхлорида, полиамидов, некоторых полиакрилатов. Вследствие малой прочности адгезионных связей в этом случае возможна адсорбция коррозионноактивных агентов на поверхности подложки, приводящая к возникновению подпленочной коррозии. Увеличение толщины таких покрытий, как правило, благоприятно сказывается на их защитной способности.
Смешанный механизм характерен для большинства других покрытий и является наиболее типичным.
Ниже приведены данные по свойствам покрытий из эпоксидного ЭП-524 (I) и фторопластового 32Л лаков (II), позволяющие судить о сравнительной эффективности адгезионного и барьерного механизмов защиты:
I II
Адгезия, МПа 30 12
Коэффициент диффузии (водяные пары), см2/с 1∙10-8 2∙10-9
Водопоглощение, г/(см*-Па) 7∙10-7 7∙10-8
Время до начала коррозии металла, ч:
в 5%-ном растворе HNO3 198 138
в 3%-м растворе NaCl 252 132
в атмосфере 95%-й влажности при 40°С 312 184
Из этих данных видно, что фторопластовое покрытие, несмотря на лучшие по сравнению с эпоксидным изолирующие свойства, уступает последнему по защитной способности. Адгезионный механизм в данном случае превалирует над барьерным.
Эффект ингибирования. Ингибирующие свойства лакокрасочных покрытий обычно обеспечиваются за счет введения в их состав противокоррозионных пигментов и ингибиторов коррозии. Эффект ингибирующего действия проявляется главным образом в электрохимических процессах, происходящих на границе металл — пленка. Поэтому ингибированные покрытия эффективны только тогда, когда они служат первым (грунтовочным) слоем. При контакте ингибированной пленки с металлом могут происходить разные процессы: изменение потенциала анодных и катодных участков, изменение рН среды, образование на металле оксидных пленок и ингибирующих комплексов; присутствие пигментов может влиять и на диффузионные характеристики покрытия (см. гл. 4). Наиболее полно эти процессы проявляются в присутствии электролитов. Поэтому эффективность многих пигментов и ингибиторов как противокоррозионных добавок зависит от их растворимости, а продолжительность действия — от времени, в течение которого они сохраняются в пленке в той концентрации, при которой способны поддерживать металл в пассивном состоянии.
Наиболее распространено применение в покрытиях пигментов. В зависимости от механизма действия различают пигменты-ингибиторы и пигменты-пассиваторы.
Анодное ингибирование достигается пигментами, обладающими способностью принимать электроны или увеличивать рН среды и вследствие химических процессов окисления или гидратации образовывать на анодных участках защитные пленки. Результатом их действия является смещение электродных потенциалов металлов в более положительную сторону, в том числе в область пассивного состояния, в которой коррозии металла не происходит. Приведенные ниже данные показывают сдвиг стационарного потенциала стали в воде под влиянием добавок пигментов:
φ, В φ, В
Свинцовый сурик +0,77 Свинцовые белила +0,13
Калий-барийхромат +0,59 Цинковые белила +0,08
Цианамид свинца +0,59 Желтый свинцовый крон +0,02
Цинковый грунтовочный +0,14 Диоксид титана —0,05
крон Железный сурик —0,04
Как видно из этих данных, противокоррозионное действие пигментов сугубо избирательно. Наиболее эффективными анодными замедлителями являются пигменты-окислители (три- и тетраоксихроматы цинка, хромат стронция, калий-барийхромат), а также пигменты, обладающие основными свойствами (свинцовый сурик, свинцовые и цинковые белила, фосфат хрома, цианамид свинца).
Эффект действия хроматных пигментов возрастает с увеличением их растворимости в воде, т. е. с ростом степени ионизации. Растворимость хроматов металлов Zn, Sr, Ba, Pb соответственно равна 1,1; 0,6; 0,001 и 0,00005 г/л. Таким образом, наиболее ценными в противокоррозионном отношении и вследствие этого самыми распространенными являются хроматы цинка — цинковые крона. При воздействии воды они образуют растворы с рН 7,0—7,6 и концентрацией хромат-ионов 3∙10-2 моль/л и более. Этой концентрации оказывается достаточно для того, чтобы сместить потенциал железа в нейтральной среде до +0,3÷ +0,5 В, при котором наступает его пассивное состояние (рис. 5.13).
Механизм действия хроматных пигментов связан с адсорбцией хромат-ионов на поверхности металла, восстановлением хрома из шестивалентного до трехвалентного состояния и образованием нерастворимых сложных комплексных соединений Fe3+ и Сr3+. При этом адсорбируются комплексные ионы, образующиеся при действии воды на хроматные пигменты:
H2O
ZnCrO4∙4H2O ↔ [ZnCrO4(OH)8]8-+8H+.
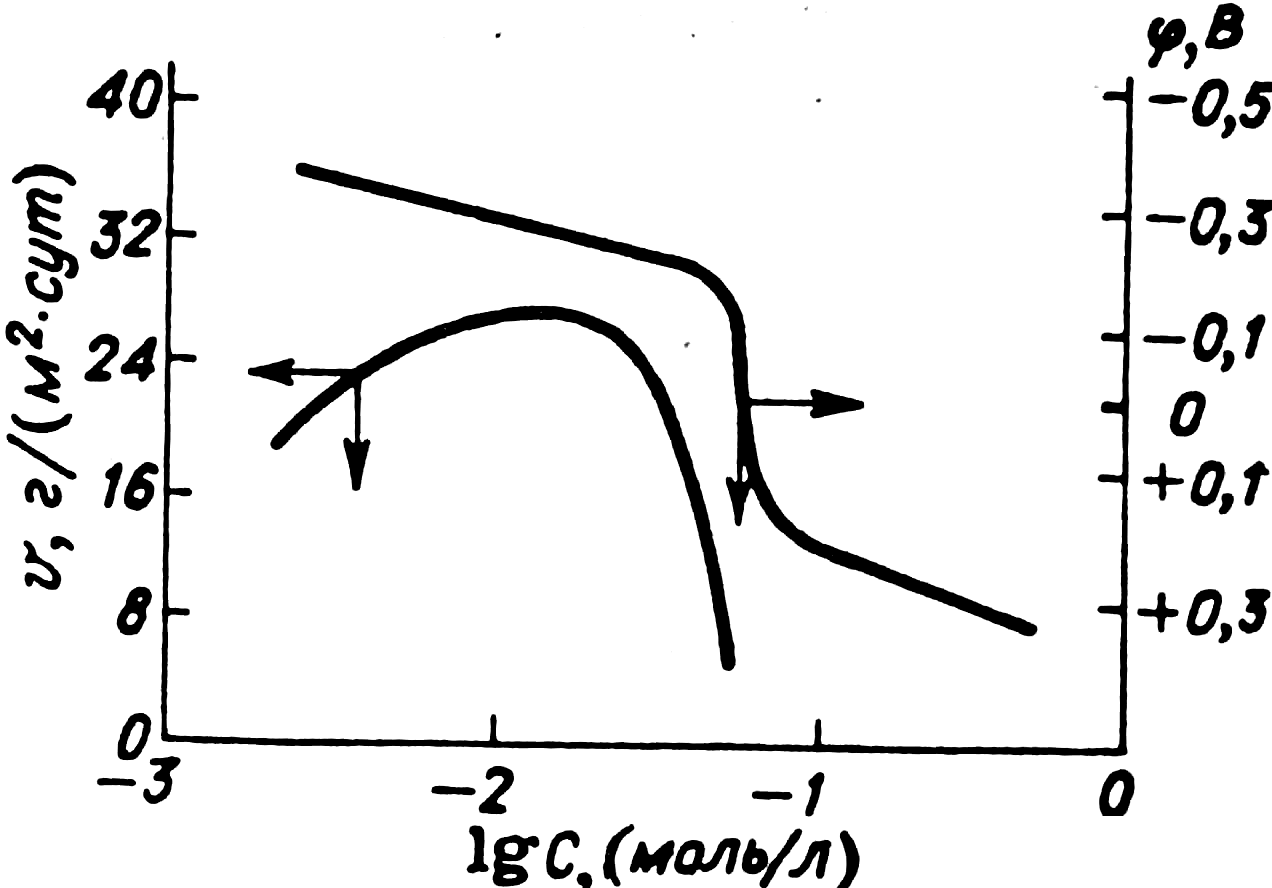
Рис. Зависимость скорости коррозии v и потенциала φ стали от концентрации С ионов СrO42- в 0,1 н. растворе Na2SO4
Пассивирующая способность кронов максимальна в чистой воде. Если покрытие эксплуатируется в электролитах, содержащих агрессивные ионы, например Cl-, SO42-, то пассивирующая способность резко падает. Поэтому крона, как противокоррозионные пигменты, непригодны для защиты металлов от коррозии в сильноагрессивных средах.
Эффективны по своему противокоррозионному действию в покрытиях и фосфатные пигменты — фосфаты хрома, цинка, марганца. Их применяют как самостоятельно (фосфат цинка), так и в смеси с хроматными пигментами (фосфат хрома). Главное преимущество этих пигментов перед хроматными — их меньшая токсичность. Противокоррозионное действие фосфатных пигментов основана на их диссоциации
Zn3(PO4)2∙4H2O ↔ [Zn(PO4)2(OH)2(H2O)2]2-+2H+
и адсорбции образующихся ионов на анодных участках поверхности; возникающие при этом железо-цинкфосфатные комплексы пассивируют металл.
Фосфатные пигменты применяют в грунтовочных составах преимущественно по черным металлам, в хроматные — по цветным (алюминию, сплавам алюминия и магния).
Пигменты основного характера (оксид цинка и др.) применяют исключительно для защиты черных металлов. Их защитное действие связано с генерированием гидроксильных ионов, способствующих образованию пассивирующего оксида по реакции:
Fe+2OH- –2e → FeO+H2O.
Свинцовые пигменты благоприятно влияют на защитную способность покрытий в морской воде. Например, свинцовый сурик РЬз04 при гидратации в воде способен образовывать ряд соединений: Pb(OH)2, Рb2O3∙ЗН2O и др. Первое, взаимодействуя с сульфатами металлов, имеющих радиус катиона менее 0,12 нм, дает нерастворимые осадки сульфата свинца, отлагающиеся преимущественно на катодных участках поверхности; второе, осаждаясь в виде комплексной соли с железом, экранирует анодные участки. Этот пигмент применяют преимущественно с такими пленкообразователями, как растительные масла, алкиды, хлоркаучук, эпоксидные олигомеры.
Катодное ингибирование (протекторная защита) в нейтральных средах осуществляется в результате использования порошков металлического цинка (цинковой пыли) и магниевых сплавов, в щелочной — порошков металлического свинца. Потенциал цинка в морской воде достигает —0,83 В, а свинца в щелочных средах —0,84В. Это позволяет применять их в качестве эффективных протекторов по стали и другим металлам, имеющим более положительные электродные потенциалы. Действие этих пигментов, однако, проявляется при высокой степени наполнения, когда достигается контакт между частицами, обеспечивающий хорошую электрическую проводимость пленок. Так, протекторные цинковые покрытия на основе полистирола, фенолоформ-альдегидных, эпоксидных и других пленкообразователей содержат до 95—96% (по массе) металлического порошка.
Алюминиевая пудра из-за наличия на поверхности частиц оксидной пленки и слоя смазки не способна к электрохимической защите. Ее положительное влияние в противокоррозионных «покрытиях сводится к обеспечению барьерного эффекта.
В сочетании с пленкообразователями можно применять не только противокоррозионные пигменты, но и вещества непигментного характера — различные ингибиторы коррозии. При этом достигается нередко более высокий противокоррозионный эффект, чем в случае использования пигментов. Вещества, способные выполнять функции ингибиторов коррозии, классифицируют следующим образом.
По характеру среды, в которой достигается эффект действия, различают ингибиторы 1) кислотной коррозии, 2) коррозии в
щелочных средах и 3) коррозии в нейтральных средах, включая атмосферные условия. По химической природе они могут быть органическими и неорганическими, маслорастворимыми и водорастворимыми. Многие ингибиторы, как и ПАВ, можно характеризовать значением гидрофильно-лиофильного баланса, которое колеблется от 5 до 20.
По способу воздействия ,на металл выделяют ингибиторы контактные и парофазные. Наибольшее применение в лакокрасочных покрытиях получили контактные ингибиторы (их действие проявляется при непосредственном соприкосновении с поверхностью металла), однако известны составы и с парофазными ингибиторами коррозии.
По механизму действия все ингибиторы подразделяют на анодные и катодные. Анодные ингибиторы, воздействуя на анодные участки, либо вызывают окисление металла и образование труднорастворимых осадков, либо экранируют их механически вследствие адсорбции. Действие катодных ингибиторов основано на снижении содержания кислорода в растворе, повышении перенапряжения катодного процесса или уменьшении площади катодов. Имеются ингибиторы (преимущественно экранирующего типа), которые замедляют одновременно и катодную, и анодную реакции.
Из неорганических соединений водорастворимого типа распространенными замедлителями коррозии в нейтральных средах являются соли щелочных металлов и азотистой и хромовой кислот. Их применяют в водных составах индивидуально или в смеси с другими ингибиторами — Na2CO3, Na3PO4, Na2HPO4, уротропином, бензоатом аммония и др. При наличии в электролите уже небольших количеств нитрита натрия (0,2 г/л и более) начальный потенциал стали смещается в положительную сторону более чем на 0,7 В, при этом скорость растворения стали практически сводится к нулю. Это явление связано с адсорбцией ионов NO2- на поверхности металла и окислением ее с образованием γ-Fe2O3. В результате уменьшается энергия Гиббса системы и затрудняется переход ион-атомов металла из решетки в раствор. Действие хроматов, а также щелочных солей аналогично действию соответствующих пигментов.
Органические ингибиторы — соединения различных классов, способные адсорбироваться на электродных участках и вызывать экранирующий эффект. Наиболее эффективны те из них, которые склонны к хемосорбции, т. е. содержат активные группы— доноры я акцепторы электронов: —CN, —CNS, —CNO, —NH2, =СО, —СНО и др. По адсорбционной способности и соответственно ингибирующему эффекту алифатические соединения располагаются в следующий ряд:
Кислоты> Амины> Спирты> Эфиры.
Повышенной адсорбционной способностью обладают также этиленовые и особенно ацетиленовые производные, вследствие взаимодействия я-электронов с поверхностными атомами металлов.
Для получения ингибированных покрытий нашли применение многие органические соединения, которые подразделяются на водорастворимые: хроматы гуанидина и циклогексиламина, фосфат гуанидина, таннин, бензотриазол, гексаметиленимин и др.; и маслорастворимые: соли и комплексы аминов и синтетических жирных, нафтеновых и сульфокислот (ингибиторы МСДА, ПМП, ИФХАН, КИНК, ИКБ-2 и др.), производные морфолина и е-капролактама (ингибиторы ВНХ-10, ВНХ-1), амиды жирных кислот (алииленсукцинимид карбамида), нитрованные масла, петролатум, церезин (ингибиторы АКОР-1, ИНГА, МНИ-5, МНИ-7), нефтяные сульфонаты кальция и карбамида (ингибиторы КСК и БМП), аддукты малеинового ангидрида и полибу-тадиенов.
Водорастворимые ингибиторы вводят как в водные, так и в органорастворимые составы, маслорастворимые — преимущественно в материалы, содержащие органические растворители, однако ингибиторы водовытесняющего типа пригодны и в воднодисперсионных составах.
Имеется ряд особенностей получения ингибированных покрытий. В отличие от пигментов, которые можно сочетать с самыми разными пленкообразователями ингибиторы выбираются индивидуально для каждого вида пленкообразующей системы с учетом их химического взаимодействия с ее компонентами (при наличии такого взаимодействия ингибитор берется в избытке). Следует учитывать и избирательное действие ингибиторов по отношению к разным металлам, а также требования по подготовке их поверхности.
Поскольку адсорбция идет преимущественно по активным центрам поверхности, а они, как правило, имеют разную природу, нередко лучший защитный эффект достигается при использовании смесей двух или нескольких ингибиторов. Концентрация ингибитора выбирается с учетом эффекта его действия. Так, для хромата циклогексиламина. (С6Н11NH2)2Н2СrО4, по данным И. Л. Розенфельда и Ф. И. Рубинштейн, минимальная концентрация в водном растворе составляет 1∙10-3 моль/л. При этой концентрации необратимый электродный потенциал стали смещается в область положительных значений, и коррозия металла становится близкой к нулю (рис. 5.14). Минимальная концентрация хромата циклогексиламина при введении его в алкидный лакокрасочный материал составляет 3% от массы пленкообразователя.
Аналогичным образом вызывает пассивацию металла хромат гуанидина NH=C(NH2)2∙H2CrO4, будучи введенным в состав масляных и алкидных красок в количестве 3—6%. (рис. 5.15).
Р ис.
а. Зависимость скорости коррозииv
и
потенциала φ стали от концентрации С
хромата
циклогексиламина в водном растворе
ис.
а. Зависимость скорости коррозииv
и
потенциала φ стали от концентрации С
хромата
циклогексиламина в водном растворе
Рис. б. Зависимость потенциала стали от продолжительности испытания в 3%-м растворе NaCl:
1 — неокрашенный металл;
2 — металл, окрашенный масляной краской;
3 — металл, окрашенный масляной краской с 6% хромата гуанидина
Действие ингибиторов проявляется не только при их введении в состав лакокрасочных материалов, но и при обработке поверхности металлов перед окрашиванием, при обработке пигментов и наполнителей.
Разработаны и нашли промышленное применение содержащие ингибиторы коррозии воднодисперсионные и органорастворимые лакокрасочные материалы: краски и эмали для длительной противокоррозионной защиты (марки ГФ-570, ГФ-570РК, ГФ-750, МС-1181) и составы для временной защиты металлов, в том числе съемные (см. гл. 4) и смываемые (марки ИС-1, ИСМ-3, ИП-27 и др.). Для профилактической и межоперационной защиты металлоизделий наряду с этим широко используются пленкообразующие ингибированные нефтяные составы (ПИНС) «Мовиль», «Шасси-Универсал», НГ-216 и др., а также ингибированные восковые составы и смазки. При их нанесении поверх лакокрасочных покрытий достигается особенно высокая противокоррозионная защита.
Использование ингибиторов коррозии наряду с пигментами — один из наиболее действенных путей повышения защитных свойств лакокрасочных покрытий. Это видно хотя бы на таких примерах. Тонкое покрытие из неингибированной олифы защищает сталь в атмосфере 100%-й влажности примерно 10 сут, такое же покрытие с ингибитором хроматом гуанидина — до 1 года. Длительность защиты съемного неингибироваиного покрытия из эмали ХВ-114 в атмосферных условиях w более 6 мес, ингибированного (ингибиторы АКОР-1, БМП или МСДА-11)—свыше 3 лет. С использованием ингибиторов коррозии (таннин и др.) появилась возможность получать высокоэффективные противокоррозионные грунтовки на основе водных дисперсий полимеров, а также составы с пониженным содержанием токсичных и дефицитных противокоррозионных пигментов, таких, как свинцовый сурик, крона и др.
