
- •Физико-химические основы технологии электронных средств
- •2. Технологии связанные с травлением
- •2.1. Травление материалов в жидких средах
- •2.2. Химическое полирующее травление поверхности
- •2.3. Электро-химическое полирующее травление поверхности
- •2.4. Ионно-плазменное травление
- •2.4.1. Ионно – плазменное травление.
- •2.4.2. Газовое травление полупроводниковых подложек. Пример
- •2.4.3. Плазмохимическое травление полупроводниковых пластин
- •2.4.4. Оборудование, технологические приемы и контроль качества плазмохимического травления
2.3. Электро-химическое полирующее травление поверхности
Электрохимическая обработка основана на законах анодного растворения металлов при электролизе.
При прохождении электрического тока через электролит на поверхности заготовки происходят химические реакции, и поверхностный слой металла превращается в химическое соединение.
Продукты электролиза переходят в раствор или удаляются механическим способом.
Производительность этого способа зависит от электрохимических свойств электролита, обрабатываемого материала и плотности тока.
Электрохимическое полированиеосуществляется в ванне, заполненной электролитом (растворы кислот и щелочей).
Обрабатываемую заготовку подключают к катоду (рис. 21.5). Катодом служит металлическая пластинка из свинца, меди, стали (иногда электролит подогревают).
Рис. 2.7. Схема электрохимического полирования:
1 – ванна; 2 – обрабатываемая заготовка; 3 – пластина-электрод; 4 – электролит; 5 – микровыступ; 6 – продукты анодного растворения
При подаче напряжения начинается процесс растворения металла заготовки (в основном на выступах микронеровностей). В результате избирательного растворения, микронеровности сглаживаются, и обрабатываемая поверхность приобретает металлический блеск.
Улучшаются электрофизические характеристики деталей: уменьшается глубина микротрещин, поверхностный слой не деформируется, исключаются упрочнения и термические изменения структуры, повышается коррозионная стойкость.
Этим методом получают поверхности под гальванические покрытия, доводят рабочие поверхности режущего инструмента, изготовляют тонкие ленты и фольгу, очищают и декоративно отделывают детали.
Механизм анодного растворения при электрохимическом полировании
Удаление металла при электрохимическом полировании происходит под действием электрического тока в среде электролита без непосредственного контакта катоды (инструмента) и заготовки. В основе процесса электрохимического полирования лежит явление анодного растворения металла. Анодное растворение может протекать в электролитах различного состава, в том числе в неагрессивных электролитах — водных растворах хлорида натрия, нитрата натрия и др. Эти соли дешевы и безвредны для обслуживающего персонала.
Под действием тока в электролите материал анода растворяется и в виде продукта реакции выносится из промежутка потоком электролита. В результате реакции образуются газообразные продукты, которые удаляются в атмосферу. Катод не изнашивается, что является одним из достоинств процесса электрохимического полирования.
При растворении в воде молекулы, например, солей, распадаются на положительные (катионы) и отрицательные (анионы). Молекулы воды поляризуются и располагаются в виде сферы вокруг какого-то центрального иона (рис. 1.20).
H2O
_

-
H2O

+ +
+

-
+ +


- +
H2O

Na Cl
+ + 

+ + 

- + _


+
_

Рис. 2.8. Схема растворения солей
Если электроды погружены в электролит, то на их поверхности протекает обратимая реакция
Ме Меn++ nе,
где n- валентность металла; Меn+ ион в растворе, е - электрон.
На поверхности металла возникает положительный заряд, и к нему притягиваются отрицательно заряженные ионы из раствора. На границе электролита с металлом образуется так называемый двойной электрический слой, подобный тому, какой возникает на обкладках конденсатора (рис.1.21). Один слой представляет поверхностные заряды в металле (+), другой — ионы в растворе (-). За счет этого на электродах возникают скачки электрического потенциала. Протекание процесса электрохимического полирования становится возможным, если приложить внешнее напряжение, превышающее разность а — к, гдеа- скачок потенциала на аноде, ак - скачок потенциала на катоде. При подключении электродов к источнику напряжения ионы начинают двигаться в электролитическом поле через межэлектродный промежуток от электрода к электроду.





































Ме






































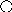



Рис. 2.9. Схема образования двойного электрического слоя.
На катодепроисходит ускоренное разложение молекул воды с выделением молекулярного водорода:
H2O + eH++ OH--
H++ H+ H2
На аноде справедлива следующая схема перехода металла в нерастворимый гидроксид:
Me — ne Men+
Men+ + n OH — Me (OH) n
Одновременно образуется молекулярный кислород:
2 OH — — 2e H2O + O+
O++ O+O2
Таким образом, в результате реакции выделяются свободные H2иO2и выпадает осадок на аноде в виде гидроокиси металла. Нерастворимые продукты выносятся потоком электролита из зоны обработки.
При большой силе тока возможны другие реакции в результате которых могут образовываться оксиды. Это нежелательные реакции, потому что оксиды покрывают поверхность металла и ухудшают растворение металла, а следовательно и обрабатываемость.
Требования предъявляемые к электролитам для электрохимического полирования.
От состава электролита сильно зависит электропроводность и скорость растворения металла. Для хороших технологических показаний процесса необходимо:
1) в электролите не должны протекать вовсе или протекать в минимальном объёме побочные реакции. Это снижает производительность.
2) растворение заготовки должно происходить только в зоне обработки
3) на всех участках обрабатываемой поверхности должен протекать расчётный ток
Универсальных электролитов, которые отвечают всем требованиям не существует. Поэтому для каждой детали подбирают свой состав электролита. Не существует расчётных методик определения оптимальных режимов, поэтому всё подбирается экспериментально.
Требования к электролитам при электрохимическом полировании:
1) содержащиеся в водном растворе электролита анионы и катионы должны хорошо диссоциировать при любых условиях
2) необходимо чтобы потенциал материала электрода был более положителен, чем потенциал осаждения катиона. Это нужно для того, чтобы катод не покрывался слоем металла
3) обеспечение в ходе реакции в электролите перехода продуктов реакции анодного растворения в нерастворимое состояние
4) скорость образования пассивной анодной плёнки и скорость её растворения должны быть равны
5) толщина удаляемого слоя при полировании должна быть минимальной
6) электролит не должен быть агрессивным к металлу при отсутствии тока. Для предотвращения разъедания металла в момент выключения тока вводится окислитель
7) электролит должен обеспечивать полирование в широком диапазоне температур и плотности тока и иметь продолжительный срок службы
8) в процессе полирования не должны выделяться вредные газы
Назначение и суть электрохимического полирования металлов.
Электрохимическое полирование поверхности детали применяют в качестве способа подготовки поверхности детали для проведения дальнейших операций покрытия (осаждение химическое и гальваническое металлов, оксидирование, анодирование, фосфорирование и т.д.)
Кроме того, электрохимическое полирование применяют для удаления заусенцев и полирования деталей сложной формы.
Преимущества метода:
нет механического воздействия на материал детали, поэтому такая обработка не нарушает поверхностного слоя, это особенно важно при полировании полупроводниковых заготовок.
Считается, что при электрополировке поверхность состоит из активных и пассивных участков. Полирование в электролите происходит вследствие неодинаковой пассивации выступов и впадин поверхности,а также различных условий диффузии анионов и катионов сквозь вязкий прианодный слой (рис.1.22). Пассивными являются микроуглубления, потому что в них скапливаются продукты анодной реакции, которые являются нерастворимыми. На активных микровыступах возрастает плотность тока и значит скорость их растворения, так как энергия необходимая для перевода иона в растворе максимальна на микровыступах детали.
+
— 



















Рис. 2.10. Схема электрополирования
Энергия отрыва иона состоит из суммы собственной энергии отрыва и энергии, необходимой для диффузии сквозь прианодный слой.
Для выяснения процесса химического полирования рассмотрим зависимость силы тока от напряжения на клеммах ванны.
Характеристика электрохимического процесса.

Рис. 2. 11. Влияние плотности тока на процесс полирования
При различных условиях на аноде электролитической ванны могут происходить:
1) растворение металлического анода
2) окисление металла анода
3) выделение газообразного кислорода
4) окисление различных веществ – компонентов раствора
5) электрополирование металла анода
Эти процессы протекают при режимах, соответствующих различным участкам характеристики процесса.
На участке АВ плотность тока увеличивается пропорционально приложенному напряжению. Анод при этом находится в активном состоянии (анод растворяется).
Участок ВС соответствует нестабильному состоянию процесса. При этом происходит пассивация анода и формируется вязкий слой электролита.
На участке CDпротекает процесс полирующего травления анода. Вязкий слой стабильный и участки анода находятся в пассивированном состоянии и идёт травление выступающих участков.
На участке DEплотность тока повышается за счёт разрядов анионовOH-. Всё это сопровождается выделением кислорода. Полирование меди на участкеCEв ортофосфорной кислоте не позволяет получить гладкой поверхности, это вызвано тем, что пузырьки выделяющегося кислорода задерживаются некоторое время на поверхности детали, что вызывает поверхностное выкрашивание –питтинг.
Участок EKне является рабочим участком электрохимического полирования.
Такие режимы используют для создания обратных процессов.
Процесс протекает при режимах, приведенных ниже:
T= 70 – 95oC
плотность тока J = 2,5 – 10А/дм2(встречаются до 100А/дм2)
U= 7 – 15 В
При электрохимическом полировании применяют ток, такой плотности, при котором вместе с растворением анода происходит разряд анионов: OH-, SO4--,PO4---.
При меньших плотностях тока металл просто растворяется.
Если плотность тока слишком велика, то происходят отрицательные явления: перегрев, бурное выделение газов на аноде, сильное растравливание металла.
Температура электролита очень важный технологический параметр, если она черезчур низкая, то увеличивается вязкость прианодного слоя, при этом ухудшается диффузия через прианодный слой и требуется повышеное напряжение в ванне.
Повышение температуры снижает вязкость прианодного слоя, при слишком большой температуре наблюдается простое травление металла.
Эффективное полирование зависит также и от времени. Увеличение длительности не улучшает качество полировки, а наоборот приводит к растравливанию отдельных участков. Необходимо установить оптимальную длительность процесса полировки, которая зависит от состояния поверхности металла, свойств металла, свойств электролита, от режимов токовых и температурных.
В ряде случаев на поверхности анода образуется труднорастворимое соединение или анод покрывается адсорбированными пузырьками, поэтому в таких случаях рекомендуется обеспечивать покачивание детали в электролите.
При покачивании обеспечивается и теплоотвод.
Для процесса важно правильно подобрать размеры, форму и материал катодов. Площадь катода должна быть в несколько раз больше полируемой детали. Форма катода чаще всего плоская, но для полирования детали сложной формы применяют профильные катоды. Материал катода должен быть химически устойчив к электролиту.
Подвесные приспособления рекомендуется выполнять из того же материала, который полируется.
Чаще всего химическая полировка используется для подготовки деталей из сплавов алюминия к последующим покрытиям (от простого окрашивания до анодирования, оксидирования и т.д.)
Существует несколько электролитов для полирования алюминия.
на основе кислот:
H3PO4,H2SO4
на основе щелочных солей:
Na2CO3
В эти электролиты добавляют хромовый ангидрид, который предотвращает разъедание металла в момент отсутствия тока.
Температура 55 – 100 оС
Длительность от 0,5 до 20 мин
Для полирования сталей в основном используют электролиты на основе ортофосфорной кислоты.
Некоторые сорта сталей можно полировать в электролитах на основе серной кислоты. Плотность тока должна быть при этом высокая 250 А/дм2
Температура 100оС
Время 0,5 мин
Скорость съёма материала 1,7 мкм/сек
Недостатки электролитов на основе ортофосфорной и серной кислот:
короткий срок службы из-за образования нерастворимых соединений (для улучшения качества полировки вводят глицерин)
Быстрорежущие стали полируют в электролитах, содержащих азотную кислоту.
Плотность тока высокая.
При полировании быстрорежущих сталей в азотной кислоте получают также
©повышение коррозионной стойкости, так как на поверхности образуются пассивные плёнки: FeO·Cr2O3иNiO·Cr2O3
При полировании быстрорежущих сталей количество снимаемого материала велико – от 20 до 40 мкм.
Если нужно снять меньший слой материала, от применяют химическое полирование, а не электрохимическое.
Серебрянные изделия полируются в цианистых электролитах серебрения.
Плотность тока 2 – 3 А/дм2
Для растворения анодной плёнки рекомендуется импульсный токовый режим.(интервал импульса 3 – 4сек).
Универсальные электролиты для полировки серебра содержат хлорную кислоту и уксусный ангидрид.
Особенность этих электролитов: возможно резкое повышение температуры, которое может привести к взрыву оборудования.
Рассмотрим характерные дефектыэлектрополированных поверхностей.
Они обусловлены дефектами самого материала металла или полупроводника, неверными условиями электрополирования, плохим качеством очистки поверхности и качествами электролита.
Например, наличие загрязнений или неоднородности материала приводит к появлению участков окисных или солевых плёнок.
Неравномерность движения электролита по поверхности или неправильное взаимное расположение деталей и электродов может вызвать как снижение точности обработки, так и искажение геометрической формы, вследствие неравномерного растворения металла.
Направленное движение газовых пузырьков по поверхности деталей могут быть причиной “полосатости” поверхности.
Пониженное напряжение также может вызвать растравливание поверхности.
Электрополирование наряду с прямым результатом даёт поверхности ряддополнительных качеств.
в ряде случаев электрополирование повышает усталостную прочность и коррозионную стойкость металла,
уменьшается коэффициент трения поверхности,
увеличивается способность металла к холодной пластической деформации (молибден),
в отдельных случаях электрополированием получают максимальную отражающую способность (алюминий).
Для ферромагнитных сплавов электрополирование позволяет повысить магнитную проницаемость материала и снизить потери на гистерезис. Это явление носит название критерия неочевидности.
