
5.Механизм и кинетика восстановления газом твердых оксидов металлов
В зависимости от вида газообразного продукта восстановления в доменной печи различают прямое и косвенное восстановление. в первом случае продуктом является СО, а во втором СО2 или Н2О.
FeO + CO = Fe+CO2
СО2+С=2СО
FeO+ С = Fe+CO
Обычно принимают в согласии с экспериментальными данными, что косвенное восстановление соответствует умеренным температурам (до 900-1000С), а прямое – высоким. В зоне умеренных температур восстановление Fe203 и Fe304 практически заканчивается, а восстановление FeO не заканчивается. Поэтому восстановление Fe203 и Fe304 в основном проходит непрямым путем, а восстановление FeO и прямым и непрямым путем..
В шихтовых материалах окислы железа иногда находятся в виде сложных соединений и твердых растворов. В общем случае активность железа в окислах и соединениях и растворах снижается, а в равновесной газовой смеси доля восстановителя СО и Н2 должна расти. При низких температурах восстановление силикатов железа окисью углерода практически не идет. Они восстанавливаются в основном прямым путем
Fe2SiO4 + 2C = 2Fe+SiO2+2CO.
В области высоких температур возможна следующая схема восстановления силикатов железа.
Fe2SiO4 = 2FeО+SiO2.
2FeO + 2CO = 2Fe+2CO2
2СО2+2С=4СО
Fe2SiO4 + 2C = 2Fe+SiO2+2CO.
При этом расходуется 3150 кДж/кг железа. В случае прямого восстановления вюстита расходуется 2730 кДж/кг железа. Таким образом, для восстановления силикатов железа требуется дополнительный расход горючего.
Механизм процесса восстановления
Сегодня нет единой трактовки механизма восстановления окислов в доменной печи.
Наиболее исследован процесс восстановления куска руды в области умеренных температур.
В пространстве между кусками руды и в крупных порах течет газ-восстановитель.
Для контакта с реакционной поверхностью газу-восстановителю нужно диффундировать по микропорам куска, а также через слой образовавшихся твердых продуктов восстановления внутрь куска. Газообразные продукты тем же путем отводятся из зоны реакции. Для описания диффузии через граничный слой газа толщиной l используется коэффициент массопередачи.
= D/l, где D – коэффициент диффузии газа восстановителя
Коэффициент диффузии газов 1 и 2 в бинарной смеси
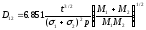
где t – температура, С
р – давление , кПа
М1 и М2 – молекулярные массы газов
1 и 2 - диаметры молекул газа , Å.
При диффузии в порах удары молекул о стенки поры, будут чаще, чем столкномения молекул такое движение называется кнудсеновским или молекулярным, коэффициент кнудсеновской диффузии
Dk = 8/3d(RT/2M)1/2
где d – эффективный размер поры.
Далее необходима адсорбция газа-восстановителя на поверхности твердой фазы. На этой поверхности протекает реакция восстановления, включающая отнятие кислорода от окисла, образование и рост зародышей продуктов восстановления – магнетита, вюстита и железа.
Последующее наращение слоя продуктов реакции происходит в результате твердофазных реакций и диффузии в твердой фазе. Диффузия преимущественно протекает по вакансиям кристаллической решетки вюстита.
Движущей силой на каждом этапе является отклонение от положения равновесия. Например, для диффузии - это разность концентраций (или давления) реагентов в начале и в конце диффузионного пути. Важное значение имеет определение лимитирующей стадии.
По С.Т. Ростовцеву критерием является показатель S = (k/D)1/2r0
где r0 – исходный размер окисного шара.
k – константа скорости химической реакции
– удельная поверхность пор
D – коэффициент диффузии газа через поры
– удельный объем пор.
если S<0.1 – процесс идет в кинетическом режиме
если S>40 – процесс идет в диффузионном режиме скорость лимитируется подводом газа-восстановителя к реакционной поверхности.
В промежуточной области при низких температурах – кинетический режим, при высоких – диффузионный.
