
РЕШЕНИЯ / САНЯ
.doc№201(картинка)

№204(такая же)
Формула поваренной соли NaCl.
Атомарная масса Na равна 23, а Cl 35.
Поэтому молярная масса NaCl - 58г (если надо посчитать точнее, то 22,989+35,453).
Чтобы найти массу одной молекулы надо разделить молярную массу на число Авогадро 6*10^23 (количество молекул в одном моле).
№207(не нашел)
№210(подобная)
В сосуде объемом 2 м3 находится смесь 4 кг гелия и 2 кг водорода при температуре 27°С. Определить давление и молярную массу смеси газов.
Решение. Воспользуемся уравнением Менделеева - Клайперона, применив его к гелию и водороду:
p1*V=m1/u1 * RT
p2*V=m2/u2 * RT
где р1 – парциальное давление гелия; m1 – масса гелия; u1 – его
молярная масса; V – объем сосуда; Т – температура газа; R = 8,31 Дж/(моль·К) –молярная газовая постоянная; р2 – парциальное давление водорода; m2 –
масса водорода; u2 – его молярная масса.
По закону Дальтона:
p=p1+p2
Из уравнений (1) и (2) выразим р1 и р2 и подставим в уравнение (3):
p=(m1*RT)/(u1*V) + (m2*RT)/(u2*V)=(m1/u1 + m2/u2)*RT/V
С другой стороны, уравнение Менделеева - Клайперона для смеси газов имеет вид:
p*V=((m1+m2)/u)*RT
Сравнивая (4) и (5) найдем молярную массу смеси газов по формуле:
u=(m1+m2)/(v1+v2)=(m1+m2)/(m1/u1 + m2/u2)
где ν1 и ν2 – число молей гелия и водорода соответственно.
p=(4/(4*10^-3)+2/(2*10^-3))*(8.31*300)/2=2.5*10^6(Па)
u=(4+2)/(4/(4*10^-3)+2/(2*10^-3))=3*10^-3(кг/молль)
Ответ: 3·10^-3 кг/моль.
№213(такая же)
Каково будет давление воздуха, если 5 л его сжаты до объема 1,5 л при неизменной температуре? Начальное давление воздуха 690 мм. рт. ст. Постройте по
точкам график процесса в координатах Р, V.
Исходя из того, что физические задачи должны решаться с использованием единиц СИ, преобразуем исходные данные.
Дано: V1 = 5 л = 5 • 10-3 м3, V2 = 1,5 л = 1,5 • 10-3 м3, T = const, p1 = 690 мм рт. ст. = 101325/760 • 690 ~ 9,20 • 104 Па.
Определить: p2.
Решение.
Считая, что поведение воздуха подчиняется законам идеального газа, для сжатия при неизменной температуре (изотермического процесса) имеем следующее
уравнение:
p1V1 = p2V2 = const,
откуда находим, что
p2 = p1V1/V2. (1)
Вычисляя по формуле (1), получим
p2 = 9,20 • 104 • 5 • 10-3/(1,5 • 10-3) ~ 3,1 • 105 (Па),
или во внесистемных единицах
p2 = 690 • 5/1,5 = 2300 (мм рт. ст).
Для пос троения графика процесса зададимся рядом значений V в диапазоне от 1,5 л до 5 л и найдём соответствующие значения p (можно сделать это и во
внесистемных единицах, округляя результаты до целых чисел). Результаты сведём в таблицу.
первое V(объем,л), второе p(давление,мм рт.ст.)
1,5=2300
2,0=1725
2,5=1380
3,0=1150
3,5=986
4,0=863
4,5=767
5,0=690
это точки график по ним построить не трудно
№216(картинка)

№219(такое же)
Смесь азота с массовой долей g1 = 87,5% и водорода с массовой долей g2 = 12,5% находится в сосуде объемом V = 20 л при температуре Т = 560 К. Определить
давление р смеси, если масса m смеси равна 8 г.
P-V = v*R*T v (N1) = 8*0.875/28 = 0.25моль
v(H2) = 8*0.125/2 = 0.5моль
v (газов) = 0,25+0,5 = 0,75моль
P = 0.75* 8.31*560/ (20*10^-3) = 174,53*10^3 Па
№222(картинка)

№225(картинка)

№228(нету)
№231(картинка)

№234(картинка)
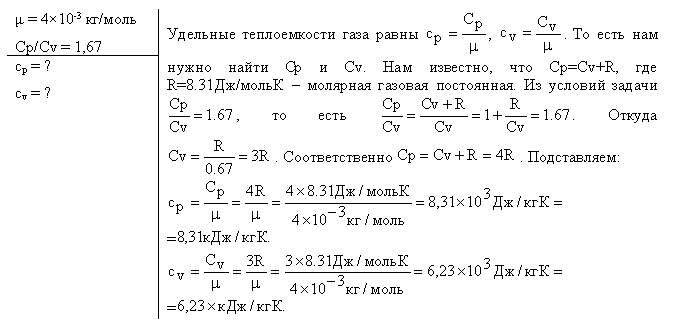
№237(картинка)

№240(нету)
№243(подобная,картинка)
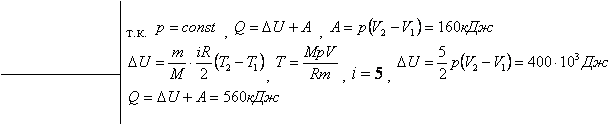
№246(нету)
№249(нету)
№252(нету)
№255(картинка № 243)

№258(нету)
№261(подобная)
температура нагревателя и холодильника идеальной тепловой машины соответственно равны 380К и 280К.
кпд=Тн-Тх/Тн
кпд1=380-280/380=0.26
№264(нету)
№267(подобная)
рассчитаем КПД тепловой машины.
кпд =(T1-T2)/T1= (3-1)/3=2/3
Значит 2/3 теплоты идёт в работу 42*2/3=28 кДж
Лауреат 1-ой Всес студ олип по физ
№270(нету)
№273(нету)
№276
Капилляр внутренним радиусом r = 2 мм опущен в жидкость. Найти поверхностное натяжение а жидкости, если известно, что в капилляр поднялась масса
жидкости m = 0,09 г
и тут картинка

