
- •Федеральное агентство по образованию
- •Глава I. Агрегатные состояния вещества. Фазы и фазовые переходы……..4
- •Глава II. Теплоемкость ……………………………………………………29
- •Глава III. Теплопроводность………………………………………………….36
- •Глава IV. Диффузия……………………………………………………………39
- •Глава V. Математическая постановка задач по расчету распределений температур и концентраций………………………………………...43
- •Глава I. Агрегатные состояния вещества. Фазы и фазовые переходы
- •Свойства жидкостей
- •Давление и вязкость в жидкой фазе
- •Поверхностное натяжение
- •Смачивание и капиллярные явления
- •Движение тел в жидкостях и газах. Метод Стокса определения вязкости жидкости.
- •Глава II. Теплоемкость
- •Теплоемкость газов. Закон Майера
- •Глава III. Теплопроводность
- •Глава IV. Диффузия
- •Глава V. Математическая постановка задач по расчету
- •Физические основы технологических процессов в пищевой промышленности.
Глава III. Теплопроводность………………………………………………….36
Молекулярно-кинетическая теория теплопроводности в газах…36
Теплопроводность кристаллов. Неэлектропроводные вещества..37
Теплопроводность кристаллов. Металлические кристаллы……..38
Глава IV. Диффузия……………………………………………………………39
Глава V. Математическая постановка задач по расчету распределений температур и концентраций………………………………………...43
Литература………………………………………………………………………44
Технология – совокупность приемов и способов получения, обработки и переработки сырья, материалов, полуфабрикатов или изделий, осуществляемых в различных отраслях промышленности, в строительстве и т.п.… В состав современных технологий включается и технический контроль производства.
Краткая Российская энциклопедия. Т.3. 2004.
Введение
В технологических процессах пищевого производства большое место за-нимают достижения физических наук. Если с понятием технологии связы-вать только процесс непосредственной переработки исходного пищевого сырья в конечный продукт, то, конечно, перечень применяемых физических явлений не будет очень широким. Как правило, это процессы разрушения структуры, нагревания или охлаждения, испарения, сублимации, разделения фаз разной плотности во вращающейся среде. Однако, если исходить из со-временного понятия технологии, то перечень используемых физических яв-лений будет существенно расширен, в основном за счет способов контроля производственного процесса.
Целью настоящего курса является углубление знаний студентов о физи-ческих явлениях, положенных в основу технологических процессов пищево-го производства. К сожалению, во временных рамках курса практически не-возможно дать глубокое освещение всех физических явлений, возможных для использования в технологиях пищевого производства ( в современном понимании термина «технология» ). Поэтому авторы курса лекций огра-ничились основополагающими разделами, которые дали бы базу для даль-нейшего углубления знаний студентов в процессе самоподготовки
Глава I. Агрегатные состояния вещества. Фазы и фазовые переходы
Агрегатными
состояниями вещества считают газообразное,
жидкое и твердое состояния, переходы
между которыми сопровождаются
скачкообразным изменением физических
характеристик (плотности, молекулярного
строения и т.п.). Однако,
изменение физических характеристик
может происходить и без изменения
агрегатного состояния. Примеры – олово,
алмаз. Охлаждение расплава олова от
![]() приводит к переходу от жидкого состояния
к твердому. При дальнейшем охлаждении
при температура
приводит к переходу от жидкого состояния
к твердому. При дальнейшем охлаждении
при температура![]() происходит резкое уменьшение плотности
на
происходит резкое уменьшение плотности
на![]() ,
т.е. олово, оставаясь твердым, переходит
в другое состояние. Нагрев алмаза при
естественных условиях приводит к
уменьшению его плотности от ≈ 3,5 г/см3
до ≈ 2,2г/см3
при температуре 600 – 700 0С,
при этом алмаз теряет свои свойства:
экстремальную твердость, прозрачность,
и превращается в графит. Кроме того,
алмаз не проводит электрический ток, а
графит - электропроводен. В обоих
случаях
изменение
свойств связано с перестройкой
микроструктуры.
,
т.е. олово, оставаясь твердым, переходит
в другое состояние. Нагрев алмаза при
естественных условиях приводит к
уменьшению его плотности от ≈ 3,5 г/см3
до ≈ 2,2г/см3
при температуре 600 – 700 0С,
при этом алмаз теряет свои свойства:
экстремальную твердость, прозрачность,
и превращается в графит. Кроме того,
алмаз не проводит электрический ток, а
графит - электропроводен. В обоих
случаях
изменение
свойств связано с перестройкой
микроструктуры.
Поэтому в физике для более точного определения состояния вещества вводится понятие фазы.
Понятие о фазах и фазовых переходах
Для формулировки понятия о фазе следует ввести понятие о термодина-мической системе. Термодинамическая система – макроскопическое тело или его часть, которые можно характеризовать макроскопическими параметрами: объёмом, температурой, давлением и т. п. Термодинами-ческая система должна состоять из достаточно большого числа частиц, находящихся в состоянии хаотического движения, для описания поведения которых можно использовать статистические методы.
Фаза – однородная по химическому составу и физическим свойствам часть термодинамической системы, отделённая от других частей термодинамической системы границей раздела. Понятие фазы более конкретно отражает состояние вещества, чем понятие агрегатного состояния. Очевидно, фаза не изменяется при изменении термодинамических характеристик: температуры, давления и т.д., до тех пор, пока есть ограничивающая ее граница раздела. При исчезновении границы раздела прежняя фаза переходит в новую фазу, т.е. происходит фазовое превращение или фазовый переход.
Фазовый переход – процесс перехода вещества из одной фазы в другую при определенных значениях внешних параметров: температуры, давления, электрических и магнитных полей и т.п. В частности, фазовый переход может сопровождаться изменением агрегатного состояния вещества: плавление или кристаллизация, испарение или конденсация. В процессе фазового перехода в течение некоторого времени могут сосуществовать различные фазы вещества. Например, при температуре плавления могут сосуществовать жидкая, твердая фаза, а также в небольшом количестве газообразная фаза.
Фазовые переходы разделяются на переходы первого и второго рода.
Фазовыми переходами первого рода называются процессы, при которых плотность вещества, энтропия, термодинамические потенциалы изменяются скачком. При этом выделяется или поглощается некоторое
количество теплоты, называемое теплотой фазового перехода. Примерами
фазовых переходов первого рода являются плавление и испарение и, обрат-ные им, процессы кристаллизации и конденсации, а также сублимация и по-лиморфные превращения - изменения кристаллической решетки кристал-лов. При фазовых переходах второго рода указанные выше термодинами-
ческие характеристики не изменяются, но изменяются скачкообразно другие характеристики: теплоемкость, магнитная проницаемость, электропровод-ность, текучесть. Поглощения или выделения тепла при фазовых переходах второго рода не наблюдается.
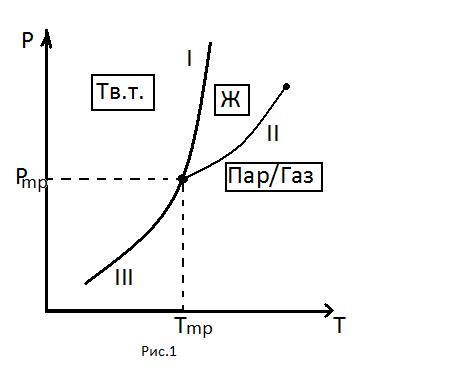
Для графического изображения процессов фазовых переходов исполь-зуются, так называемые, диаграммы состояния (Рис. 1), на которых в коор-динатах давление(p) –температура(T) представляются зависимости темпе-ратур плавления (I), испарения (II) и сублимации (III) от давления. Диаграм-ма состояния для каждого вещества индивидуальна. На (Рис. 1) представлена типичная диаграмма состояния для простого однокомпонентного вещества. Диаграммы состояния позволяют анализировать, какие фазы находятся в термодинамическом равновесии при заданных значениях давления и тем-пературы. Давление pтр и температура Tтр соответствуют тройной точке, в которой в равновесии находятся три фазы: твердое тело, жидкость и пар.
Рассмотрим
фазовые переходы с использованием
диаграммы состояния (Рис. 2). Пусть
состояние некоторой термодинамической
системы (твердого тела) определяется
точкой 1 на диаграмме. При нагреве при![]() до
тем-пературы, соответствующей точке 2,
происходит плавление. Дальнейший
до
тем-пературы, соответствующей точке 2,
происходит плавление. Дальнейший

нагрев до температуры, соответствующей точке 3, приводит к переходу сис-темы в газообразное состояние. Нагрев системы от точки 3 до точки 4 не со-провождается какими-либо фазовыми переходами. Если исходное состояние твердого тела определяется точкой 5, то при его нагревании до температуры, соответствующей точке 6, будет происходить сублимация (возгонка), т.е. прямой переход из твердого состояния в газообразное.
Следует отметить, что над поверхностью твердой или жидкой фазы всегда имеется небольшое количество газа одноименного вещества, который не находится в состоянии термодинамического равновесия.
Зависимость температуры системы от времени можно представить диа-граммой в координатах (Т,t) (Рис.3), которая представляет динамику нагрева термодинамической системы в процессе, представленном точками 1 – 2 –

Рис. 3.
3 – 4 на рис.2. Участок А графика (Рис. 3) представляет процесс нагрева до
температуры плавления (T1). В процессе плавления (участок B) температура системы остается равной Tплавл. до полного превращения твердой фазы в жидкую. Процесс сопровождается поглощением теплоты – теплоты плавления. Участок C представляет нагрев полученного количества жидкой фазы до температуры испарения (T2). Процесс испарения (участок D) проходит при постоянной температуре Tисп до полного превращения жидкой фазы в пар с поглощением теплоты испарения. Участок E соответствует нагреву полученного количества газовой фазы.
Если двигаться по графику в обратном направлении от точки 4 к точке 1, т.е. уменьшать температуру системы, то на участке D будет происходить конденсация пара с выделением теплоты конденсации, а на участке B кристаллизация жидкости с выделением теплоты кристаллизации.
Теплоты соответствующих фазовых переходов прямых и обратных процессов одинаковы: теплота плавления равна теплоте кристаллизации, а теплота испарения - теплоте конденсации. Температуры конденсации и кристаллизации равны соответственно температурам испарения и плавления.
Связь термодинамических параметров системы при фазовых переходах первого рода в химически однородных веществах описывается уравнением Клапейрона-Клаузиуса:
![]() ,
,
где
![]() - удельная теплота фазового перехода;
- удельная теплота фазового перехода;![]() и
и![]() -
давление и температура;ΔVф
-
разность удельных объемов фаз.
-
давление и температура;ΔVф
-
разность удельных объемов фаз.
Молекулярные представления о структуре вещества
Известно, что электрический заряд атома или молекулы в целом равен нулю. Однако, это утверждение справедливо лишь на больших расстояниях. Происходит это по той причине, что электронная оболочка атома не полно-стью экранирует заряд атомного ядра и за пределами атома имеется элект-рическое поле, являющееся суперпозицией двух полей. Распределение потен-циальной энергии ( E ) и силы взаимодействия частиц ( F ) в этих полях ка-чественно представлено на рис. 4. Практически напряженность электри-ческого поля, создаваемого атомами или молекулами, равна нулю на рас-стоянии r, равном нескольким диаметрам, а следовательно, равна нулю и сила их электрического взаимодействия. При сближении атомов или моле-кул на меньшее расстояние возникает сила притяжения (Рис. 4), которая

после прохождения через точку минимума потенциальной энергии ( r = r0) становится силой отталкивания. Дальнейшее сближение приводит к резкому увеличению силы отталкивания вследствие взаимодействия электронных оболочек. В точке минимума потенциальной энергии ( r = r0) сила взаимо-действия частиц равна нулю, поэтому частицы, находящиеся на таком рас-стоянии друг от друга, могут при определенных условиях создавать связан-ную пару. Величина r0 имеет порядок 10-9 м.
Устойчивому положению взаимодействующих атомов или молекул соответствуют следующие условия:
Наименьшее значение потенциальной энергии взаимодействия. (Это – фундаментальный принцип природы: система устойчива, если она обладает минимальным запасом энергии.)
Равенство нулю сил взаимодействия. Уменьшение r относитель-но r0 приводит к отталкиванию частиц, а увеличение – к их притяжению друг к другу.
Кинетическая энергия частицы, обусловленная тепловым движением, Ек пропорциональна kT. Поэтому структура совокупности молекул, т.е. агрегатное или фазовое состояние вещества будут зависеть от соотношения величин минимальной потенциальной энергии Еп min и kT.
1. Если kT << Еп min (в случае низких температур), то молекулы притя-нутся друг к другу и расположатся вплотную – вещество будет находиться в твердом состоянии.
2. В противоположном предельном случае высоких температур (kT >> Еп min) интенсивное тепловое движение молекул будет препятствовать соединению молекул в агрегаты. При соударении молекул эти агрегаты бу-дут моментально разбиваться и вещество будет находиться в газообразном состоянии. Кроме того, при достаточно большой кинетической энергии нале-тающей частицы рассеяние можно представить, как отражение от круто на-растающей «потенциальной стенки». Это является физическим обоснова-нием одного из положений модели идеального газа об абсолютной упру-гости столкновений молекул.
При промежуточных температурах, когда kT
 Еп
min
, благодаря тепловому движению, молекулы
будут непрерывно перемещаться в
пространстве, обмениваясь местами, но
не увеличивая взаимных расстояний на
величину, заметно превышающую r0;
вещество будет находиться в жидком
состоянии.
Еп
min
, благодаря тепловому движению, молекулы
будут непрерывно перемещаться в
пространстве, обмениваясь местами, но
не увеличивая взаимных расстояний на
величину, заметно превышающую r0;
вещество будет находиться в жидком
состоянии.
Приведенные здесь соображения о молекулярном строении вещества позволяют объяснить процессы фазовых переходов первого рода.
В твердой фазе, как было указано выше, молекулы или атомы находятся в связанном состоянии на расстояниях примерно равных r0. Тепловое движе-ние в этом случае проявляется в форме колебаний около положения равнове-сия в точке минимума потенциальной энергии r = r0 (Рис. 4) . Амплитуда ко-лебаний пропорциональна тепловой энергии kT. При увеличении темпера-туры отклонения частицы от положения r = r0 становятся настолько значи-тельными, что сила взаимодействия не может обеспечивать нахождение час-тиц в непосредственной связи друг с другом и при T = Tплавл происходит переход твердой фазы в жидкость. В процессе плавления тепловая энергия, передаваемая системе, расходуется только на разрушение структуры твердой фазы, поэтому дальнейшего повышения температуры не происходит до тех пор, пока в системе остаются связи, характерные для твердой фазы.
Повышение температуры сверх T = Tплавл связано с нагреванием жидкости. Характер теплового движения частиц ещё можно приблизительно считать колебательным, но уже не периодическим. При достижении температуры T = Tисп взаимодействующие частицы могут расходиться на такие расстояния, что силы взаимодействия оказываются недостаточными для удержания частиц в какой-либо близости друг от друга. Таким образом система переходит в газообразное состояние. Температура системы остается неизменной ( T = Tисп ) до тех пор, пока остатки жидкой фазы не перейдут в газообразное состояние. По окончании процесса испарения температура снова может повышаться, но при этом будет происходить нагрев уже газовой фазы. Причем, чем выше температура, тем ближе взаимодействие частиц будет приближаться к модели идеального газа. Верхним пределом температуры нагрева газа является температура начала ионизации газовых молекул, при которой газ переходит в состояние плазмы. Характер поведения плазмы имеет свои особенности, не учитываемые в настоящем рассмотрении.
Если систему охлаждать, начиная с газообразного состояния, то все из-ложенные выше рассуждения справедливы с точностью до наоборот. При снижении температуры до T = Tконд = Tисп происходит фазовый переход конденсации обратный испарению, при T = Tкрист = Tплавл процесс кри-сталлизации - обратный процессу плавления.
Твердые тела
Особенностью твердых тел, отличающей их от газов и жидкостей, являя-ется способность сохранять форму за счет внутренних сил. Однако, за таким простым определением скрывается большое разнообразие объектов, которое удовлетворяют указанному свойству. По признаку структуры это разнооб-разие разобьем на следующие группы: кристаллические тела (поли- и монокристаллические), аморфные тела, полимеры и композиты. Рассмотрим вкратце их свойства.
Кристаллические вещества. Кристаллические вещества имеют правильную, упорядоченную структуру в областях различной протяженности. Упорядоченно расположенные молекулы и атомы соответствуют минимальной потенциальной энергии частиц и являются наиболее стабильными образованиями. Эти, упорядоченно расположенные частицы, образуют пространственную кристаллическую решетку, т.е. регулярное расположение частиц (атомов, молекул, ионов), характеризующееся периодической повторяемостью в трех измерениях.
Кристаллические решетки классифицируются как по характеру физических связей частиц, их составляющих, так и по пространственному расположению частиц.
По характеру связи атомов в твердом теле кристаллы подразделяются на:
- атомные – в узлах решетки расположены нейтральные атомы, связан-ные между собой ковалентными (гомеополярными) связями;
- молекулярные – в узлах расположены молекулы, связанные ван-дер-ваальсовыми силами;
- металлические – в узлах расположены положительные ионы метал-лов и связь между ними осуществляется через посредство электронного «газа», создаваемого в металле валентными электронами;
- ионные - в узлах кристаллической решётки расположены правильно чередующиеся ионы, составляющие молекулу с ионной связью ( например ионы Na+ и Cl- в кристалле NaCl ), в этом случае ионы создают свои периодические структуры, которые пространственно совмещаются в еди-ную решетку кристалла;
- кристаллы с водородными связями, которые формируются молеку-лами, имеющими в своей структуре атом водорода, связанный ковалентной связью с электроотрицательным атомом ( кристаллы льда, кристаллы слож-ных органических и биологических веществ).
Таблица. Энергии связи кристаллов различного типа
|
Тип кристалла |
Энергия связи(кДж/моль) |
|
Ионные( NaCl, LiF, оксиды ) |
754 ( NaCl ) 1006 ( LiF ) |
|
Валентные ( атомные )( C, Si,Ge ) |
712 ( алмаз ) |
|
Металлические( Na, Fe, Cu ) |
110 ( Na ) 394 ( Fe ) |
|
Кристаллы с водородными связями ( H2O, HF и т.п.) |
|
|
Молекулярные( Ar, CH4 ) |
7,54 ( Ar ) 10,06 ( CH4 ) |
Молярные энергии связи различных типов кристаллов, характеризую-щие прочность связей атомов и молекул в структуре кристаллов, приведены в таблице.

Рис. 5.
Кристаллическую решетку можно получить геометрически, если провес-ти три системы параллельных плоскостей, пересекающихся между собой под углами α, β и γ, а также отстоящих друг от друга на расстояния a, b и c.
Примеры элементарных ячеек, образованных соседними парами плоскостей, приведены на рис. 5.
В зависимости от соотношения между a, b и c, а также от углов α, β и γ различают 7 кристаллографических систем (сингоний) (Рис. 5).
1. Кубическая (или правильная) – a = b = c; α = β = γ =900 (Рис. 5б).
2. Гексагональная. 3. Тетрагональная. 4. Тригональная. 5. Ромбическая.
6. Моноклинная. 7. Триклинная - a ≠ b ≠ c; α ≠ β ≠ γ ≠900 (Рис. 5а).
Наиболее простыми и распространенными кристаллическими решет-ками являются кубические решетки, которые бывают простыми, объемоцент-рированными (о.ц.к.) и гранецентрированными (г.ц.к.). В простой кубической решетке частицы располагаются в вершинах куба. В решетке о.ц.к. к части-цам, расположенным в вершинах, добавлены частицы в центрах кубов, а в решетке г.ц.к. - в центрах граней кубов. В каждой ячейке решетки содер-жится: для простой кубической решетки - 8 частиц, для о.ц.к. решетки - 9 и для г.ц.к. решетки - 14 частиц.
В большинстве случаев кристаллические вещества состоят из множе-ства хаотически ориентированных друг относительно друга отдельных мел-ких кристаллов (зерен или кристаллитов). Такие структуры называются по-ликристаллами. При определенных условиях кристаллизации упорядо-ченная кристаллическая структура может занимать значительный объем и называется монокристаллом.
Более частое образование поликристаллов обусловлено особенностью естественного процесса кристаллизации. При кристаллизации из расплава вещества необходимо не только снижать температуру, но и иметь центры кристаллизации. Образование кристаллов вокруг отдельных центров происходит хаотически. Поэтому в больших объемах поликристаллов, охватывающих большое количество кристаллитов, свойства вещества изотропны ( одинаковы в среднем во всех направлениях ).
Монокристаллы встречаются как в природе (крупные алмазы, горный хрусталь, кристаллы драгоценных минералов), так и в технике. В последнем случае их выращивают по специальной технологии.
Аморфные вещества. Структура аморфных веществ полностью соответ-ствует структуре жидкостей, т.е. взаимодействие между молекулами обеспе-чивает только ближний порядок. Поэтому свойства аморфных тел не зависят от направления (изотропны). Однако, в отличие от жидкостей подвижность молекул в аморфных веществах мала. Образование аморфных твердых тел объясняется высокой вязкостью исходных жидкостей при температурах, близких к температуре кристаллизации. Поэтому структурная перестройка жидкости не успевает отслеживать снижение температуры. В результате жидкость оказывается переохлажденной и в отсутствие центров кристалл-лизации сохраняет структуру, характерную для жидкости. Примерами аморфных веществ является стекло, аморфный углерод (уголь), смолы и т.п. Аморфное состояние вещества не является стабильным и может переходить в кристаллическое. Так стекло со временем начинает кристаллизоваться и мут-неет.
Полимеры. Из химии известно, что некоторые простые молекулы орга-нических веществ, такие как этилен, винилхлорид, стирол и т.п., склонны к полимеризации, т.е. к образованию при определенных условиях длинных цепей их простых молекул, объединенных химическими связями. Линейные молекулы полимера могут взаимодействовать между собой за счет сил притя-жения отдельных участков цепей или, при использовании некоторых техно-логий, можно получить химические связи между цепями. Например, давно известный процесс вулканизации, позволяющий получать из природного по-лимера каучука техническую резину за счет поперечных химических связей линейных цепей посредством атомов серы.
Композиты. Материалы достаточно новые, но получившие признание во многих отраслях техники и прежде всего в космической и авиационной. Принцип построения композитных материалов заключается в следующем. Если тончайшие нити какого-либо высокопрочного материала, например, стекла, углерода, связать между собой в единый монолит каким-либо связующим веществом, то полученный материал будет обладать высокой прочностью при относительно малом весе. На основе этой идеи были получены такие материалы, как стекло- и углепластики.
