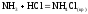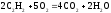- •3506 Збірник індивідуальних завдань
- •Біогенні елементи
- •Завдання у тестовій формі
- •Комплексні сполуки Завдання у тестовій формі Завдання 1–90 мають чотири варіанти відповідей, з яких лише один правильний. Оберіть, на вашу думку, правильний варіант відповіді.
- •Розчини
- •Кількісний склад розчинів
- •Колігативні властивості розчинів
- •Рівновага у розчинах електролітів
- •Термодинаміка
- •Кінетика
- •Електрохімічні та електрокінетичні явища в біологічних системах
- •Окисно-відновні реакції
- •Гальванічні елементи
- •Фізико-хімія поверхневих явищ. Дисперсні системи
- •Завдання у тестовій формі
- •Список літератури
- •Додаток а
- •(Обов’язковий)
- •Варіанти індивідуальних завдань
Термодинаміка
На підставі стандартних ентальпій утворення
 і абсолютних ентропій
і абсолютних ентропій речовин
визначте:
речовин
визначте:
 ,
, ,
, хімічної реакції. Зробіть висновок
щодо термодинамічної імовірності
перебігу реакції за стандартних умов.
Розрахунки провести за рівняннями
реакцій, наведеними у таблиці 1,
використовуючи довідкові дані, наведені
у таблиці 2.
хімічної реакції. Зробіть висновок
щодо термодинамічної імовірності
перебігу реакції за стандартних умов.
Розрахунки провести за рівняннями
реакцій, наведеними у таблиці 1,
використовуючи довідкові дані, наведені
у таблиці 2.Таблиця 1
Варіант
Рівняння реакції
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
Продовження таблиці 1
Варіант
Рівняння реакції
18
19
20
21
22
23
24
25
26
27
28
29
30
Таблиця 2. Стандартні ентальпії утворення
 ,
стандартні ентропії
,
стандартні ентропії деяких
неорганічних та органічних речовин
при 298,15К٭
деяких
неорганічних та органічних речовин
при 298,15К٭Речовина і стан
 ,
,кДж/моль
 ,
,Дж/(моль. К)
C (к, графіт)
0
5,74
CCl4 (р)
-135,4
214,4
CH3OH (р)
-239,45
126,6
CH4 (г)
-74,81
186,31
CO (г)
-110,52
197,54
Продовження таблиці 2
Речовина і стан
 ,
,кДж/моль
 ,
,Дж/(моль. К)
CO2 (г)
-393,51
213,67
C2H2 (г)
226,0
200,83
C2H4 (г)
52,5
219,3
C2H6 (г)
-84,7
229,5
CS2 (р)
88,70
151,04
CaC2 (к)
-60
70,0
CaO (к)
-635,1
38,1
Cl2 (г)
0
222,98
HCl (г)
-92,31
186,79
Cu (к)
0
33,1
CuO (к)
-162,0
42,63
Fe (к)
0
27,15
FeO (к)
-265
60,8
Fe2O3 (к)
-822
87
Fe3O4 (к)
-1117,13
146,19
H2 (г)
0
130,52
N2 (г)
0
191,5
NH3 (г)
-46,2
192,6
NH4Cl (к)
-314,2
95,81
NO (г)
90,2
210,6
NO2 (г)
33,5
240,2
O2 (г)
0
205,04
H2O (г)
-241,82
188,72
H2O (р)
-285,83
70,08
H2O2 (р)
-187,78
109,5
P2O5 (к)
-1507,2
140,3
PH3 (г)
5,4
210,2
PbО (к)
-217,61
68,70
PbS (к)
-100
91,2
PbSО4 (к)
-920,48
148,57
Продовження таблиці 2
Речовина і стан
 ,
,кДж/моль
 ,
,Дж/(моль. К)
S (к)
0
31,9
SO2 (г)
-296,90
248,07
SO3 (г)
-395,8
256,7
H2S (г)
-20,9
205,69
H2SO4 (р)
-814,2
156,9
Ti (к)
0
30,63
TiO2 (к)
-943,9
50,33
٭Наведені у таблиці величини взято з довідника (Термические константы веществ / под ред. В.П. Глушко. - М: ВИНИТИ, 1965-1981. Вып.І-Х)
Кінетика
Розрахуйте, у скільки разів зросте швидкість хімічної реакції при підвищенні температури на
 приназваному
значенні температурного коефіцієнта
приназваному
значенні температурного коефіцієнта
 (табл.
3).
(табл.
3).
Таблиця 3
Номер завдання
Номер завдання
1
20
4
6
100
2
2
30
4
7
30
3
3
40
3
8
60
3
4
50
3
9
50
2
5
60
2
10
40
4
У таблиці 2 зазначене значення температурного коефіцієнта хімічної реакції
 .
При температурі 150С
реакція закінчується за
.
При температурі 150С
реакція закінчується за
 хвилин. Визначте час перебігу реакції
при температурі 350С
(табл. 4).
хвилин. Визначте час перебігу реакції
при температурі 350С
(табл. 4).Таблиця 4
Номер завдання
Номер завдання
9
2
20
14
2
40
Продовження таблиці 4
Номер завдання
Номер завдання
10
2,5
12,5
15
4
160
11
3
27
16
2
60
12
2
16
17
3
81
13
2,5
25
18
3,5
12,25
На скільки градусів необхідно підвищити температуру, щоб швидкість реакції зросла в n разів при даному значенні
 (табл. 5).
(табл. 5).Таблиця 5
Номер завдання
n
Номер завдання
n
19
9
3
25
64
2
20
130
2
26
174
3
21
40
2,5
27
81
3
22
241
3
28
12,25
3,5
23
80
3
29
32
2
24
16
2,5
30
27
3
Складіть вираз константи рівноваги оборотної реакції, наведеної в таблиці. Визначте, в який бік зміститься рівновага оборотної реакції: а) при підвищенні температури (р=const); б) при підвищенні тиску (T=const) (табл. 6).
Таблиця 6
Номер завдання
Рівняння хімічної реакції
31
COCI2
 CO + CI2
CO + CI2
112,5
32
CO2 + 2H2
 CH3OH(г)
CH3OH(г)
193,3
33
2N2O
 2N2
+ O2
2N2
+ O2
-163,1
34
2NO +CI2
 2NOCI
2NOCI
-73,6
35
3O2
 2O3
2O3
184,6
36
CO +H2O(г)
 CO2
+ H2
CO2
+ H2
-41,2
Продовження таблиці 6
Номер завдання
Рівняння хімічної реакції
37
H2 + I2
 2HI
2HI
51,9
38
N2 + O2
 2NO
2NO
180,7
39
2H2 + O2
 2H2O(г)
2H2O(г)
483,7
40
2CO +O2
 2CO2
2CO2
-566
41
N2O4
 2NO2
2NO2
58
42
2NO +O2
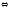 2NO2
2NO2
-113
43
2SO3
 2SO2+O2
2SO2+O2
196,6
44
3H2 + N2
 2NH3
2NH3
-92,5
45
2HBr
 H2
+ Br2
H2
+ Br2
72,5
46
4HCI + O2
 2H2O(г)+
2CI2
2H2O(г)+
2CI2
-114,5
47
N2 +2O2
 2NO2
2NO2
67,5
48
C + H2O(г)
 CO + H2
CO + H2
131
49
2NH3
 N2
+ 3H2
N2
+ 3H2
92,5
50
2SO2 +O2
 2SO3
2SO3
-196,6
51
2NOCI
 2NO+CI2
2NO+CI2
73,6
52
H2 + CO2
 CO + H2O(г)
CO + H2O(г)
41,2
53
CI2 + CO
 COCI2
COCI2
-112,5
54
2NO2
 N2O4
N2O4
-58
55
2H2S + 3O2
 2H2O
+ 2SO2
2H2O
+ 2SO2
-561,1
56
H2 + Br2
 2HBr
2HBr
-72,5
57
2NH3
 3H2
+ N2
3H2
+ N2
92,5
58
2O3
 3O2
3O2
-184,6
59
2H2O(г)+ 2CI2
 4HCI + O2
4HCI + O2
114,5
60
2HI
 H2
+ I2
H2
+ I2
-51,9
Розрахуйте, як зміниться швидкість прямої та зворотної реакцій, якщо об’єм газової суміші змінити в n разів (табл. 7).
Таблиця 7
Варіант
Рівняння хімічної реакції
Зміна об’єму газової суміші
61
2SO2 +O2
 2SO3
2SO3
збільшити у 3 рази
62
2NO +O2
 2NO2
2NO2
збільшити у 3 рази
63
3H2 + N2
 2NH3
2NH3
збільшити у 3 рази
64
2NO +CI2
 2NOCI
2NOCI
збільшити у 4 рази
65
CO +H2O(г)
 CO2
+ H2
CO2
+ H2
зменшити у 3 рази
66
N2 + O2
 2NO
2NO
збільшити у 3 рази
67
4NH3+5O2
 4NO+
6H2O
4NO+
6H2O
зменшити у 2 рази
68
4NH3+3O2
 2N2
+ 6H2O
2N2
+ 6H2O
зменшити у 2 рази
69
N2O4
 2NO2
2NO2
збільшити у 4 рази
70
4HCI+O2
 2H2O(г)+
2CI2
2H2O(г)+
2CI2
збільшити у 2 рази
71
2H2S+3O2
 2H2O+2SO2
2H2O+2SO2
збільшити у 2 рази
72
3O2
 2O3
2O3
збільшити у 3 рази
73
Cl2 + CO
 COCI2
COCI2
збільшити у 4 рази
74
2NO +Cl2
 2NOCl
2NOCl
збільшити у 2 рази
75
3H2+N2
 2NH3
2NH3
збільшити у 2 рази
76
2H2S+3O2
 2H2O
+ 2SO2
2H2O
+ 2SO2
збільшити у 3 рази
Розрахуйте, як зміниться швидкість прямої та зворотної реакцій, якщо тиск змінити в n разів ( продовження табл. 7):