
- •1)Вид волновой функции и вероятности нахождения электрона в основном состоянии атома водорода. 2)Вид волновой функции и вероятности нахождения электрона в первом возбужденном состоянии атома водорода.
- •14 (1). Экспериментальные доказательства существования спина и магнитного момента электрона.
- •16 (0). Строение электронных оболочек. Объяснение периодической системы д.И.Менделеева.
- •18 (2). Векторная модель многоэлектронного атома.
- •19 (2). Квантовые состояния многоэлектронных атомов. Правило Хунда.
- •21 (2). Эффект Зеемана.
- •22 (1). Рентгеновские спектры. Закон Мозли.
16 (0). Строение электронных оболочек. Объяснение периодической системы д.И.Менделеева.
В 1869г. Д. И. Менделеевым был открыт периодический закон и построена периодическая система элементов, объяснение которой – одна из важнейших задач атомной физики.
Сформулируем прежде всего те принципы, на которых основано это объяснение:
1). Состояние электрона в атоме полностью определяется четырьмя квантовыми числами:
главным квантовым числом n= 1, 2, 3, …; орбитальным квантовым числом l = 0, 1, …,n-1; магнитным квантовым числомm = 0, ±1, ±2, …, ±l; магнитным спиновым квантовым числомms= +1/2, -1/2.
2) Принцип Паули: В атоме может существовать только один электрон в состоянии, характеризуемом данными значениями четырех квантовых чисел; т.е. два электрона в одном и том же атоме должны различаться значениями по крайней мере одного квантового числа.
3) Атом (как и любая система) устойчив тогда, когда находится в состоянии с наименьшей возможной энергией.
Совокупность электронов, обладающих одинаковым главным квантовым числом образует слой. Слои имеют названия :

Совокупность электронов, имеющих одинаковые nи l, образуетоболочку. Названия оболочек :

Принцип Паули ограничивает число электронов на той или иной электронной оболочке. Действительно, электроны в невозбужденном атоме стремятся перейти в состояние с наименьшей энергией (в устойчивое состояние), которое соответствует минимальным значениям главного и орбитального чисел. Однако возможность такого перехода ограничена принципом Паули. Поэтому электроны в невозбужденном атоме находятся в таких состояниях, при которых энергия атома является наименьшей, но распределение по состояниям удовлетворяет принципу Паули.
Установим теперь, сколько электронов может находится на оболочке и в атоме.
Т.к. число msможет иметь два значения, то в атоме может быть два электрона с одинаковыми числамиn, l, m. При заданномlквантовое числоmможет иметь (2l+1) значений, следовательно, на оболочке может быть 2(2l+1) электронов, т.е.

При заданном nквантовое число l может приниматьnзначений: 0, 1, 2, …,n-1. Поэтому максимальное число электронов в слое можно выразить суммой арифметической прогрессии:
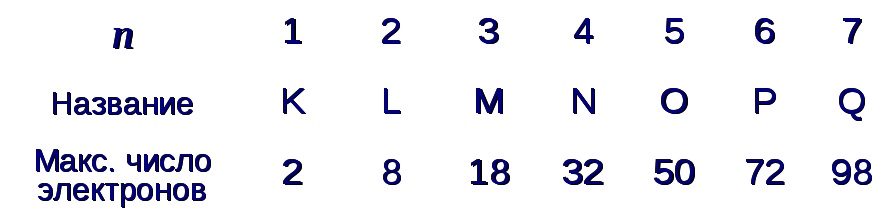

(16.1)
Конфигурация электронных оболочек атомов записывается с помощью следующих обозначений. Каждая оболочка обозначается соответствующим nи буквой, обозначающейl, а индексом справа вверху обозначается число электронов. Например:
Водород 1s1
Гелий 1s2
Литий 1s22s1
Углерод 1s22s22p2
Кислород 1s22s22p4
Аргон 1s22s22p63s23p6
Итак, принцип Паули дает следующую картину построения электронной оболочки атомов. Каждый вновь присоединяемый электрон связывается в состоянии с наименьшими возможными квантовыми числами. Эти электроны постепенно заполняют слой с одним и тем же главным квантовым число n. Когда построение слоя заканчивается, получается устойчивая структура (инертный газ). Следующий электрон начинает заполнение уже нового слоя и т.д. Эта идеальная схема соблюдается до 18 элемента таблицы Менделеева (до аргона). Начиная с 19-го элемента (калия) наблюдаются отступления от идеальной схемы. Причина этих отступлений заключается в том, что идеальная схема не учитывает взаимодействия электронов между собой.
Например, 19-ый электрон калия должен (согласно идеальной схеме) находиться в 3d-оболочке. Однако химические и спектроскопические данные указывают на то, что этот электрон находится в 4s-оболочке. Детальный расчет с учетом взаимодействия электронов показывает, что состояние 3dдействительно отвечает большей энергии, чем 4s. По этой же причине 20-ый электрон кальция тоже присоединяется в 4s-состояние, а нормальное заполнение 3d-оболочки начинается у скандия. Аналогичное нарушение нормального порядка наблюдается у рубидия, цезия, франция. Другое отступление от нормального порядка заполнения слоев имеет место у редких земель (Z=58 - 71): идет заполнение 4f-оболочки после того, как заполнены оболочки 5s, 5pи 6s.
Таким образом, атомная физика полностью объяснила периодическую таблицу элементов. Причем теория не только объяснила, но и уточнила таблицу. До 1922г. элемент Z=72 не был известен. Он был предсказан Менделеевым, и ему было оставлено место в группе редких земель. Однако по теоретическим соображениям, группа редких земель должна содержать 14 элементов (т.к. на 4fоболочке может находиться 14 элементов), т.е. должна заканчиваться 71-м элементом, а элементZ=72 должен быть аналогом циркония и титана. На это впервые указал Н. Бор, и вскоре элемент 72 (гафний) был открыт в циркониевых рудах и по своим химическим и оптическим свойствам оказался аналогом титана и циркония, а не элементов группы редких земель.
17(1). Полный момент импульса электрона в атоме. Символические обозначения термов. Правила отбора для оптических переходов.
Операции с векторами LиSможно производить с помощью следующего полуклассического метода. Вектора складываются по обычным правилам параллелограмма:
J = L + S, (17.1)
в![]()
![]() результате получается векторJ- вектор полного момента импульса. В это
чисто классическое правило вносятся
следующие поправки, характерные для
квантовой механики. Во-первых, углы
между векторамиLиSне могут быть произвольными. ВекторLможет располагаться относительно
вектораJтолько под
такими углами, чтобы его проекция на
направлениеJ была
равна , гдеm= 0, ±
1, …, ±l. Аналогичное
требование предъявляется и к ориентации
вектораS: его проекция
на направлениеJ
равна , гдеms=
±1/2. Таким образом, угол междуLиSможет принимать
ряд дискретных значений.
результате получается векторJ- вектор полного момента импульса. В это
чисто классическое правило вносятся
следующие поправки, характерные для
квантовой механики. Во-первых, углы
между векторамиLиSне могут быть произвольными. ВекторLможет располагаться относительно
вектораJтолько под
такими углами, чтобы его проекция на
направлениеJ была
равна , гдеm= 0, ±
1, …, ±l. Аналогичное
требование предъявляется и к ориентации
вектораS: его проекция
на направлениеJ
равна , гдеms=
±1/2. Таким образом, угол междуLиSможет принимать
ряд дискретных значений.
В![]() о-вторых,
полный моментJ, как
всякий момент импульса в квантовой
механике имеет свое квантовое числоj,
такое, что (17.2)
о-вторых,
полный моментJ, как
всякий момент импульса в квантовой
механике имеет свое квантовое числоj,
такое, что (17.2)
Ч![]() ислоjназываетсявнутренним
квантовым числом, оно может принимать
значения:
ислоjназываетсявнутренним
квантовым числом, оно может принимать
значения:
(17.3)
Ф![]()
![]() ормула
(17.3) записана в общем виде для любой
величины вектораS.
Если рассматривается всего один электрон,
тоs=1/2, и тогдаjможет принимать всего два значения:
и (17.4)
ормула
(17.3) записана в общем виде для любой
величины вектораS.
Если рассматривается всего один электрон,
тоs=1/2, и тогдаjможет принимать всего два значения:
и (17.4)
П![]()
![]() роекция
вектораJна какое
либо направлениеZ(ось
квантования, направление внешнего
магнитного или электрического поля и
т.д.) в соответствии с законами квантовой
механики равна: (17.5)
роекция
вектораJна какое
либо направлениеZ(ось
квантования, направление внешнего
магнитного или электрического поля и
т.д.) в соответствии с законами квантовой
механики равна: (17.5)
где (17.6)
т.е. mjможет принимать (2j+ 1) значений. Числоmjназываетсямагнитным внутренним квантовым числом. Еслиj- полуцелое число, то в этом случаеmjне принимает значение 0.
Эти правила сложения векторов LиS составляютвекторную модель атома, имеющую большое практическое значение: модель проста и наглядна, а ее результаты совпадают с экспериментом и с результатами точного квантовомеханического решения.
Р![]() азличные
состояния атома (термы) принято обозначать
специальными символами, по которым
сразу можно указать все квантовые числа.
Общий вид такого обозначения:
(17.7)
азличные
состояния атома (термы) принято обозначать
специальными символами, по которым
сразу можно указать все квантовые числа.
Общий вид такого обозначения:
(17.7)
где квантовое число Lобозначает орбитальный момент всего атома (так же, как и для отдельного электрона):L= 0 1 2 3 4 …
Символ SPDFG…
С![]() права
внизу записывается квантовое число
полного момента атома, слева вверху –
кратность (мультиплетность) терма:
(17.8) гдеS– спиновое
квантовое число всего атома.
права
внизу записывается квантовое число
полного момента атома, слева вверху –
кратность (мультиплетность) терма:
(17.8) гдеS– спиновое
квантовое число всего атома.
Т![]() .к.
терм - это характеристика всего атома,
то используются прописные буквы вместо
строчных (которые применяются для
отдельного электрона). Примеры:
.к.
терм - это характеристика всего атома,
то используются прописные буквы вместо
строчных (которые применяются для
отдельного электрона). Примеры:
Запись (читается "дублет Р три вторых") означает, что L= 1,S= 1/2,J= 3/2.
З![]()
![]() апись
(читается "синглетSноль") означает, чтоL= 0,S= 0,J=
0.
апись
(читается "синглетSноль") означает, чтоL= 0,S= 0,J=
0.
Запись (читается "триплет Dдва") означает, чтоL= 2,S= 1,J= 2.
Правила отбора для оптических переходов
С![]() огласно
комбинационному принципу, волновое
число любой спектральной линии (в
испускании и поглощении) может быть
представлена как разность двух термов
(17.9)
огласно
комбинационному принципу, волновое
число любой спектральной линии (в
испускании и поглощении) может быть
представлена как разность двух термов
(17.9)
Но обратное утверждение не всегда справедливо: не всякая комбинация термов дает частоту, сjответствующую реально наблюдаемой спектральной линии. Существуют определенные правила отбора, указывающие, какие комбинации термов возможны, какие нет (точнее маловероятны или даже имеют нулевую вероятность).
Э![]() ти
правила связаны с законами сохранения
момента импульса и четности в квантовых
переходах. В частности установлено, что
в атоме наиболее вероятны переходы
между состояниями, при которых квантовые
числаl иmменяются на величину:
(17.10)
ти
правила связаны с законами сохранения
момента импульса и четности в квантовых
переходах. В частности установлено, что
в атоме наиболее вероятны переходы
между состояниями, при которых квантовые
числаl иmменяются на величину:
(17.10)
причем правило отбора для магнитного квантового числа mнадо учитывать только в том случае, если атом находится в магнитном поле. На главные квантовые числаn1 иn2 никаких ограничений не накладывается, т.е. величина ∆nможет быть любой.
Если условие (17.10) соблюдается, то такие переходы называются разрешенными. Другие переходы маловероятны, и их называют запрещенными. Другими словами, разрешены переходы между соседними по lуровнями, т.е. междуs- иp-состояниями, междуp- иd-состояниями, междуd- иf-состояниями и т.д.
Интенсивность спектральной линии определяется вероятностью перехода электрона из одного состояния в другое. В теории Бора это можно было представить наглядно в виде пространственного перемещения электрона с одной орбиты на другую. В квантовой теории никаких орбит нет, а переход связан с представлением об изменении волновой функции.
В![]() ероятность
перехода определяется так называемым
матричным элементом: интегралом вида
ероятность
перехода определяется так называемым
матричным элементом: интегралом вида
(17.11)
который представляет собой дипольный момент ex, усредненный между состояниямиYmиYn. Вычисления этого элемента и приводят к сформулированным выше правилам отбора. Отметим еще раз, что правила отбора имеют вероятностный характер: "запрещенные" спектральные линии иногда можно наблюдать, но они имеют малую интенсивность.
