
- •1)Вид волновой функции и вероятности нахождения электрона в основном состоянии атома водорода. 2)Вид волновой функции и вероятности нахождения электрона в первом возбужденном состоянии атома водорода.
- •14 (1). Экспериментальные доказательства существования спина и магнитного момента электрона.
- •16 (0). Строение электронных оболочек. Объяснение периодической системы д.И.Менделеева.
- •18 (2). Векторная модель многоэлектронного атома.
- •19 (2). Квантовые состояния многоэлектронных атомов. Правило Хунда.
- •21 (2). Эффект Зеемана.
- •22 (1). Рентгеновские спектры. Закон Мозли.
1 2
(0). Водородоподобный атом. Орбитальный
и собственный моменты импульса электрона
и описание различных состояний электрона
в атоме.
2
(0). Водородоподобный атом. Орбитальный
и собственный моменты импульса электрона
и описание различных состояний электрона
в атоме.
Уравнение Шредингера для водородоподобного атома имеет вид: (12.1)
Решение этого уравнения впервые получил Шредингер в 1926 году. Решение можно найти теми же методами, которыми были решены предыдущие задачи, но в данном случае процедура решения оказывается довольно громоздкой, поэтому мы решать это уравнение не будем, а рассмотрим основные результаты решения. Точное решение приведено во многих курсах квантовой механики, полностью совпадает с экспериментальными данными, что является решающим подтверждением справедливости квантовомеханического подхода к изучению явлений микромира.
Э нергия
электрона определяется формулой, в
точности совпадающей с результатом,
полученным в рамках теории Бора:
нергия
электрона определяется формулой, в
точности совпадающей с результатом,
полученным в рамках теории Бора:
(12.2)
где n= 1, 2, 3, ... - "главное квантовое число". Часто применяются следующие условные обозначения и термины:K-слой,L-слой и т.д.:
![]()
 Момент
импульса электрона в атоме определяется
орбитальным квантовым числом l:
(12.3)
Момент
импульса электрона в атоме определяется
орбитальным квантовым числом l:
(12.3)
где орбитальное квантовое число l может принимать значенияl = 0, 1, 2, ..., (n-1).
Часто применяются следующие условные обозначения и термины: s-оболочка,p-оболочка и т.д.:
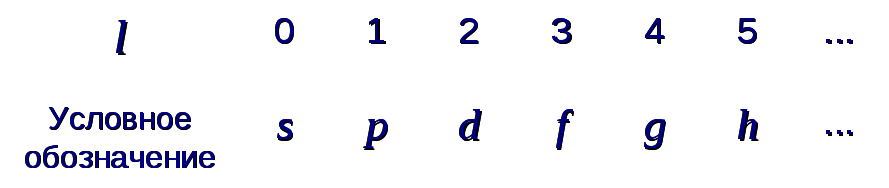
П![]() роекция
момента импульса на выделенное направление
(например, на направление внешнего
магнитного поля) определяется магнитным
квантовым числом m:
(12.4)
роекция
момента импульса на выделенное направление
(например, на направление внешнего
магнитного поля) определяется магнитным
квантовым числом m:
(12.4)
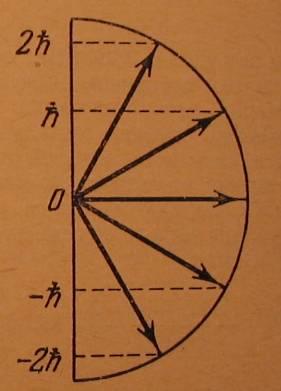
Магнитное квантовое число может принимать значения: m = 0, ±1, ±2, …, ± l,или:m = -l, -l+1, -l+2,..., 0, 1, 2, ..., lвсего (2l+ 1) значений.
Для наглядности пространственное квантование вектора момента импульса часто изображают графически на векторных диаграммах:
l = 1l = 2

 Спин
(собственный механический момент
импульса электрона) определяется
спиновым квантовым числомs,
которое для одного электрона имеет
фиксированное значениеs= 1/2:
Спин
(собственный механический момент
импульса электрона) определяется
спиновым квантовым числомs,
которое для одного электрона имеет
фиксированное значениеs= 1/2:
(12.5)→
П![]() роекция
спина на выделенное направление
(например, на направление внешнего
магнитного поля) определяется магнитным
спиновым квантовым числомms:
(12.6)
роекция
спина на выделенное направление
(например, на направление внешнего
магнитного поля) определяется магнитным
спиновым квантовым числомms:
(12.6)
![]()
Магнитное спиновое квантовое число msможет принимать два значения: (12.7)
1)Вид волновой функции и вероятности нахождения электрона в основном состоянии атома водорода. 2)Вид волновой функции и вероятности нахождения электрона в первом возбужденном состоянии атома водорода.
1
 )
2)
)
2)
Уровни энергии атома водорода. Толщина линии соответствует вероятности перехода. (рис в книге).
Итак, состояние электрона в атоме определяется четырьмя квантовыми числами, перечисленными выше:
главным n:n= 1, 2, 3, ...
орбитальным l:l = 0, 1, 2, ..., (n-1)
магнитным m: m = 0, ±1, ±2, …, ± l,
магнитным спиновым ms :
С огласнопринципу Паули, для каждого электрона
в атоме эта четверка чисел должна быть
уникальной, или по-другому: в атоме не
может быть двух электронов с одинаковой
четверкой квантовых чисел, т.е. хотя бы
одним квантовым числом каждый электрон
должен отличаться от всех остальных
электронов в атоме.
Число различных состояний,
соответствующих данному орбитальному
квантовому числуl,
рав-но2(2l+1) (это
максимально возможное число электронов
на оболочке), а число состояний,
соответствующих данному главному
квантовому числуn,
равно: (12.8)
огласнопринципу Паули, для каждого электрона
в атоме эта четверка чисел должна быть
уникальной, или по-другому: в атоме не
может быть двух электронов с одинаковой
четверкой квантовых чисел, т.е. хотя бы
одним квантовым числом каждый электрон
должен отличаться от всех остальных
электронов в атоме.
Число различных состояний,
соответствующих данному орбитальному
квантовому числуl,
рав-но2(2l+1) (это
максимально возможное число электронов
на оболочке), а число состояний,
соответствующих данному главному
квантовому числуn,
равно: (12.8)
это максимально возможное число электронов на слое.
13 (1). Спин и магнитный момент электрона.
Спектры атомов щелочных металлов
С![]() пектры
атомов щелочных металлов схожи со
спектрами водорода: они также состоят
из серий, причем линии в серии закономерно
сгущаются к границе серии. Общий вид
термов щелочных атомов имеет вид
пектры
атомов щелочных металлов схожи со
спектрами водорода: они также состоят
из серий, причем линии в серии закономерно
сгущаются к границе серии. Общий вид
термов щелочных атомов имеет вид
(13.1) где σ – некоторая поправка, различная для различных серий.
На рисунке изображены (в книге) уровни энергии и переходы в атоме лития. Видно качественное сходство с атомом водорода. Однако изучение структуры спектральных линий указывает на то, что уровни p,d,f, …, - т.е. все, кромеs– уровней – расщеплены на два (т.е.являются двойными).
Дублетная структура термов, а также некоторые другие экспериментальные факты, например аномальный эффект Зеемана, который мы рассмотрим позднее, вызвали в свое время (20-е годы прошлого столетия) большие затруднения у физиков. Эти факты в конце концов привели к гипотезе о том, что у электрона существует собственный механический момент (спин) и связанный с ним магнитный момент. Эта гипотеза была выдвинута Уленбеком и Гаудсмитом (UhlenbeckG.,GoudsmitS., 1925 г).
В![]() еличина
механического момента – спина – может
быть определена из факта дублетности
термов атомов щелочных металлов. Как
всякий момент спин электрона должен
быть квантованным. Его величину принято
обозначать буквойS(не
путать с обозначениемs-термов),
и выражать с помощью соответствующего
квантового числаs:
(13.2)
еличина
механического момента – спина – может
быть определена из факта дублетности
термов атомов щелочных металлов. Как
всякий момент спин электрона должен
быть квантованным. Его величину принято
обозначать буквойS(не
путать с обозначениемs-термов),
и выражать с помощью соответствующего
квантового числаs:
(13.2)
Д алее
число возможных проекций спина на
выбранное направление равно 2s+1.
С другой стороны опыт показывает, что
термы дублетны, поэтому спин имеет
только две возможных ориентации.
Следовательно
алее
число возможных проекций спина на
выбранное направление равно 2s+1.
С другой стороны опыт показывает, что
термы дублетны, поэтому спин имеет
только две возможных ориентации.
Следовательно
2s+1 = 2, отсюдаs= 1/2,
Кроме механического момента, электрон имеет и магнитный момент. Орбитальному движению электрона соответствует орбитальный магнитный момент, а спину – собственный магнитный момент.
О![]()
![]() пределим
в рамках теории Бора величину орбитального
магнитного момента. “Сила тока” на
орбите электронаi
= en.
Магнитный момент где "площадь
орбиты"
пределим
в рамках теории Бора величину орбитального
магнитного момента. “Сила тока” на
орбите электронаi
= en.
Магнитный момент где "площадь
орбиты"
П
![]() оэтому
Итак,
оэтому
Итак,
(13.3)
![]()
Величина (13.4)
н![]() азываетсямагнетоном Бораи применяется для
измерения магнитных моментов атомов и
молекул:
азываетсямагнетоном Бораи применяется для
измерения магнитных моментов атомов и
молекул:
(13.5)
П![]() роекция
магнитного момента на некоторое
направлениеZ, так же,
как и проекция момента импульса, может
принимать 2l+1 значений:
(13.6) гдеm
= 0, ± 1, ± 2, …± l.
роекция
магнитного момента на некоторое
направлениеZ, так же,
как и проекция момента импульса, может
принимать 2l+1 значений:
(13.6) гдеm
= 0, ± 1, ± 2, …± l.
О тношение
величины магнитного момента к моменту
импульса называется гиромагнитным
отношением. Для орбитального момента
тношение
величины магнитного момента к моменту
импульса называется гиромагнитным
отношением. Для орбитального момента
(13.7)
С![]() обственному
моменту импульса электрона – спину –
соответствует и собственный магнитный
момент μs, причем вся
совокупность экспериментальных фактов
указывает на то, что этот собственный
магнитный момент электрона равен:
(13.8)
обственному
моменту импульса электрона – спину –
соответствует и собственный магнитный
момент μs, причем вся
совокупность экспериментальных фактов
указывает на то, что этот собственный
магнитный момент электрона равен:
(13.8)
Т аким
образом, гиромагнитное отношение для
собственных моментов электрона
аким
образом, гиромагнитное отношение для
собственных моментов электрона
(13.9)
в двое
больше, чем для орбитальных моментов.
Проекция собственного магнитного
момента на некоторое направлениеZ,
так же как и проекция спина, может
принимать всего 2 значения:
двое
больше, чем для орбитальных моментов.
Проекция собственного магнитного
момента на некоторое направлениеZ,
так же как и проекция спина, может
принимать всего 2 значения:
(13.10)
Н![]()
![]() аличие
спина и магнитного момента электрона
объясняет многие экспериментальные
факты. Например, дублетную структуру
термов щелоч-ных атомов можно объяснить
следующим образом. В состояниях l≠ 0 (p,d,f,
… - термы) атом обладает орбитальным
магнитным моментом, с которым
взаимодействует собственный магнитный
момент электрона, причем он может
ориентироваться относительно орбитального
момента так, что его проекция равна либо
+ , либо – . Поэтому вместо одного
уровня возникает два уровня, иp-,d-,f-,… термы
являются двойными.
аличие
спина и магнитного момента электрона
объясняет многие экспериментальные
факты. Например, дублетную структуру
термов щелоч-ных атомов можно объяснить
следующим образом. В состояниях l≠ 0 (p,d,f,
… - термы) атом обладает орбитальным
магнитным моментом, с которым
взаимодействует собственный магнитный
момент электрона, причем он может
ориентироваться относительно орбитального
момента так, что его проекция равна либо
+ , либо – . Поэтому вместо одного
уровня возникает два уровня, иp-,d-,f-,… термы
являются двойными.
