
Методическое пособие биохимия человека
.pdf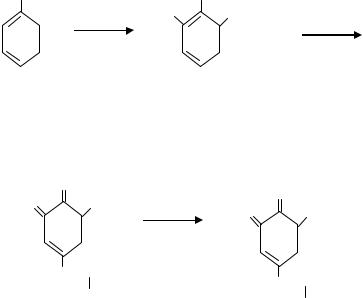
Ход работы: к 5 каплям раствора белка приливают 5 капель раствора нингидрина, кипятят 1-2 минуты. Появляется синефиолетовое окрашивание. С течением времени раствор синеет.
Примечание: нингидриновая реакция со спиртовым раствором нингидрина широко используется для разделения аминокислот хроматографическим методом, для открытия отдельных аминокислот и определения их количества. В
присутствии органических растворителей образовавшееся шиффово основание не распадается, поскольку в соединении нет воды. Конденсируясь с нингидрином,
оно содержит в своем составе радикал исходной аминокислоты, который обусловливает различную окраску: синюю, фиолетовую, а в присутствии пролина
— желтую.
3. Ксантопротеиновая реакция (Мульдера).
Принцип метода. Ксантопротеиновая реакция доказывает присутствие в белке ароматических аминокислот: триптофана, фенилаланина, тирозина. При обработке раствора белка концентрированной азотной кислотой появляется желтое
|
|
OH |
|
O2N |
OH |
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
+ 2HNO3 |
|
|
NO2 |
|
|||||
|
|
|
|
|
|
|
|
|
|
–2H2O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
H2 |
|
C––CH––COOH |
H2 |
|
C––CH––COOH |
|
|||||||||||||
|
|
|
|||||||||||||||||
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
NH2 |
|
|
|
|
NH2 |
|
||||||
тирозин |
|
динитротирозин |
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
желтого цвета |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
OH |
|
|
|
|
|
O |
|
|||||||||
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
||||
|
|
|
|
+ |
|
|
|
|
|
|
|
|
O |
|
|
||||
|
|
|
|
|
|
|
|
|
|||||||||||
O––N |
|
NO2 |
+ NH4OH |
|
|
|
|
|
|
||||||||||
|
|
N+ |
|
|
NO2 |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
–H2O |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
H4NO |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
H2C––CH––COOH
H2C––CH––COOH
NH2
NH2
оранжевое соединение
окрашивание (нитрование), которое при добавлении щелочи переходит в оранжевое. Химизм реакции нитрования с образованием нитросоединения следующий:
Реактивы: раствор яичного белка; раствор тирозина 0,05 %; раствор желатина; азотная кислота концентрированная; аммиак концентрированный.
Ход работы: Берут 3 пробирки. В первую вносят 4 капли раствора тирозина, во вторую — 4 капли раствора желатина, в третью — столько же раствора яичного белка. В каждую пробирку добавляют по 2 капли азотной кислоты. Нагревают пробирки и отмечают появление желтого окрашивания. После охлаждения добавляют в каждую
11
пробирку по 5-7 капель водного раствора аммиака, при этом желтая окраска сменяется на оранжевую.
Примечание: реакция носит название ксантопротеиновой от греческого xanthos — желтый. Реакция обеспечивает появление желтого окрашивания при попадании конц. азотной кислоты на кожу, ногти и т.д. Такую реакцию дают более простые ароматические соединения, например, фенолы. Желатин, сальмин, клупеин (протамины) дают отрицательную реакцию, так как в них отсутствуют ароматические аминокислоты.
4. Реакция Фоля.
Принцип метода. Реакция Фоля указывает на присутствие в белке аминокислот цистеина и цистина, содержащих слабосвязанную серу. Метионин, хотя и является содержащей серу аминокислотой, данной реакции не дает, поскольку сера в нем связана прочно. Реакция состоит в том, что при кипячении белка со щелочью аминокислоты цистеин и цистин легко отщепляют серу в виде сульфида металла, который с плюмбитом дает черный или бурый осадок сернистого свинца.
Реактив Фоля состоит из 5 % раствора уксуснокислого свинца и избытка 10 % раствора едкого натрия. Реакция протекает в реактиве Фоля по следующим уравнениям:
(CH3COO)2Pb + 2NaOH  2CH3COONa + Pb(OH)2 + NaOH
2CH3COONa + Pb(OH)2 + NaOH
избыток
Pb(OH)2 + 2NaOH  Na2PbO2 + 2H2O + NaOH
Na2PbO2 + 2H2O + NaOH
в реакции с аминокислотой
HOOC––CH––CH2––S––H + 2NaOH HOOC––CH––CH2––OH + Na2S + H2O
HOOC––CH––CH2––OH + Na2S + H2O
NH2 |
NH2 |
цистеин |
серин |
Na2S + Na2PbO2 + 2H2O |
PbS + 4NaOH |
плюмбит |
черный |
натрия |
осадок |
Реактивы: раствор яичного белка; реактив Фоля (к 5-10 % раствору уксуснокислого свинца добавляют раствор едкого натра до растворения).
Ход работы: к 5 каплям раствора белка добавляют 5 капель реактива Фоля. Интенсивно прокипятить и дать постоять 1-2 минуты. При этом появляется черный или бурый осадок сульфида свинца.
12
5. Реакция на тирозин (Миллона).
Принцип метода. При добавлении к раствору белка реактива Миллона (раствор ртути в азотной кислоте с небольшим количеством NaNO2) при кипячении образуется кроваво-красный осадок ртутной соли динитротирозина, благодаря наличию в тирозине фенольного кольца. Химизм реакции можно предоставить следующим образом:
|
OH |
|
O OHg |
|||||||||
|
|
|
|
|
|
O2N |
|
|
||||
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
––N––O |
|||
|
|
|
|
|
+ HNO3 + HgNO3 |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
+ 2 Н2О |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
H2 |
|
C––CH––COOH |
H2 |
|
C––CH––COOH |
|||||||
|
|
|||||||||||
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
NH2 |
|
|
|
NH2 |
|||||
тирозин |
ртутная соль |
|||||||||||
|
|
|
|
|
|
динитротирозина |
||||||
Следует избегать прибавления избытка реактива Миллона, так как он содержит азотную кислоту, которая, при взаимодействии с белком может дать желтое окрашивание, маскирующее реакцию Миллона.
Реактивы: раствор яичного белка; раствор фенола 0,1%; раствор желатина 1%; реактив Миллона (в 57 мл конц. азотной кислоты растворяют 40 г ртути сначала на холоде, а затем, нагревая на водяной бане; полученный раствор разбавляют 2 объемами воды, дают отстояться и сливают с осадка).
Ход работы: Берут три пробирки, в первую пробирку наливают 5 капель раствора яичного белка, во вторую — 5 капель раствора фенола, а в третью — 5 капель раствора желатина. В каждую пробирку приливают по 3 капли реактива Миллона и осторожно нагревают. В пробирке с яичным белком появляется кроваво-красное окрашивание, в пробирке с фенолом — розовато-красное, а в пробирке с желатином жидкость бесцветна, т.к. белки, не содержащие тирозина, этой реакции не дают.
6. Реакции на триптофан (Адамкевича и Шульца-Распайля).
Принцип метода. Если к раствору белка добавить концентрированную уксусную кислоту или тростниковый сахар, а затем осторожно по стенке пробирки спускать из пипетки концентрированную серную кислоту, то на границе двух жидкостей образуется красно-фиолетовое кольцо.
Реакция обусловлена наличием в белке триптофана, который, реагируя с глиоксилевой кислотой, присутствующей в виде примеси в концентрированной уксусной кислоте, или с оксиметилфурфуролом, образующимся из фруктозы, дает окрашенные продукты конденсации. Концентрированная серная кислота принимает участие в реакции в качестве водоотнимающего вещества.
13
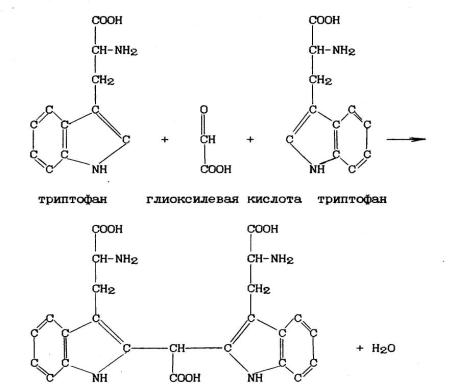
Интенсивность получаемой окраски зависит от количества триптофана. Содержание триптофана в яичном и соевом белке в 2 раза больше, чем в пшеничном; в желатине триптофана нет.
Ход превращения триптофана может быть представлен в следующем виде.
продукт конденсации триптофана с глиоксилевой кислотой Реактивы: раствор яичного белка; раствор пшеничного (или
соевого) белка 1%; желатин 1% раствор; концентрированная уксусная кислота; концентрированная серная кислота; 10% раствор сахарозы.
Ход работы:
а) Реакция Адамкевича.
В3 пробирки наливают: в первую - 5 капель раствора яичного белка, во вторую - 5 капель 1% раствора пшеничного (или соевого) белка и в третью - 5 капель 1% раствора желатина. В каждую пробирку добавляют по 5 капель концентрированной уксусной кислоты, слегка нагревают и затем подслаивают равным объемом концентрированной серной кислоты. В первых двух пробирках с растворами яичного и пшеничного белка на границе двух слоев жидкости появляется красно-фиолетовое кольцо, постепенно распространяющееся на всю жидкость. При нагревании в кипящей водяной бане окраска развивается быстрее
Впробирке с раствором желатина реакция получается отрицательной.
б) Реакция Щульца-Распайля.
Втри пробирки наливают: в первую - 5 капель раствора яичного белка, во вторую - 5 капель 1% раствора пшеничного (или соевого)
14
белка, в третью - 5 капель раствора желатина. В каждую пробирку добавляют по 1 капле 10% сахарозы (сахароза, как известно, состоит из фруктозы и глюкозы), перемешивают и подслаивают равными объемами концентрированной серной кислоты. В пробирках с растворами яичного и пшеничного белка на границе двух жидкостей образуется красно-фиолетовое кольцо. В кипящей водяной бане окраска развивается быстрее. В пробе с раствором желатина окрашивания не наблюдается.
7. Реакция на аргинин (Сакагучи).
Принцип метода. При добавлении к раствору белка щелочи, гипобромита и α-нафтола жидкость окрашивается в красный цвет. Реакция обусловлена присутствием в белке аминокислоты аргинина (гуанидиноаминовалерьяновой кислоты), имеющей в своем составе гуанидиновую группировку. В результате реакции образуется сложное соединение красного цвета, представляющее собой продукт конденсации окисленного аргинина с α-нафтолом. Гипобромит играет роль окислителя и участвует, по-видимому, в образовании промежуточного бромамидного соединения аргинина.
Реакция Сакагучи не является строго специфичной для аргинина. Ее дают и другие монозамещенные гуанидина.
Реактивы: раствор белка; 1% раствор пшеничного (или соевого) белка; 10% раствор едкого натрия; 0,1% раствор α-нафтола; 2% раствор гипобромита натрия.
Ход работы. В две пробирки наливают: в первую - 5 капель раствора яичного белка, во вторую - 5 капель 1% раствора пшеничного (или соевого) белка и добавляют в каждую по 5 капель 10% раствора едкого натра, по 3 капли 0,1% раствора α-нафтола и по каплям (1-3-5) 2% раствора гипобромита натрия. Жидкость в обеих пробирках окрашивается в красный цвет.
Вопросы для самоконтроля.
1.Объясните принципы цветных реакций на белки и аминокислоты.
2.Как каждое из приведенных ниже полипептидов ведет себя при различных цветных реакциях на белок: треонил-аспарагил- лизил-тирозил-глутаминовая кислота и серил-цистеил-аланин?
3.Все ли пептиды дают положительную биуретовую реакцию?
4.Почему пролин дает с нингидрином желтую окраску?
5.Наблюдается ли положительная реакция Фоля в присутствии метионина? Почему?
15
ЛАБОРАТОРНАЯ РАБОТА № 2.
ХРОМАТОГРАФИЧЕСКИЙ МЕТОД ОПРЕДЕЛЕНИЯ АМИНОКИСЛОТ
Теоретическая часть.
Хроматографические методы нашли чрезвычайно широкое применение в экспериментальной биохимии, поскольку позволяют с очень высокой степенью разрешения разделять смеси аминокислот, белков, липидов и их метаболитов. Общим для всех хроматографических методов является необходимость использования специального носителя или адсорбента, в котором и происходит разделение смесей веществ на составные части. В качестве адсорбента может быть использована в определенных случаях обычная фильтровальная или хроматографическая бумага. Преимущество таких методов в том, что они не требуют дорогостоящего дополнительного оборудования, однако и разделение смесей происходит не столь качественно как при использовании более эффективных носителей. Одним из классических методов хроматографического разделения веществ является колоночная хроматография. В этом случае адсорбент специальным образом набивается в хроматографическую колонку, где и происходит разделение. В качестве адсорбентов применяют производные целлюлозы и сефадекса, несущие ионообменные группировки (аминоэтильные, сульфоэтильные, карбоксиметильные и др.), гель фосфата кальция, силикагель и другие носители. В тех случаях, когда носители избирательно связывают определенные белки, фракционирование белковых смесей идет особенно эффективно. Такой вид хроматографии называют хроматографией сродства или аффинной хроматографией.
Одной из ее модификаций является хроматография, основанная на гидрофобном взаимодействии носителя (фенилили октилсефароза) с соответствующими неполярными аминокислотными радикалами белковых молекул. Применение эффективных сорбентов (различные производные силикагеля) и высокого давления при элюировании с них белков привело к возникновению ряда вариантов жидкостной хроматографии высокого разрешения.
В ходе ионообменной хроматографии образец помещается в буфер, свойства которого придают разделяемым компонентам высокие положительные либо отрицательные заряды. В результате этого образец, проходя через колонку, наполненную адсорбентом, несущим противоположно заряженные группировки, связывается с ним. Другие составляющие смеси, не несущие в данных условиях зарядов, противоположных группировкам носителя, свободно проходят через колонку. Задержанный в колонке компонент смеси можно смыть из нее, используя буфер с другим значением рН.
16
В случае, когда изменение концентрации буферного раствора осуществляется в процессе снятия белков с одной и той же колонки, хроматографию называют градиентной. Элюат (жидкость выходящая из колонки) собирают небольшими порциями (по несколько миллилитров) в отдельные пробирки при помощи специальной установки - коллектора фракций. Таких проб в процессе фракционирования белков на колонке хроматографическим методом получают обычно несколько сотен. В результате проведения цветной реакции на белок или путем измерения поглощения каждого раствора
вультрафиолетовой области спектра устанавливают содержание белка в каждой пробе. По этим данным строят кривую, из рассмотрения которой становится ясным, сколько фракций белка содержится в элюате и в какой серии пробирок находится каждая фракция. Одноименные пробы объединяют и из полученного раствора выделяют чистый белок.
Фракционирование белков методом молекулярных сит основано на различной скорости перемещения белковых молекул (в зависимости от молекулярной массы) через колонку, заполненную специальным материалом — сефадексом (название образовано из начальных слогов трех слов separation (разделение) pharmacia (название шведской фирмы, выпускающей реактивы) и dextran (декстран)). Сефадекс получают путем обработки эпихлоргидрином полисахарида декстрана, в результате чего между молекулами последнего возникает то или иное число поперечных связей.
Аналогично этому обработка другого полисахарида — агарозы - 2,3-дибром-пропанолом в резко щелочных условиях приводит к возникновению сетчатого полимера сефарозы, дающего гели, пригодные для фракционирования белков с молекулярными массами
всотни тысяч дальтон.
Взависимости от числа поперечных связей в сефадексе и размера белковых молекул осуществляется та или иная степень проникновения последних внутрь гранул сефадекса, заполняющих колонку. Большие белковые молекулы, не способные пройти через сито из ячеек в гранулу, быстро выносятся из колонки с током элюента; мелкие молекулы белка, проникшие внутрь зерна сефадекса, удерживаются некоторое время последним и выходят из колонки с последующими порциями элюата. Таким образом, колонка с сефадексом как бы просеивает через себя молекулы белка по их размерам, выпуская, как это ни парадоксально, первыми самые крупные молекулы. Так как гранулы сефадекса сильно разбухают в растворителе и образуют гель, этот метод называют также методом гельфильтрации.
Интересен предложенный П. А. Альбертсоном метод фракционирования белков с помощью двухфазных систем, составленных из водных растворов полимеров. При этом способе
17
фракционирование осуществляется в мягких условиях (физиологические значения ионной силы и рН среды), а водные растворы полимеров оказывают стабилизирующее действие на разделяемые белки. Метод позволяет работать с любыми количествами вещества, используя простейшую аппаратуру. Распределение белков между фазами определяется различиями в физико-химических свойствах фракционируемых белков и полимеров, входящих в состав верхней и нижней фаз: на основе комплекса свойств тех и других происходят взаимодействия (образование ионных и водородных связей, гидрофобные взаимодействия и др.), приводящие к накоплению определенного белка или группы белков в одной из полимерных фаз.
Практическая часть.
Радиальная (распределительная) жидкостная хроматография Принцип метода. Отдельные аминокислоты обладают различной
растворимостью в двух частично смешивающихся жидкостях, одной из которых является вода, другой — водонасыщенный органический растворитель, например, фенол, бутанол с уксусной кислотой. Из двух частично смешивающихся жидкостей один растворитель должен быть полярным - неподвижная фаза, а другой неполярным — подвижная фаза. Более гидрофобная аминокислота или другое вещество, лучше растворяющееся в неполярном растворителе, движется с большей скоростью от линии старта, чем гидрофильная аминокислота. В результате этого смесь аминокислот по окончании хроматографического разделения оказывается на разном расстоянии от линии старта.
Радиальную хроматографию проводят на бумаге в чашке Петри. Растворитель перемещается от центра к периферии и захватывает аминокислоты, которые распределяются концентрическими кругами и обнаруживаются после высушивания бумаги и проведения нингидриновой реакции.
Реактивы: 0,5% раствор смеси аминокислот: аланин, аргинина и лейцина. Можно использовать смесь других аминокислот, Rf которых при работе с соответствующими растворителями резко отличаются друг от друга. Растворитель: смешивают 40 мл бутилового спирта, 10 мл ледяной уксусной кислоты и 50 мл дистиллированной воды. После расслоения используют верхний слой уксусной кислоты с бутанолом, насыщенный водой. 0,1% раствор нингидрина на водонасыщенном бутиловом спирте.
Ход работы: На диске фильтровальной бумаги с помощью 2-х параллельных разрезов выделяют бумажный «хвостик». Разрезы должны проходить от края до середины диска и располагаться друг от друга на расстоянии 1см. Затем бумажный «хвостик» укорачивают на 1,5 — 2см и отгибают по месту соединения с бумагой
18
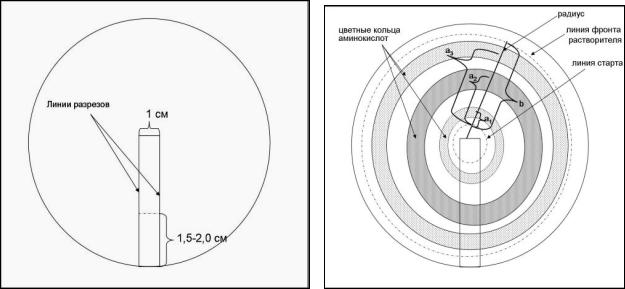
перпендикулярно плоскости диска. Для получения при хроматографии вполне круглых зон необходимо, чтобы длина разрезов была одинаковой (рис.1). Раствор смеси аминокислот (0,002 мл) наносят на место сгиба и высушивают на воздухе. Затем бумажный диск помещают между двумя половинками чашки Петри, нижняя из которых наполовину заполнена растворителем.
Скорость хроматографирования зависит от ширины «хвостика» и от расстояния между поверхностью жидкости и поверхностью бумаги, а также от качества фильтровальной бумаги.
Рис 1 Заготовка для хроматограммы |
Рис. 2 Хроматограмма. |
Через 1 час, когда растворитель на диске фильтровальной бумаги будет иметь диаметр 6-7 см, бумагу высушивают на воздухе или в сушильном шкафу при температуре 70 — 800С для удаления растворителя. Высушенную хроматограмму быстро, одним движением, смачивают раствором нингидрина, налитым в чашку Петри, и вновь высушивают в сушильном шкафу при температуре 901000С в течение 5 минут. При этом проявляются аминокислоты в виде трех колец, окрашенных в фиолетово-красный цвет, которые указывают на разделение аланина, аргинина и лейцина.
Для каждой аминокислоты рассчитывают коэффициент Rf или скорость перемещения по формуле: а/b, где а — расстояние в миллиметрах, пройденное аминокислотой от места нанесения аминокислоты до середины ее пятна; b — расстояние в миллиметрах от места нанесения аминокислоты (линии старта) до фронта растворителя (рис. 2). Чем меньше растворимость аминокислоты в воде и чем больше ее растворимость в органическом растворителе, тем быстрее она движется вслед за фронтом органического растворителя, тем больше величина Rf, и, наоборот, чем больше ее
19
растворимость в воде и меньше в органическом растворителе, тем медленнее аминокислота будет передвигаться и тем меньше величина Rf. Сравнивают коэффициент распределения известных стандартных аминокислот с коэффициентом распределения аминокислот, полученных для исследуемой смеси и определяют наличие отдельных аминокислот в исследуемом материале. Rf для аланина должно быть в пределах от 0,40 до 0,42; для аргинина —
0,12-0,20; для лейцина — 0,60-0,72.
Вопросы для самоконтроля:
1.Какие существуют разновидности хроматографического метода разделения веществ?
2.В чем заключается сущность хроматографического метода определения аминокислот на фильтровальной бумаге?
3.Какая фаза растворителя в данной работе является подвижной, а какая – неподвижной?
4.От чего зависит коэффициент распределения аминокислот?
5.Для чего в данной работе проделывают реакцию с нингидрином?
20
