
Тема 2. Характеристические функции
1. Определить изменение энтропии и изобарно-изотермического потенциала при стандартных условиях для реакции:
Fe304
+ СО = ЗFeО
+ С02
если
стандартные энтропии FeO,CO2,
Fe304
СО соответственно равны: 58,79; 213,6;
151,46; 197,4 Дж/моль К,
а стандартные величины
К,
а стандартные величины
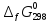 равны: -216,0; -394,89; -1010; -137,4 кДж/моль. Возможен
ли данный процесс при стандартных
условиях?
равны: -216,0; -394,89; -1010; -137,4 кДж/моль. Возможен
ли данный процесс при стандартных
условиях?
Ответ:
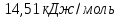
2.
Определите
изменение изобарно-изотермического
потенциала для реакции Ni
+ 2Н2О(Ж)
=
NH4NO2
и дайте заключение о возможности ее
протекания при стандартных условиях,
если
 G°(H20(ж))=
-237,5 кДж/моль
и
G°(H20(ж))=
-237,5 кДж/моль
и
 G°(NH4N02)=+115,94
кДж/моль.
G°(NH4N02)=+115,94
кДж/моль.
Ответ: 590,94 кДж/моль
3. Вычислите
стандартное изменение изобарного
потенциала Δ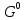 для
реакции хлорирования метана СН4
+ Сl2
= СНзС1(г)
+ НС1, используя табличные значения ΔН
и ΔS
для всех веществ, участвующих в данной
реакции.
для
реакции хлорирования метана СН4
+ Сl2
= СНзС1(г)
+ НС1, используя табличные значения ΔН
и ΔS
для всех веществ, участвующих в данной
реакции.
Ответ: -102,73 кДж/моль
4. Вычислите стандартное изменение изобарного потенциала язя реакции горения ацетона СНз-СО-СНз(г), + 402= ЗСО2 + ЗН2Ож). Необходимые величины энтальпии и энтропии реагирующих веществ возьмите из справочника.
Ответ: -1742,9 кДж/моль
5. Выясните возможность получения металлического кадмия из сульфида кадмия (II) восстановлением оксидом углерода (II) по реакции:
2CdS (кр.)
+2СO
(г.)=CO2
(г.)+СS2
(г.)+2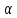 Сd
Сd
Ответ: реакция протекать не может.
6.
Установлено, что химические процессы,
для которых
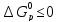 ,
можно использовать в химической
технологии. Определите температурные
границы технологического использования
реакции:
,
можно использовать в химической
технологии. Определите температурные
границы технологического использования
реакции:
C2H6 (г.)=С2H4 (г.)+H2 (г.)
Ответ:
868
7.
Пользуясь зависимостью:
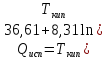 (Дж/моль)
(Дж/моль)
Справедливой для неполярных веществ, и принимая пар за идеальный газ, рассчитайте теплоту, работу и изменения энтропии, энтальпии и внутренней энергии при испарении 1 моль нижеприведенных веществ при нормальном давлении:
а) изопрен,
 б) бензол,
б) бензол,
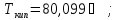 в) циклогексан,
в) циклогексан,
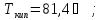 г) гексан,
г) гексан,
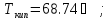 д)
стирол,
д)
стирол,

Ответ: для а) 25,87 кДж; 2,55 кДж; 84,21 Дж/К; 25,87 кДж; 23,32 кДж.
8. Рассчитайте ΔG, если температура кипения 351 К для процессов:
C2H6O (ж, Р=1,01∙105Па)= C2H6O (г, Р=9,09∙104Па),
C2H6O (ж, Р=1,01∙105Па)= C2H6O (г, Р=1,01∙105Па),
C2H6O (ж, Р=1,01∙105Па)= C2H6O (г, Р=1,11∙105Па).
Ответ: -307,46Дж/моль, 0, 275,5 Дж/моль
9. Вычислить изменение изобарного потенциала для процесса перехода 1 моль жидкого бензола при температуре кипения 80,1°С и давлении P1 в газообразный при Р2 и обратно для трех случаев: 1) P1 = 1,013∙105 н/м2 и Р2=9,11∙104 н/м2; 2) P1=1,013∙105 н/м2 и Р2 = 1,013∙105 н/м2; 3) Р1 = 101,3∙105 н/м2 и Р2= 1,114∙105 н/м2.
Ответ:
-311,56;0;-13240,27
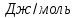
10-15.Найти изменение изобарного потенциала при сжатии 1 моль указанной жидкости от P1 до Р2 при 0°С. Сжимаемостью жидкости в указанном интервале давлений пренебречь.
|
Номер Задачи |
Жидкость |
Плотность г/см3 |
Давление,
н/м2∙ |
|
|
|
|
|||
|
10 |
Четырёххлористый Углерод |
1,633 |
1,013 |
10,13 |
|
11 |
Анилин |
1,039 |
0,506 |
4,05 |
|
12 |
Нитробензол |
1,223 |
1,013 |
6,078 |
|
13 |
Хлорбензол |
1,128 |
1,216 |
9,72 |
|
14 |
Хлороформ |
1,526 |
1,013 |
8,10 |
|
15 |
Бензол |
0,879 |
1,013 |
5,065 |
Ответ: 85,98 Дж; 31,72 Дж; 50,94 Дж; 84,81 Дж; 7,087 Дж; 35,96 Дж
16. При 25°С энтропии ромбической и моноклинической серы соответственно равны 31,88 и 32,55 дж/г∙атом∙град, а теплоты образования равны 0,00 и 0,30 кдж/г∙атом. Рассчитать ΔG и ΔF для процесса при 25°С. Пренебречь приближенно различием плотностей обеих модификаций серы. Какая из двух модификаций серы является более устойчивой при 25°С? Дайте приближенную оценку температуры перехода, при которой обе модификации серы находятся в равновесии, принимая для ΔS и ΔH значения при 25°С.
Ответ:100,34 Дж/г∙атом
17-25. Найти ΔG и ΔF химических реакций из электрохимических данных. Изменением объемов твердых и жидких веществ при реакции пренебречь.
|
Номер задачи |
Реакции |
Температура
|
Э.Д.С.,в |
|
17 |
Ag + 1/2 Cl2 (г) = AgCl (т) |
17 |
1,132 |
|
18 |
2Hg + Cl2 (г) = Hg2Cl2 (т) |
25 |
1,085 |
|
19 |
AgCl + 1/2 H2 = Ag + HC1 aq |
25 |
0,224 |
|
20 |
Zn + Cl2(г) = ZnCl2 aq |
25 |
2,123 |
|
21 |
Cu + Cl2 (г) = CuCl2 aq |
25 |
1,023 |
|
22 |
Cd + Cl2 (г) = CdCl2 aq |
25 |
1,763 |
|
23 |
Cu + 1/2 Cl2 (г) = CuCl (т) |
25 |
0,839 |
|
24 |
Co (т) + Cl2 (г) =CoCl2 aq |
25 |
1,637 |
|
25 |
Sn + Cl2 (г) = SnCl2 aq |
25 |
2,496 |
Ответ: 34) -109,24 кдж/моль, -106,83 кдж/моль; 35) -209,4 кдж/моль, -206,92 кдж/моль; 36) -21,62 кдж/моль, -19,136 кдж/моль; 37)-409,74 кдж/моль, -407,26 кдж/моль; 38) -197,44 кдж/моль, -194,96 кдж/моль; 39)-340,26 кдж/моль, -337,78 кдж/моль; 40) -80,96 кдж/моль, -78,48 кдж/моль; 41)-315,94 кдж/моль, -313,46 кдж/моль; 42)-481,73 кдж/моль, -479,25 кдж/моль
26—33. Вычислить изменения изобарного потенциала при изотермном сжатии газа от Р1до Р2; газы считать идеальными.
|
Номер задачи |
Газ |
Количество газа |
Тем пе рату ра
|
Давление,
н/м2∙ |
|
|
|
|
||||
|
26 |
Кислород |
0,005 м3 |
0 |
0,1013 |
1,013 |
|
27 |
Азот |
7 г |
27 |
0,506 |
3,04 |
|
28 |
Хлор |
0,002 м3 |
25 |
1,013 |
10,13 |
|
29 |
Водород |
0,01 м3 |
100 |
0,506 |
5,065 |
|
30 |
Кислород |
20 г |
25 |
1,013 |
15,20 |
|
31 |
Фосген |
0,01 м3 |
20 |
1,013 |
10,13 |
|
32 |
Окись углерода |
0,003 м3 |
25 |
0,1013 |
2,026 |
|
33 |
Сероводород |
0,001 м3 |
25 |
1,013 |
2,026 |
Ответ: ;
;
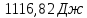 ;
;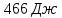 ;
;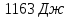 ;
;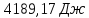 ;
; ;
;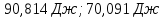
34. Определить изменение изохорного потенциала и внутренней энергии при обратимом испарении 1 моль брома при давлении 1,013∙105 н/м2 и температуре кипения —7,3° С. Теплота испарения брома равна 31,0 кдж/моль.
Ответ: 28,79;-2,21 кдж/моль
35.
Вычислить
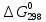 реакции
разложения С4Н104(г)
= С3Н6(г)
+ СН4(г)
при 25 °С, если теплоты образования
С4Н10,
C3H6,
CH4
равны соответственно: 125,1; 20,4; -74,83 кДж,
а энтропии их равны соответственно:
310,04; 266,87; 186,14 Дж/моль
реакции
разложения С4Н104(г)
= С3Н6(г)
+ СН4(г)
при 25 °С, если теплоты образования
С4Н10,
C3H6,
CH4
равны соответственно: 125,1; 20,4; -74,83 кДж,
а энтропии их равны соответственно:
310,04; 266,87; 186,14 Дж/моль К.
К.
Ответ: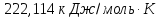
36. В
каком направлении может протекать
реакция крекинга циклогексана при 727
°С С 6Н12
=
ЗС2Н4,
если при данной температуре
 G°(
(С6Н12)=402,2
кДж/моль, a
G°(
(С6Н12)=402,2
кДж/моль, a
 G°(C2H4)=
114,0 кДж/моль.
G°(C2H4)=
114,0 кДж/моль.
Ответ: -60,2 кДж/моль
37. Почему синтез аммиака по реакции N2 (г.)+3H2 (г.)=2NH3 (г.)
стремятся вести при более низкой температуре?
Ответ:
так как
 кДж/проб
кДж/проб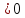 и
и
 Дж/K∙проб
Дж/K∙проб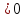
38. Определить: ΔU,ΔH,ΔS процесса:
 1
моль H2O
(ж; 20
1
моль H2O
(ж; 20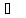 ;
1 атм.) 1 моль H2O
(г; 250
;
1 атм.) 1 моль H2O
(г; 250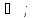 1
атм.)
1
атм.)
Энтальпия испарения
воды при 100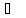 равна 40655 Дж/моль. Теплоёмкость жидкой
и парообразной воды равна:
равна 40655 Дж/моль. Теплоёмкость жидкой
и парообразной воды равна:
Ср(ж)=75,30 Дж/моль∙К
Ср(г)= 30,00+10,71∙10-3T-0,33∙105T-2 Дж/моль∙К
Ответ: 138,92 Дж/моль∙К; 51925 Дж/моль
39. Один
моль двухатомного идеального газа,
взятый при 25 и 1 атм., нагревается при постоянном
давлении, пока объём не возрастёт втрое.
Рассчитать Q,
A,
ΔH,
ΔU
и ΔS
процесса.
и 1 атм., нагревается при постоянном
давлении, пока объём не возрастёт втрое.
Рассчитать Q,
A,
ΔH,
ΔU
и ΔS
процесса.
Ответ: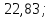
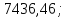 4957,6
4957,6
40. В
одном сосуде находится кислород, а в
другом – азот. Эти сосуды соединены
трубкой с краном. При открывании крана
происходит изотермическое смешение
газов при 25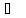 :
:
0,2 моль O2 (0,2 атм.) + 0,8 моль N2 (0,8 атм.)→смесь газов
а) Рассчитать общее
давление смеси газов; б) Чему равны Q,
A,
ΔU,
ΔS,
ΔH
и ΔG
для процесса смешения; в) Чему были бы
равны Q
и A,
если бы смешение газов протекало обратимо
и изотермически при 25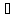
Ответ:
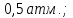 Q=A=ΔU=ΔH=0;
Q=A=ΔU=ΔH=0;
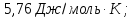 -1717,344; 1717,344
-1717,344; 1717,344
41. В основу современного производства азотной кислоты положена реакция: 4NH3 (г.)+5O2 (г.)=4NO (г.)+6H2O (г.) стремятся вести при более низкой температуре?
Выяснить влияние изменения температуры на протекание этого процесса.
Ответ:
благоприятствует условие ΔT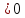 ,
так как
,
так как
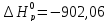 кДж/проб
кДж/проб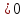 и
и
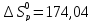 Дж/K∙проб
Дж/K∙проб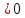
42. Почему повышение температуры препятствует протеканию реакции:
2NO (г.)+O2 (г.)=2NO2 (г.), а понижение- способствует?
Ответ:
так как
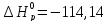 кДж/проб
кДж/проб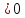 и
и
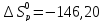
Дж/K∙проб
43. Определите
 ,
,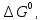
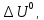
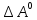 и
и
 при
298,2 К ДЛЯ реакции
при
298,2 К ДЛЯ реакции
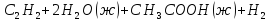
Ответ: 140∙103 ;-116,97∙103 Дж/моль;-50,32 Дж/моль∙К.
44.
Определите ΔS,
ΔH
и ΔUпроцесса
1 моль H2O
(ж,200С,
1 атм)→1моль Н2О(г,2500С,
1 атм), имея следующие данные: Ср(ж)
18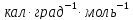 .
ΔН испарения воды при 1000С
и 1 атм составляет 9720
.
ΔН испарения воды при 1000С
и 1 атм составляет 9720
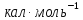 .
.
Ответ:
33,28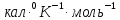 .;
11410
.;
11410
 ;
12450
;
12450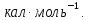
45.Найти изменение U,H,S,А и G при изотермическом расширении 5 молей кислорода, рассматриваемого как идеальный газ, от 100 до 1000 л при 25 °С, если Ср,298 = 29,38 Дж∙моль∙К-1.
Ответ: ΔU = ΔH = 0; ΔS = 95,74 Дж∙К-1; ΔА = ΔG = - 28,55 кДж.
46. Найти изменение U, H, S, А и G при переходе 1 моля воды в пар при 100°С и 1 атм. При этой температуре мольный объем воды равен 18 мл, а мольный объем пара равен 30,2 л. Теплота испарения воды при 100 °С равна 40,65 кДж∙моль-1.
Ответ: ΔG = 0; ΔН= 40,65 кДж∙моль-1; ΔU= 37,59 кДж∙моль-1; ΔS= 108,92 Дж∙моль -1∙К-1; ΔА = -3,06 кДж∙моль-1.
47. а)
Найти ΔН0
при 10000К
для реакции NaCl(тв)→Na(г)+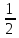 Сl2(г);
Сl2(г);
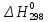 =124,1
ккал и
=124,1
ккал и
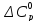 =−1,585
- 3,82·10-3 Т
– 0,34·105Т-2.
=−1,585
- 3,82·10-3 Т
– 0,34·105Т-2.
б)Выполняется ли соотношение ΔS0=ΔH0/T для (1) приведенной реакции при 250С; (2) реакции NaCl(тв)→NaСl(г) при 250С; (3) реакции NaCl(ж)→NaСl(г) при 14130С(температура кипения NaСl)? Объясните каждый случай, предполагая, что газы идеальные.
Ответ:
 ;
1) нет; 2) нет; 3) да.
;
1) нет; 2) нет; 3) да.
48. ΔН0
для процесса плавления воды при 00С
равна 1436
 .
Ср
для твердой и жидкой воды составляет
соответственно 8,9 и 18,0
.
Ср
для твердой и жидкой воды составляет
соответственно 8,9 и 18,0
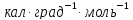 .
Определите а) ΔН, б) ΔS
и в) ΔС при постоянном давлении 1 атм для
следующего процесса:
.
Определите а) ΔН, б) ΔS
и в) ΔС при постоянном давлении 1 атм для
следующего процесса:
Н2О(тв,-100С)→ Н2О(ж,-100С).
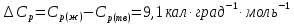 ;
;
Ответ:
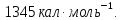 ;
;
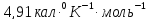 ;
;
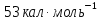 .
.
49. Вычислить ΔrG°473 реакции: 1/2N2 + 1/202 = NO, если
ΔrG0298
=
86,44 кДж∙моль-1
а стандартные энтропии (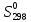 Дж∙моль -1∙K-1
и средние теплоемкости веществ (Сp,298,
Дж∙моль -1∙К-1)
равны:
Дж∙моль -1∙K-1
и средние теплоемкости веществ (Сp,298,
Дж∙моль -1∙К-1)
равны:
|
Вещество |
|
|
|
|
N2(г) |
191,50 |
29,12 |
|
|
О2(г) |
205,04 |
29,38 |
|
|
NO(r) |
210,64
|
29,86 |
Ответ:
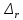 G0473=
84,25 кДж∙моль-1.
G0473=
84,25 кДж∙моль-1.
50. Вычислить реакции ΔrG0973 для: 2С02(Г) =2СО (г) + 02(г), если стандартные значения равны:
|
Ве- щест- во |
Δr |
|
|
|
|
|
|
co2(r) |
-393,52 |
213,67 |
37,14 |
|
||
|
co(r) |
-110,53 |
197,55 |
29,14 |
|||
|
02(r) |
— |
205,04 |
29,38 |
|||
Ответ: ΔrG0973 = 391,48 кДж∙моль -1.
51.
Вычислить реакции ΔrG0500
для: Fe2C03(т)
= FeO(т)
+ C02
(г), если значенияи Δr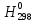 ,
стандартные энтропии и теплоемкости
веществ равны:
,
стандартные энтропии и теплоемкости
веществ равны:
|
Вещест- во |
Δr |
|
|
|
|
|
FеСО3(т) |
-738,15 |
95,40 |
83,26 |
||
|
FeO(т) |
-264,85 |
60,75 |
49,92 |
||
|
со2(г) |
-393,52 |
213,67 |
37,14 |
Ответ: ΔrG0500 =- 9,95 кДж∙моль-1 .

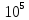


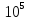
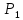
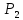
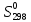
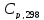
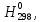 кДж∙моль-1
кДж∙моль-1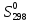 ,
Дж∙моль-1∙К-1
,
Дж∙моль-1∙К-1 ,
Дж∙моль-1∙К-1
,
Дж∙моль-1∙К-1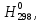 кДж∙моль-1
кДж∙моль-1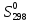 ,
Дж∙моль-1∙К-1
,
Дж∙моль-1∙К-1 ,
Дж∙моль-1∙К-1
,
Дж∙моль-1∙К-1