
- •Т.Н. Мартынова химия
- •Введение
- •Литература Основная
- •Дополнительная
- •Программа
- •Общие методические указания по подготовке, выполнению и оформлению контрольной работы
- •Контрольные задания
- •1. Химический элемент, простое вещество, сложное вещество и смесь
- •2. Количественные меры вещества: атомная и молекулярная массы, моль, закон авогадро. Мольный объём газа.
- •3. Эквивалент. Закон эквивалентов. Эквивалентная масса. Эквивалентный объём
- •4. Вывод химических формул соединений. Расчёты по химическим формулам и уравнениям
- •5. Электронная структура атомов и периодическая система химических элементов д.И.Менделеева
- •6. Химическая связь, её типы и свойства
- •7. Закономерности протекания химических реакций
- •8. Растворы и способы выражения их концентрации
- •9. Растворы электролитов
- •10. Окислительно-восстановительные реакции
- •11. Электролиз
- •12. Корозия металлов
- •Приложения
- •П5. Значения атомных масс некоторых химических элементов
- •П6. Растворимость солей и оснований в воде
- •П7. Константы диссоциации Кд слабых электролитов при 250с
- •П8. Ряд стандартных электродных потенциалов в водных растворах при 25 0с
- •Оглавление
- •Химия Программа, методические указания, решение типовых задач и контрольные задания для студентов-заочников факультета механизации сельского хозяйства
12. Корозия металлов
Коррозия – это разрушение металла в результате физико-химического взаимодействия с окружающей средой. При этом металлы окисляются и образуют продукты, состав которых зависит от условий коррозии.
При электрохимической коррозии на поверхности металла одновременно протекают два процесса:
анодный – окисление металла (М)
М – ne ® Mn+
и катодный – восстановление окислителя (Ох)
Ox + ne ® Red.
Окислителями при коррозии служат молекулы кислорода О2, хлора Cl2, ионы H+, Fe3+, NO3- и т.д. Наиболее часто при коррозии наблюдается ионизация (восстановление) кислорода:
в нейтральной или щелочной среде
О2 + 2Н2О + 4е ® 4ОН –
в кислой среде
О2 + 4Н+ + 4е ® 2Н2О
и выделение водорода
2Н+ + 2е ® Н2.
Электрохимическая коррозия возможна, если ЭДС элемента имеет положительное значение (ЕЭ>0).
Так как ЕЭ = Еок –Евосст , то коррозия возможна при условии, что потенциал окислителя положительнее потенциала металла:
ЕОК > ЕМn+/M. (12.1)
Потенциал кислородного электрода при 25 0С описывается уравнением:
 .
.
Потенциал водородного электрода описывается уравнением:
 .
.
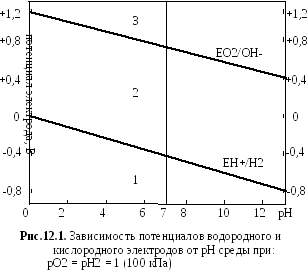
Уравнение (12.1) позволяет определить возможность протекания коррозии различных металлов. Если потенциал металла положительнее потенциала кислородного электрода (рис.12.1, область 1), то коррозия металла невозможна. Если потенциал металла положительнее потенциала водородного электрода и отрицательнее потенциала кислородного электрода (рис.12.1, область 2), то коррозия возможна с поглощением кислорода и невозможна с выделением водорода. Если потенциал металла отрицательнее потенциала водородного электрода (рис.1, область 3), то возможна коррозия как с поглощением кислорода, так и с поглощением водорода.
Химическая коррозия представляет собой самопроизвольное разрушение металлов в среде окислительного газа (например кислорода, галогенов) при повышенных температурах или в жидких неэлектролитах. Сущность процессов химической коррозии сводится к окислительно-восстановительной реакции, осуществляемой непосредственным переходом электронов металла на окислитель. В соответствии с законами химической термодинамики эта реакция может протекать лишь при условии, если энергия Гиббса меньше нуля: ΔG < 0. Для ряда металлов, у которых в результате химической коррозии получаются сплошные плёнки установлена логарифмическая зависимость роста плёнки от времени:
d = klnt.
где k – константа,
d - толщина плёнки,
t - время.
Пример.12.1. Как проходит коррозия цинка, находящегося в контакте с кадмием в нейтральной и кислом растворах. Составьте электронные уравнения анодного и катодного процессов. Каков состав продуктов коррозии?
Решение:
Цинк имеет более отрицательный потенциал (-0,763 В), чем кадмий (-0,403 В), поэтому он является анодом, а кадмий катодом.
Анодный процесс:
Zn0 – 2e = Zn2+.
Катодный процесс:
в кислой среде 2H+ + 2e = H2,
в нейтральной
среде
 O2
+ H2O
+ 2e
= 2OH
-.
O2
+ H2O
+ 2e
= 2OH
-.
Так как ионы Zn2+ с гидроксильной группой образуют нерастворимый гидроксид, то продуктом коррозии будет Zn(OH)2.
Ответ: продуктом коррозии будет Zn(OH)2.
Задачи
12.1. Во сколько раз возрастёт толщина плёнки при увеличении продолжительности газовой коррозии никеля и алюминия от 10 до 100 часов?
12.2. Почему в железной бочке можно хранить концентрированную серную кислоту и нельзя хранить разбавленную?
12.3. Приведите примеры металлов которые могут корродировать с выделением водорода в водном растворе, имеющем рН:
1) 2,8;
2) 6,5:
3) 11,0.
12.4. Возможна ли коррозия олова в водном растворе с рН = 6 при контакте с воздухом? При каких значениях рН возможна коррозия с выделением водорода?
12.5. Почему в атмосферных условиях цинк корродирует, а золото нет? Подтвердите это расчётами.
12.6. Если к медной пластинке, опущенной в кислоту, прикоснуться цинковой, то на меди начинается бурное выделение водорода. Объясните это явление, составив уравнения анодного и катодного процессов. Напишите уравнения протекающей химической реакции.
12.7. К какому типу покрытий относится олово на стали и на меди? Какие процессы будут протекать при атмосферной коррозии оловянированных стали и меди при нейтральной реакции среды при 25 0С? Напишите уравнения катодных и анодных реакций.
12.8. В пресной или в морской воде железо будет сильнее подвергаться коррозии и почему?
12.9. Что произойдёт, если железное изделие поместить в раствор соли:
1) меди;
2) цинка;
3) серебра,
Напишите уравнения происходящих реакций в сокращённой ионной форме.
12.10. Для ослабления процесса коррозии железные изделия подвергаются никелированию и цинкованию. В каком случае коррозия будет усиливаться при повреждении такого изделия?
12.11. При контакте с цинком или с оловом коррозия железа будет замедляться?
12.12. Основная реакция процесса коррозии выражается ионным уравнением Fe + 2Н+ = Fe2+ + Н2. Какой процесс с участием кислорода способствует сдвигу равновесия этой реакции вправо?
12.13. Как влияет рН среды на скорость коррозии железа и цинка? Составьте уравнения анодного и катодного процессов атмосферной коррозии этих металлов.
12.14. Две железные пластинки, находящиеся во влажном воздухе частично покрыты одна оловом, другая медью. На какой из этих пластинок быстрее образуется ржавчина? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этих пластинок. Каков состав продуктов коррозии железа?
12.15. Две железные пластинки, находящиеся во влажном воздухе частично покрыты одна никелем, другая медью. На какой из этих пластинок быстрее образуется ржавчина? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этих пластинок. Каков состав продуктов коррозии железа?
12.16. Две железные пластинки, находящиеся во влажном воздухе частично покрыты одна кадмием, другая свинцом. На какой из этих пластинок быстрее образуется ржавчина? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этих пластинок. Каков состав продуктов коррозии железа?
12.17. Почему химически чистое железо более стойко против коррозии, чем техническое железо? Составьте электронные уравнения анодного и катодного процессов коррозии технического железа во влажном воздухе и в кислой среде.
12.18. Какое покрытие называется анодным и какое – катодным? Назовите несколько металлов, которые могут служить для анодного и катодного покрытий железа.
12.19. Если к медной пластинке, опущенной в кислоту, прикоснуться цинковой, то на меди начнётся бурное выделение водорода. Дайте этому объяснение и составьте электронные уравнения анодного и катодного процессов. Напишите уравнение протекающей химической реакции.
12.20. В чём сущность протекторной защиты металлов от коррозии? Приведите пример протекторной защиты железа в электролите, содержащим растворённый кислород. Составьте электронные уравнения анодного и катодного процессов.
12.21. Как происходит атмосферная коррозия луженого железа и луженой меди при нарушении покрытия? Составьте электронные уравнения анодного и катодного процессов.
12.22. Какой металл целесообразнее выбрать для протекторной защиты от коррозии свинцовой оболочки кабеля:
1) цинк;
2) магний;
3) хром.
Почему? Составьте электронные уравнения анодного и катодного процессов атмосферной коррозии. Каков состав продуктов коррозии.
12.23. Железное изделие покрыто оловом. Какое это покрытие – анодное или катодное? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и в хлороводородной кислоте. Какие продукты коррозии образуются в первом и во втором случаях?
12.24. Железное изделие покрыто свинцом. Какое это покрытие – анодное или катодное? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и в хлороводородной кислоте. Какие продукты коррозии образуются в первом и во втором случаях?
12.25. Железное изделие покрыто кадмием. Какое это покрытие – анодное или катодное? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и в хлороводородной кислоте Какие продукты коррозии образуются в первом и во втором случаях?
