17.4 Атом щелочного металла
Пусть
атом щелочного металла имеет
 электронов. Тогда можно считать, что
электронов. Тогда можно считать, что электронов вместе с ядром образуют
остов, в электрическом поле которого
движется внешний (валентный) электрон,
довольно слабо связанный с остовом
атома.
электронов вместе с ядром образуют
остов, в электрическом поле которого
движется внешний (валентный) электрон,
довольно слабо связанный с остовом
атома.
В
некотором смысле атомы щелочных металлов
являются водородоподобными, однако не
полностью. Дело в том, что внешний
электрон деформирует электронный остов
и тем самым искажает поле, в котором
движется. В первом приближении поле
остова можно рассматривать как
суперпозицию поля точечного заряда
 и поле точечного диполя, расположенного
в центре остова. При этом ось диполя
направлена все время к внешнему электрону.
и поле точечного диполя, расположенного
в центре остова. При этом ось диполя
направлена все время к внешнему электрону.
Это позволяет представить потенциальную энергию внешнего электрона в поле такого остова как
 , (17.28)
, (17.28)
где
 – некоторая постоянная.
– некоторая постоянная.
Решение
уравнения Шредингера для электрона с
потенциальной энергией (17.28) приводит
к тому, что теперь дозволенные значения
энергии
 в области
в области (для связанных состояний внешнего
электрона) будут зависеть от главного
квантового числа
(для связанных состояний внешнего
электрона) будут зависеть от главного
квантового числа и от орбитального квантового числа
и от орбитального квантового числа :
:
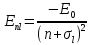 , (17.29)
, (17.29)
где
 =13,6
эВ,
=13,6
эВ, – поправка Ридберга (или квантовый
дефект), зависящая от
– поправка Ридберга (или квантовый
дефект), зависящая от .
Значения поправок определяются
экспериментально. Например, для натрия
эти значения равны
.
Значения поправок определяются
экспериментально. Например, для натрия
эти значения равны
 (17.30)
(17.30)
Таким
образом, в атоме щелочного металла
снимается вырождение по числу
 .
.
Схема
энергетических уровней
 для лития представлена на рис. 5.
для лития представлена на рис. 5.

Рис. 5
Заметим,
что у лития основным состоянием является
 ,
поскольку состояние с
,
поскольку состояние с уже занято двумя электронами, входящими
в состав остова.
Зависимость энергии
уже занято двумя электронами, входящими
в состав остова.
Зависимость энергии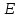 электрона не только от
электрона не только от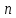 ,
но и от
,
но и от объясняется тем, что в атоме щелочного
металла внешний электрон находится в
электрическом поле атомного остова,
которое не кулоновское (не
объясняется тем, что в атоме щелочного
металла внешний электрон находится в
электрическом поле атомного остова,
которое не кулоновское (не ).
Заряд остова не точечный, и распределение
его несколько отличается от
сферически-симметричного.
).
Заряд остова не точечный, и распределение
его несколько отличается от
сферически-симметричного.
Правило
отбора
Излучение (и поглощение) происходит в
результате перехода внешнего электрона
с одного уровня на другой. Однако не все
переходы возможны. Возможны лишь те,
при которых орбитальное квантовое число
 внешнего электрона меняется на единицу:
внешнего электрона меняется на единицу:
 (17.31)
(17.31)
Это
означает, что разрешенными являются
переходы лишь между
 -
и
-
и -
состояниями, между
-
состояниями, между -
и
-
и -
состояниями и т.д. Заметим, что главное
квантовое число
-
состояниями и т.д. Заметим, что главное
квантовое число может изменяться на любое целое число.
может изменяться на любое целое число.
17.5 Принцип Паули. Заполнение электронных оболочек
Электроны
в атомах могут находиться в различных
состояниях, которым соответствуют
разные наборы четверки квантовых чисел
 .
Энергия электронов в атоме зависит от
.
Энергия электронов в атоме зависит от и
и .
Однако в магнитном поле снимается
вырождение по магнитному квантовому
числу
.
Однако в магнитном поле снимается
вырождение по магнитному квантовому
числу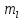 и каждый
и каждый -ый
уровень расщепляется на
-ый
уровень расщепляется на мелких подуровней (эффект Зеемана), и
энергия электронов в атоме уже будет
зависеть от трех квантовых чисел
мелких подуровней (эффект Зеемана), и
энергия электронов в атоме уже будет
зависеть от трех квантовых чисел .
.
Распределение электронов по энергетическим уровням осуществляется согласно принципу Паули (1940г.):
в
атоме не может быть электронов с
одинаковыми значениями всех четырех
квантовых чисел
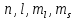
или
в
каждом квантовом состоянии, характеризуемом
набором квантовых чисел
 ,
определяющих некоторый уровень энергии,
может находиться не более двух электронов
с противоположно направленными спинами.
,
определяющих некоторый уровень энергии,
может находиться не более двух электронов
с противоположно направленными спинами.
Кроме того, следует учитывать, что система частиц стабильна, когда ее потенциальная энергия минимальна.
Именно принцип Паули объяснил, почему электроны в атомах оказываются не все на самом нижнем энергетическом уровне.
Совокупность
электронов атома с одинаковыми значениями
квантового числа
 образуют так называемую оболочку. В
соответствии со значением
образуют так называемую оболочку. В
соответствии со значением оболочки обозначают большими буквами
латинского алфавита следующим образом:
оболочки обозначают большими буквами
латинского алфавита следующим образом:
|
Значение
|
1 |
2 |
3 |
4 |
5 |
6 |
|
Оболочка |
|
|
|
|
|
|
Оболочки
подразделяют на подоболочки, отличающиеся
квантовым числом
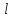 .
Различные состояния в подоболочке
отличаются значениями квантовых чисел
.
Различные состояния в подоболочке
отличаются значениями квантовых чисел и
и .
Число состояний в подоболочке равно
.
Число состояний в подоболочке равно .
Подоболочки обозначают в виде:
.
Подоболочки обозначают в виде:

где
цифра означает квантовое число
 .
.
Возможные состояния электронов в атоме и их распределение по оболочкам и подоблочками показано в таблице 1.
Ранее
было показано, что данному значению
 соответствует
соответствует состояний, отличающихся друг от друга
значениями квантовых чисел
состояний, отличающихся друг от друга
значениями квантовых чисел (см. вывод формулы 17.8). Из таблицы 1 видно,
что число возможных состояний в
(см. вывод формулы 17.8). Из таблицы 1 видно,
что число возможных состояний в оболочках равно соответственно 2, 8, 18.
…, т.е. равно
оболочках равно соответственно 2, 8, 18.
…, т.е. равно .
.
|
Оболочка |
|
|
| ||||||||||||||
|
Подоболочка
|
|
|
|
|
|
| |||||||||||
|
|
0 |
0 |
+1 |
0 |
-1 |
0 |
+1 |
0 |
-1 |
+2 |
+1 |
0 |
-1 |
-2 | |||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |||
|
Число электронов в подоболочке |
2 |
2 |
6 |
2 |
6 |
10 | |||||||||||
|
Число электронов в оболочке |
2 |
8 |
18 | ||||||||||||||
Распределение электронов по состояниям называют электронной конфигурацией.
Их
обозначают символически, например,
так: . Это означает, что в атоме имеются два
. Это означает, что в атоме имеются два –электрона, два
–электрона, два -электрона,
шесть
-электрона,
шесть -электронов
и один
-электронов
и один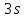 -электрон
. Это электронная конфигурация атома
-электрон
. Это электронная конфигурация атома .
.
Оболочку (или подоболочку) полностью заполненную электронами называют замкнутой.