
Модуль 2.24
Глава 17 Физика атомов
17.1 Атом водорода
Рассмотрим
систему, состоящую из неподвижного ядра
с зарядом
 и движущегося вокруг него электрона.
При
и движущегося вокруг него электрона.
При
 такая система называется водородоподобным
ионом, при
такая система называется водородоподобным
ионом, при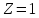 она представляет собой атом водорода.
она представляет собой атом водорода.
Потенциальная энергия взаимодействия электрона с ядром в такой системе равна
 ,
(17.1)
,
(17.1)
где
 – расстояние электрона от ядра.
– расстояние электрона от ядра.
Уравнение Шредингера в этом случае имеет вид:
 (17.2)
(17.2)
Поле
(17.1), в котором движется электрон, является
центрально-симметричным, т.е. зависит
от
 .
Поэтому целесообразно задачу решать в
сферической системе координат
.
Поэтому целесообразно задачу решать в
сферической системе координат .
Остановимся лишь на сути процесса
решения и на анализе окончательных
результатов.
.
Остановимся лишь на сути процесса
решения и на анализе окончательных
результатов.
Решение
уравнения (17.2) проводят методом разделения
переменных с учетом стандартных
требований, налагаемых на
 -функцию: она должна быть однозначной,
конечной, непрерывной и гладкой. В
процессе решения обнаруживается, что
этим требованиям можно удовлетворить
в следующих случаях: 1) при любых
положительных значениях энергии
-функцию: она должна быть однозначной,
конечной, непрерывной и гладкой. В
процессе решения обнаруживается, что
этим требованиям можно удовлетворить
в следующих случаях: 1) при любых
положительных значениях энергии ;
2) при дискретных отрицательных значениях
энергии, равных
;
2) при дискретных отрицательных значениях
энергии, равных
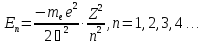 (17.3)
(17.3)
Случай
 соответствует электрону, пролетающему
вблизи ядра и удаляющемуся снова на
бесконечность. Случай
соответствует электрону, пролетающему
вблизи ядра и удаляющемуся снова на
бесконечность. Случай соответствует электрону, связанному с
ядром.
соответствует электрону, связанному с
ядром.
Нас
будут интересовать связанные состояния
электрона. Для
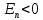 собственные функции уравнения (17.2),
т.е.
собственные функции уравнения (17.2),
т.е. -функции, содержат, как выяснилось, три
целочисленных параметра
-функции, содержат, как выяснилось, три
целочисленных параметра :
:
 , (17.4)
, (17.4)
где
 называютглавным
квантовым числом,
оно совпадает с номером уровня энергии
называютглавным
квантовым числом,
оно совпадает с номером уровня энергии
 (17.3). Параметры
(17.3). Параметры и
и представляют собойорбитальное
и магнитное
квантовые числа,
физический смысл которых будет выяснен
в дальнейшем.
представляют собойорбитальное
и магнитное
квантовые числа,
физический смысл которых будет выяснен
в дальнейшем.
Решения,
удовлетворяющие стандартным условиям,
получаются при значениях
 ,
не превышающих
,
не превышающих
 .
Таким образом, при данном
.
Таким образом, при данном квантовое число
квантовое число может принимать
может принимать значений:
значений:
 . (17.5)
. (17.5)
В
свою очередь, при данном
 квантовое число
квантовое число может принимать
может принимать различных значений:
различных значений:
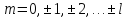 . (17.6)
. (17.6)
Энергия
 электрона (17.3) зависит только от главного
квантового числа
электрона (17.3) зависит только от главного
квантового числа .
Отсюда следует, что каждому собственному
значению
.
Отсюда следует, что каждому собственному
значению (кроме случая
(кроме случая )
соответствует несколько собственных
функций
)
соответствует несколько собственных
функций ,
отличающихся значениями квантовых
чисел
,
отличающихся значениями квантовых
чисел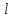 и
и .
Это означает, что электрон может иметь
одно и то же значение энергии, находясь
в нескольких различных состояниях.
Например, энергией
.
Это означает, что электрон может иметь
одно и то же значение энергии, находясь
в нескольких различных состояниях.
Например, энергией =2)
обладают четыре состояния:
=2)
обладают четыре состояния: .
.
Кратность
вырождения. Состояния
с одинаковой энергией называют
вырожденными, а число различных состояний
с определенным значением энергии
 –кратностью
вырождения
данного энергетического уровня.
–кратностью
вырождения
данного энергетического уровня.
Кратность
вырождения
 -го уровня водородоподобного атома
можно определить, исходя из возможных
значений
-го уровня водородоподобного атома
можно определить, исходя из возможных
значений и
и .
Каждому из
.
Каждому из -значений
квантового числа
-значений
квантового числа соответствует
соответствует значений числа
значений числа .
Поэтому полное число
.
Поэтому полное число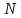 различных состояний для данного
различных состояний для данного равно
равно
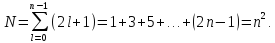 (17.7)
(17.7)
Следовательно,
кратность вырождения
 -го энергетического уровня равна
-го энергетического уровня равна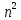 .
.
В
действительности, как будет показано
в дальнейшем, это число надо удвоить
из-за наличия собственного момента
(спина) у электрона. Таким образом,
кратность вырождения
 -го энергетического уровня
-го энергетического уровня
 (17.8)
(17.8)
Символы
состояний
Различные состояния электрона в атоме
принято обозначать малыми буквами
латинского алфавита в зависимости от
значения орбитального квантового числа
 :
:
Квантовое
число
 0 1 2 3 4 5
0 1 2 3 4 5
Символ состояния s p d f g h (17.9)
Принято говорить о s-состоянии (или s-электроне), p-состоянии (или p-электроне) и т.д.
Значение
главного квантового числа
 указывают перед символом состояния с
данным
указывают перед символом состояния с
данным .
Например, электрон, имеющий главное
квантовое число
.
Например, электрон, имеющий главное
квантовое число и
и ,
обозначают символом
,
обозначают символом .
Выпишем последовательно несколько
состояний электрона:
.
Выпишем последовательно несколько
состояний электрона:
1s; 2s; 2p; 3s; 3p; 3d …
Схема уровней энергии для атома водорода в различных состояниях показана на рис. 1.
Мы
знаем, что испускание и поглощение света
происходит при переходах электрона с
одного уровня на другой. В квантовой
механике доказывается, что для орбитального
квантового числа
 имеется правило отбора
имеется правило отбора
 . (17.10)
. (17.10)
Правило
отбора является следствием закона
сохранения момента импульса при
испускании кванта. Фотон обладает
собственным моментом импульса – спином,
равным единице (в единицах
 ).
При испускании фотон уносит из атома
этот момент, а при поглощении привносит,
вследствие чего орбитальное квантовое
число
).
При испускании фотон уносит из атома
этот момент, а при поглощении привносит,
вследствие чего орбитальное квантовое
число меняется на единицу.
меняется на единицу.

Рис. 1
На рис. 1 показаны переходы, разрешенные правилом отбора (17.10). Переходы, приводящие к возникновению серии Лаймана, можно записать в виде:
 ,
,
серии Бальмера соответствуют переходы
 и
и

и т.д.
Состояние
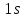 является основным состоянием атома
водорода. В этом состоянии атом обладает
минимальной энергией.
является основным состоянием атома
водорода. В этом состоянии атом обладает
минимальной энергией.
