
Модуль 25
Глава 18 Атомное ядро
18.1 Состав и характеристика атомного ядра
Состав ядра Экспериментально установлено, что атомное ядро состоит из протонов и нейтронов. Эти частицы называют нуклонами.
Протон
(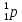 )
обладает положительным зарядом
)
обладает положительным зарядом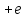 и массой
и массой
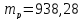 МэВ (18.1)
МэВ (18.1)
или
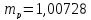 а.е.м.
а.е.м.
В
ядерной физике принято выражать массы
в единицах энергии, умножая их для этой
цели на
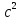 .
Применяется также единица массы,
называемая атомной единицей массы; 1
а.е.м. = 1,66·10-27
кг или 931,5 МэВ.
.
Применяется также единица массы,
называемая атомной единицей массы; 1
а.е.м. = 1,66·10-27
кг или 931,5 МэВ.
Для сравнения укажем, что масса электрона равна
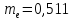 МэВ. (18.2)
МэВ. (18.2)
Отсюда
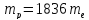 .
.
Протон имеет спин s=1/2 и собственный магнитный момент
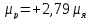 , (18.3)
, (18.3)
где
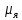 – ядерный магнетон (единица, в которой
измеряют магнитные моменты нуклонов)
,
– ядерный магнетон (единица, в которой
измеряют магнитные моменты нуклонов)
,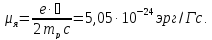
Ядерный магнетон в 1836 раз меньше магнетона Бора, т.е. собственный магнитный момент протона в 660 раз меньше магнитного момента электрона.
Нейтрон
(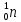 )
Его электрический заряд равен нулю, а
масса
)
Его электрический заряд равен нулю, а
масса
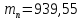 МэВ (18.4)
МэВ (18.4)
или
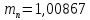 а.е.м.
а.е.м.
Разность масс нейтрона и протона равна
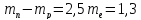 МэВ.
МэВ.
Спин нейтрона s=1/2 и , несмотря на отсутствие электрического заряда, нейтрон имеет магнитный момент
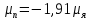 . (18.5)
. (18.5)
Знак минус означает, что «направления» спина и магнитного момента у нейтрона взаимно противоположны.
В свободном состоянии нейтрон нестабилен и самопроизвольно распадается по схеме:
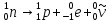 ,
,
где
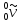 – антинейтрино, частица с массой покоя
равной нулю.
– антинейтрино, частица с массой покоя
равной нулю.
Период полураспада (время, за которое распадается половина первоначального количества нейтронов) равен примерно 12 мин.
Характеристика
атомного ядра
Основными величинами, характеризующими
атомное ядро, являются зарядовое
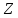 и массовое
и массовое
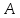 числа. Число
числа. Число
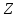 равно количеству протонов в ядре и
определяет его электрический заряд
равно количеству протонов в ядре и
определяет его электрический заряд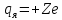 .
Его также называют атомным номером.
Массовое число
.
Его также называют атомным номером.
Массовое число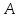 определяет число нуклонов в ядре. Число
нейтронов в ядре
определяет число нуклонов в ядре. Число
нейтронов в ядре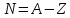 .
.
Для
обозначения ядер применяется символ
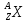 ,
где под
,
где под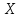 имеется в виду химический символ
элемента, которому принадлежит данное
ядро, например,
имеется в виду химический символ
элемента, которому принадлежит данное
ядро, например,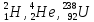 и т.д.
и т.д.
Конкретные атомы с данным числом протонов и нейтронов в ядре принято называть нуклидами.
Нуклиды
с одинаковым числом Z,
числом протонов, (т.е. принадлежащие
одному химическому элементу) называются
изотопами.
Так, например, у кислорода имеется три
стабильных изотопа
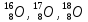 .
.
Водород
имеет три изотопа:
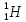 –
– обычный
водород, или протий (
обычный
водород, или протий (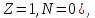 ядро – протон (
ядро – протон (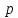 );
);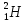 – тяжелый водород, или дейтерий (
– тяжелый водород, или дейтерий (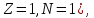 ядро
– дейтрон (
ядро
– дейтрон (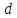 );
);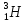 – тритий (
– тритий (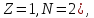 ядро – тритон (
ядро – тритон (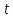 ).
).
Протий
и дейтерий стабильны, тритий радиоактивен
и распадается по
схеме:
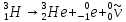 .
.
Известно
около 1500 ядер с различными
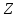 и
и ,
а также с различными и
,
а также с различными и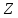 и
и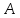 .
Из них ¼ устойчивы, остальные
радиоактивны. Многие из этих ядер не
встречаются в природе, а получены
искусственным путем посредством ядерных
реакций. В природе встречаются элементы
сZ
от 1 до 92, исключая технеций (
.
Из них ¼ устойчивы, остальные
радиоактивны. Многие из этих ядер не
встречаются в природе, а получены
искусственным путем посредством ядерных
реакций. В природе встречаются элементы
сZ
от 1 до 92, исключая технеций (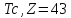 )
и прометий (Pm,
Z=61).
Остальные трансурановые элементы (с
)
и прометий (Pm,
Z=61).
Остальные трансурановые элементы (с
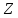 от 93 до 109) были получены искусственным
путем посредством различных ядерных
реакций.
от 93 до 109) были получены искусственным
путем посредством различных ядерных
реакций.
Размеры ядер В первом приближении ядро можно считать шаром, радиус которого довольно точно определяется формулой
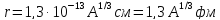 , (18.6)
, (18.6)
где
1фм = 10-13
см, ферми (фм) – название единицы длины,
применяемой в ядерной физике. Из этой
формулы вытекает важный вывод: масса
ядра, определяемая массовым числом
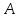 ,
пропорциональна его объему
,
пропорциональна его объему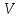 ,
поскольку
,
поскольку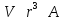 .
Следовательно, плотность вещества во
всех ядрах примерно одинакова и, как
показывает расчет, равна
.
Следовательно, плотность вещества во
всех ядрах примерно одинакова и, как
показывает расчет, равна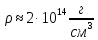 .
.
Спин
ядра
Спины нуклонов складываются в
результирующий спин ядра. Спин
нуклона ½, поэтому спин
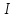 ядра может быть как целым, так и полуцелым
– в зависимости от числа нуклонов,
четного или нечетного.
ядра может быть как целым, так и полуцелым
– в зависимости от числа нуклонов,
четного или нечетного.
В
основных состояниях всех стабильных
ядер
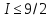 .
Это указывает на то, что спины большинства
нуклонов в ядре взаимно компенсируют
друг друга, располагаясь антипараллельно.
У всех четно-четных ядер (т.е. ядер с
четными числами протонов и нейтронов)
спин равен нулю.
.
Это указывает на то, что спины большинства
нуклонов в ядре взаимно компенсируют
друг друга, располагаясь антипараллельно.
У всех четно-четных ядер (т.е. ядер с
четными числами протонов и нейтронов)
спин равен нулю.
