
- •Оглавление
- •Введение
- •1. Основы номенклатуры гетероциклических соединений
- •2. Пятичленные гетероциклы с одним гетероатомом
- •2.1. Пиррол, фуран и тиофен в природе
- •2.2. Методы синтеза пятичленных гетероциклов с одним гетероатомом
- •2.3. Химические свойства пятичленных гетероциклов с одним гетероатомом
- •2.3.1 Электрофильное замещение в пирроле, фуране и тиофене
- •2.3.2. Особенности химических свойств пиррола
- •Конденсация с альдегидами и кетонами.
- •2.3.3. Особенности химических свойств фуранов
- •2.3.4. Особенности химических свойств тиофена
- •3. Конденсированные пятичленные гетероциклы с одним гетероатомом
- •3.1. Индолы в природе
- •3.2. Синтезы индолов
- •3.3. Химические свойства индолов
- •4. Пятичленные гетероциклы с двумя гетероатомами
- •4.1. 1,2-Азолы
- •4.2. 1.3-Азолы
- •4.2.1.Таутомерия и химические свойства 1,3-азолов
- •5. Шестичленные гетероциклы с одним гетероатомом
- •5.1. Пиридин
- •5.1.1. Методы синтеза пиридинов
- •5.1.2. Химические свойства пиридина
- •6. Конденсированные шестичленные гетероциклы с одним гетероатомом
- •6.1. Хинолины
- •6.1.1. Методы получения хинолинов
- •6.2. Изохинолины
- •6.2.1. Методы получения изохинолинов
- •6.3. Химические свойства хинолинов и изохинолинов
- •7. Шестичленные гетероциклы с несколькими атомами азота
- •7.1. Пиримидин
- •7.1.1. Химические свойства производных пиримидина
- •8. Биядерные гетероциклы с несколькими атомами азота
- •8.1. Пурины
- •9. Нуклеиновые кислоты, нуклеозиды, нуклеотиды
- •9.1. Строение нуклеиновых кислот
- •СПИСОК ЛИТЕРАТУРЫ

|
|
|
|
1 |
|
|
|
1 |
|
|
|
|
|
|
|
|
|
1 |
|
|
|
7 |
|
S |
2 |
1 |
|
|
5 |
1 |
|||
|
|
|
O |
|
|
|
|
4 |
||||||||
|
S |
|
|
|
6 |
|
|
3 |
N |
|
O |
|||||
3 |
2 |
3 |
|
|
2 |
|
|
2 |
|
N |
3 |
4 |
2 |
|||
|
|
|
|
4 |
|
|||||||||||
тиирeн |
|
оксиран |
|
5 |
|
|
|
|
O |
|||||||
|
|
|
|
|
|
|
|
|
3 |
|||||||
|
|
1 |
|
|
|
|
тиeпан |
1,3-диазeт |
1,3-диоксалан |
|||||||
|
6 |
|
N N 2 |
|
|
|
|
H |
|
|
|
|
|
|
||
|
5 |
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
N |
3 |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
1,2,4-триазин азиридин
Общепринятые и тривиальные названия и нумерация атомов приведены
вкаждом разделе для всех рассматриваемых гетероциклов.
2.Пятичленные гетероциклы с одним гетероатомом
|
4 |
3 |
5 |
1 |
2 |
z |
|
Z=O фуран, Z=S тиофен, Z=NH пиррол
2.1. Пиррол, фуран и тиофен в природе
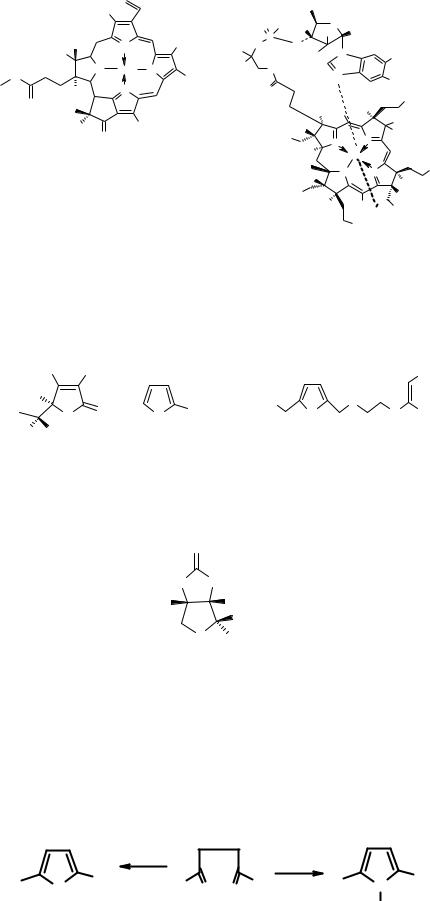
Пиррол входит в состав порфирина (I), на основе которого построен гем (II) – пигмент крови, обеспечивающий процесс дыхания, хлорофилла (III) – зелёного пигмента растений, ответственного за процесс фотосинтеза, витамина В12 (IV), пигментов желчи и др. Гем также входит в состав цитохромов – ферментов, обеспечивающих перенос электронов, а следовательно, процессов окисления и восстановления в биохимических реакциях. Хлорофилл и гемм синтезируются в живой клетке из порфобилиногена (V).
Me 
|
N |
Me |
N |
Me |
HO2C |
CO2H |
|
|
|
||||
NH |
HN |
Fe N |
|
|
||
N |
|
|
|
|||
|
N |
|
N |
|
|
N |
|
|
HO2C |
|
|
H N |
H |
|
|
|
|
|
||
порфирин |
|
|
|
2 |
|
|
|
Me |
|
порфобилиногeн |
|||
|
I |
HO2C |
|
|||
|
гeм |
|
|
V |
||
II
5
|
|
|
Me |
|
|
|
O- |
CH2OH |
|
|
|
|
|
|
|
|
|
O |
H |
O |
H |
|
|
|
|
|
|
|
Me |
|
P |
|
H |
|
|
|
|
|
H |
N |
Me O |
O |
|
|
|
||
|
|
Me |
|
N |
|
|
|||||
|
|
|
|
|
Me |
||||||
|
|
|
Mg N |
|
H |
H |
HO |
|
|||
|
|
|
N |
|
|
|
|
|
|||
|
O |
|
Et |
N |
|
..N |
|
|
|||
C20H39 |
|
|
N |
O |
|
|
Me |
||||
|
|
H |
|
|
|
|
|||||
O |
|
|
|
|
|
CONH2 |
|||||
|
|
H |
|
|
|
|
Me |
|
H |
||
|
|
|
|
|
|
Me |
|
||||
|
|
|
|
|
|
|
Me |
||||
|
|
MeO2C |
Me |
|
|
|
H |
|
|
||
|
|
|
H2NOC |
|
|
Me |
|||||
|
|
|
|
|
|
||||||
|
|
|
O |
|
|
|
N |
N |
|
||
|
|
|
хлорофилл-а |
|
|
|
H |
|
Co2+ |
|
|
|
|
|
|
|
|
Me |
N |
N |
CONH2 |
||
|
|
|
III |
|
|
|
|
Me |
|||
|
|
|
|
|
|
|
|
|
H |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H2NOC |
H |
Me CN |
Me |
|
|
|
|
|
|
|
|
|
|
CONH |
||
|
|
|
|
|
|
|
|
|
|
|
2 |
CONH2
витамин В12
IV
Тетрагидрофурановое кольцо входит в состав витамина С (VI), фурфурилтиол (VII) определяет запах жареного кофе, ранитидин (VIII) – один из наиболее коммерчески успешных медицинских препаратов, используемый для лечения язвы желудка.
|
HO |
OH |
|
|
|
|
NO2 |
|
|
|
|
|
|
|
|
||
|
H |
|
|
|
MeNH |
S |
|
|
HOCH2 |
O |
O |
O |
CH2SH |
N NHMe |
|||
|
O |
|||||||
H |
OH |
|
фурфурилтиол |
|
ранитидин |
H |
||
аскорбиновая кислота |
|
VII |
|
VIII |
|
|||
витамин С |
|
|
|
|
|
|
||
VI
(+)-Биотин (IX, витамин Н) содержит тетрагидротиофеновый цикл и представляет собой наиболее важное природное производное тиофеновой кислоты. Он содержится в дрожжах и яйцах.
|
O |
HN |
NH |
H |
H |
|
H |
S (CH2)4CO2H
(+)-биотин (витамин Н)
IX
2.2. Методы синтеза пятичленных гетероциклов с одним гетероатомом
Общий метод синтеза таких гетероциклов основан на использовании в качестве исходных 1,4-дикарбонильных соединений (метод Пааля-Кнорра). Пирролы образуются по схеме:
|
|
|
NH3 |
|
RNH2 |
|
|
|
|
|
|
|
|
|
|
Me |
N |
Me |
PhH Me O O |
Me |
Me |
N |
Me |
|
|
||||||
|
H |
|
|
|
|
R |
|
|
|
|
|
|
|
|
6
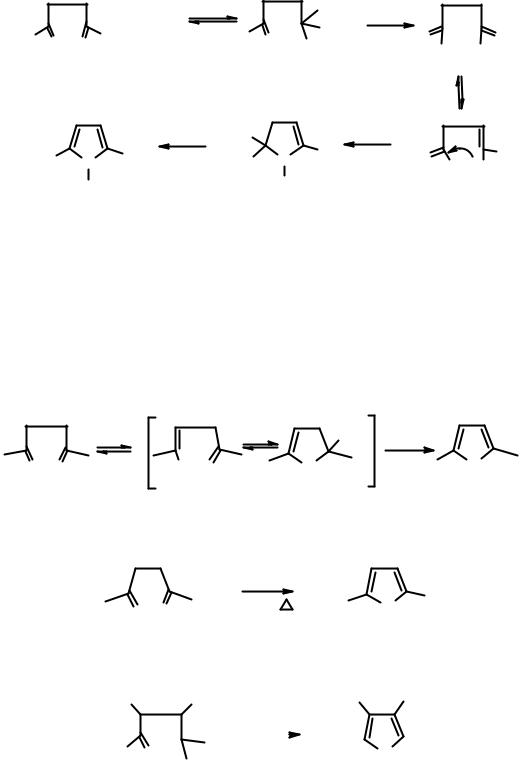
Реакция с аммиаком или первичными аминами позволяет получать либо N-незамещенные пирролы, либо N-алкилпирролы с хорошими выходами. Наиболее вероятный механизм процесса включает следующие стадии:
+ RNH2 |
|
NHR |
- H2O |
|
|
|
Me |
|
|||
Me |
O |
NR |
|||
Me O O Me |
|||||
O OH |
|||||
|
|||||
|
|
1 |
|
Me 2 Me |
|
|
- H2O HO |
Me |
|
Me |
|
Me N |
Me |
Me N |
O |
|||
|
Me :NHR |
|||||
R |
5 |
R 4 |
|
|
3 |
Нуклеофильная атака аминогруппой по карбонильному центру приводит к образованию полуаминаля 1, который при отщеплении воды образует имин 2, изомеризующийся в енамин 3. За счет нуклеофильной атаки аминогруппой енамина по второму карбонильному центру происходит циклизация в дигидропиррол 4, который ароматизуется в пиррол 5 за счет отщепления воды. Элиминирование воды на последней стадии происходит очень легко, т.к. приводит к энергетически выгодной ароматической структуре.
Аналогично происходит образование фуранов (Z=O) из 1,4- дикарбонильных соединений в кислой среде:
|
H+ |
|
OH -H2O |
O O |
OH O |
O |
O |
Ограничения метода связаны лишь с доступностью 1,4-дикарбонильных соединений. Если они доступны, то циклоконденсация идет с очень высокими выходами, например:
|
|
Bu-t |
TsOH |
|
|
Bu-t |
t-Bu |
O |
PhH, |
t-Bu |
O |
||
|
O |
|
||||
|
|
|
|
|
80% |
|
Очевидно, что использование 1,4-диальдегидов (или их скрытых форм, например, ацеталей) дает возможность получать 2,5-незамещенные фураны:
EtO2C |
CO2Et |
H2SO4 |
EtO2C |
CO2Et |
|
|
|
|
|
||
|
OEt |
|
|
|
|
H O |
50oC |
|
O |
||
OEt |
|
||||
|
|
|
|
90% |
|
|
|
|
|
|
|
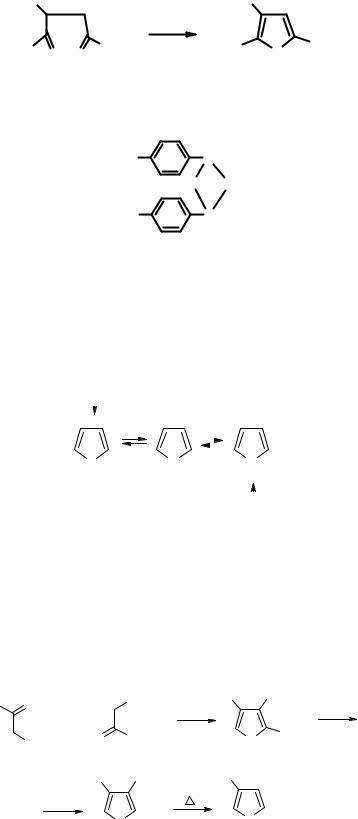
Аналогично по методу Пааля – Кнорра происходит и образование тиофенов:
7
R |
|
R |
|
|
P4S10 |
|
|
R O O R |
или H2S/HCl R |
S |
R |
|
|||
|
|
40 |
|
Выходы значительно растут при использовании в качестве осерняющего агента реактива Лоуссона.
MeO P S
S
S S
MeO P O
O
Реактив Лоуссона
В 1936 году Юрий Константинович Юрьев – профессор нашего университета – обнаружил взаимные превращения фурана, пиррола и тиофена друг в друга в каталитических условиях при высоких температурах (реакция Юрьева). Наилучшие результаты дают превращения фурана. При превращениях пиррола и тиофена выходы новых гетероциклических соединений очень низкие.
H2S
|
H O |
|
NH3 |
|
|
||||
|
|
|
|
||||||
|
|
|
|||||||
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
S |
H2S |
O |
|
H2O N |
|||||
|
|
NH3 |
|
|
|
|
H |
||
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
Al O , 350-400oC |
||||||||
|
2 |
3 |
|
|
|
|
|
|
|
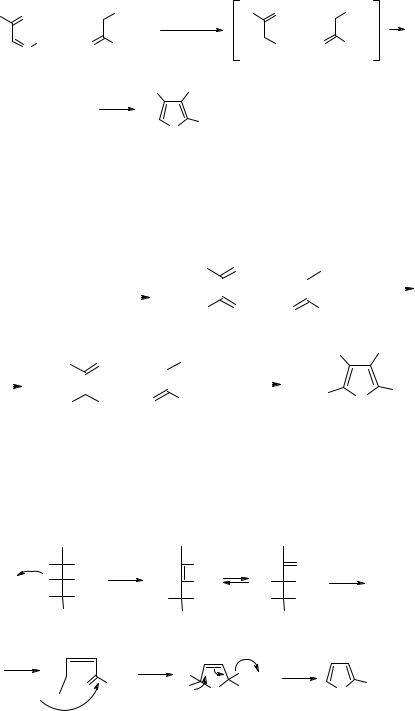
Перечисленные выше способы являются общими методами синтеза всех трех пятичленных гетероциклов. Однако для каждого из них в отдельности существуют и специфические методы получения. Синтез Кнорра – циклоконденсация α- аминокарбонильных и 1,3-дикарбонильных соединений в щелочных средах. Для предотвращения димеризации свободных α-аминокарбонильных соединений в пиразины их используют в виде солей. Аминокетоны генерируют in situ в реакционной среде при подщелачивании. Процесс идет по следующей схеме:
Me |
O |
|
|
|
CO2Et |
Me |
CO2Et |
|
|
|
KOH |
|
|||
|
|
|
|
+ |
|
|
|
|
+ |
|
|
|
H2O |
CO2H |
|
|
|
- |
O |
CO Me |
|||
|
Cl |
N |
|||||
|
NH3 |
|
|
2 |
H |
53% |
|
|
|
|
|
|
|
6 |
|
|
|
|
|
Me |
CO2H |
Me |
|
|
|
KOH |
|
|
|
|
|
|
|
1 дн |
|
N |
N |
|
|
|
|
|
|
|
H |
H |
|
|
|
|
|
|
60% |
73% |
|
Образующееся в результате реакции производное пиррола 6 можно превратить в 3- метилпиррол, поскольку пирролкарбоновые кислоты (а также фуранкарбоновые кислоты, см. ниже) при 180-200оС легко декарбоксилируются
8
Трудности, связанные с применением α-аминокарбонильных соединений, можно преодолеть, синтезируя их в реакционной среде в присутствии второго компонента (1,3- дикарбонильного соединения). Например, в качестве предшественника аминокетона можно использовать монооксим α-кетоальдегида, восстанавливая его цинком в уксусной кислоте или метабисульфитом натрия. Последовательность стадий в этом процессе точно не установлена.
Me |
O |
CO2Et |
|
Me |
O |
CO2Et |
|
|
+ |
Na2S2O5 |
|
+ |
|
|
N OH |
|
|
|
||
|
O Me |
|
|
NH2 |
O Me |
|
|
|
Me |
|
CO2Et |
|
|
|
|
|
N |
Me |
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
75% |
|
|
|
Эта модификация позволяет использовать в качестве единственного исходного 1,3- дикарбонильное соединение, благодаря его способности образовывать при нитрозировании оксимы. Так, обработка 2 моль ацетоуксусного эфира 1 моль NaNO2 в уксусной кислоте с последующим восстановлением цинком приводит к, так называемому, пирролу Кнорра.
MeCOCH2CO2Et |
1 моль NaNO2 |
Me |
O |
|
CO2Et |
Zn |
|
||||||||||
|
|
+ |
|
|
|
|
|||||||||||
|
|
|
|
|
|
AcOH |
|||||||||||
|
2 моль |
|
|
|
|
|
|
|
|
|
|
|
|||||
|
AcOH |
EtO2C |
NHOH |
O Me |
|
||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Me |
|
CO2Et |
|
|
|
|
|
Me |
|
O |
CO2Et |
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
+ |
|
|
|
|
|
|
EtO2C |
|
N Me |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
EtO2C |
|
NH2 O |
Me |
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
H |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
70% |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Широко известен специфический метод синтеза фурфурола (фуран-2-карбальдегида) кислотным гидролизом пентозосодержащих полисахаридов, добываемых из доступного природного сырья (оболочки семян, овес, кукурузные початки, капуста, сахарный тростник). Процесс идет с количественным выходом по схеме:
|
CHO |
|
CHO |
|
CHO |
|
|
||
H |
OH |
12% HCl |
|
OH |
|
O |
|
|
|
H+ HO |
H |
|
H |
H |
H |
|
|
||
|
|
|
|
||||||
H |
OH |
|
H |
OH |
H |
OH |
|
|
|
|
CH2OH |
|
CH OH |
|
CH OH |
|
|
||
|
|
|
|
2 |
|
2 |
|
|
|
|
|
CHO |
H |
|
OH H+ |
|
|
CHO |
|
HOCH |
O |
H |
O |
CHO |
-H2O |
O |
|||
|
|
||||||||
|
2 |
|
|
|
|
|
100% |
|
|
|
|
|
|
|
|
|
|
||
Образующийся фурфурол может быть двумя путями превращен в незамещенный фуран
9
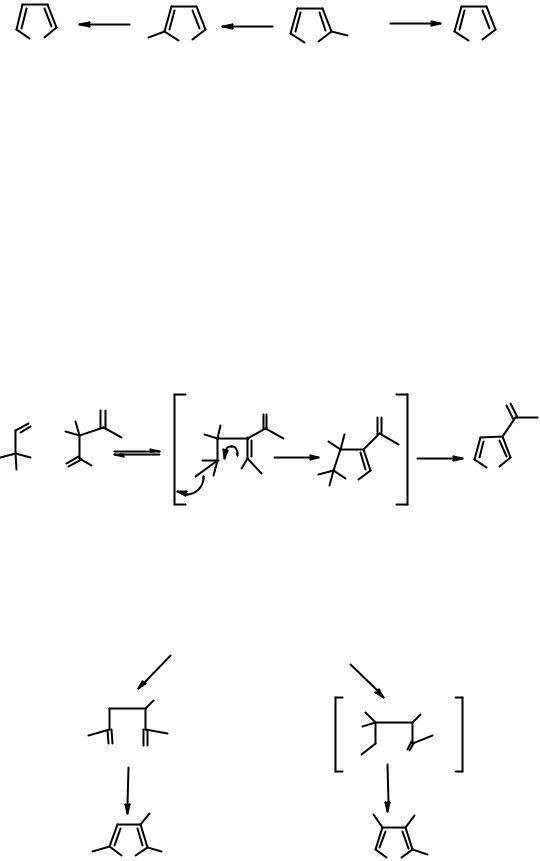
|
200oC |
1. NaOH |
|
Ni |
O |
HO2C |
O 2. H+ |
O |
CHO 280oC O |
75% |
|
86-90% |
|
|
|
Путь А |
|
Путь В |
|
Реакция Канниццарро позволяет с хорошим выходом превратить фурфурол в фуран-2-карбоновую кислоту, которая термически декарбоксилируется с образованием фурана (путь А), в результате каталитического декарбонилирования фурфурола (в качестве катализатора используется никель) также образуется фуран (путь В).
Широко используется для получения фуранов метод Фейста-Бенáри – взаимодействие α-галогенкарбонильных и 1,3-дикарбонильных соединений в присутствии оснований. Процесс образования 3-ацилфуранов упрощенно включает в себя альдольную конденсацию, причем в роли карбонильной компоненты выступает α-хлоркетон, а метиленовой – 1,3-дикарбонильное соединение. Затем происходит внутримолекулярная циклизация (нуклеофильное замещение хлора енолят-анионом) и ароматизация с отщеплением воды.
|
|
|
|
O |
|
O |
|
O |
|
|
|
H |
|
|
O |
||
|
|
|
|
|
|
|||
|
O |
H |
|
|
HO |
H |
HO |
H |
H |
+ |
|
|
|
H |
_ |
-H2O |
|
Cl |
O |
|
H |
- Cl- |
O |
|||
|
H |
|
Cl |
H O H |
||||
|
|
|
|
H |
O |
|||
|
|
|
|
|
|
|
H |
Следует иметь ввиду, что необходимые для синтеза фуранов по ПаалюКнорру 1,4-дикарбонильные соединения получают реакцией 1,3- дикарбонильных соединений с α-галогенкарбонильными.
|
|
MeCOCH2Cl + |
MeCOCH2CO2Et |
|
KI/EtONa/EtOH |
|
NaOH/H2O |
||
|
|
|
|
|
|
|
CO2Et |
Me |
CO2Et |
|
|
|
||
Me |
|
Me |
HO |
Me |
O |
|
O |
Cl |
O |
100-150oC |
|
|
|
|
(CO2H)2 |
|
CO2Et |
Me |
CO2Et |
|
|
|||
Me |
O |
Me |
|
O Me |
90% |
|
10% |
||
(Пааль-Кнорр) (Фейст-Бенари)
10
