
- •Ароматические диазосоединения классификация
- •Номенклатура
- •Изомерия
- •Способы получения
- •Общая схема
- •Механизм реакции в общем виде
- •Получение диазопроизводных.
- •Физические свойства
- •Электронное строение и устойчивость
- •Химические свойства
- •I. Реакции с выделением азота
- •3. Образование иодпроизводных.
- •4. Окисление
- •Практическая значимость
Химические свойства
I. Реакции с выделением азота
SN (чаще SN1) через арилкатион или SR.
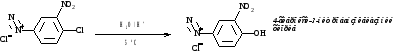
1. Получение фенолов (эффективный лабораторный способ)
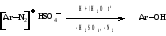
Применение гидросульфатов, а не хлоридов, подавляет конкурирующую реакцию замены на хлор.
Кислая среда уменьшает возможность побочной реакции азосочетания соли диазония и
образующегося фенола.
Температура увеличивает скорость замены на гидроксильную группу.
Механизм реакции

Метод используется в синтезах мезатона, фенатона, гваякола, витамина В6 и др.
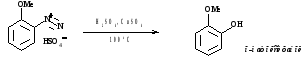
2. Образование фторпроизводных (реакция Шимана)
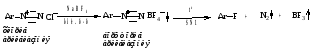
Побочные продукты - газы, выделение легкое.
Прямое фторирование аренов не проводят, т.к. реакция сильно экзотермическая.
3. Образование иодпроизводных.
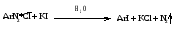
Побочные продукты: фенолы.
Преимущества: прямое иодирование возможно только π-избыточных для ароматических соединений, т.к.
реакция эндотермическая и обратимая.
-
Замещение диазогруппы водородом (метод удаления аминогруппы из ароматического соединения).
а) действием фосфорноватистой кислоты
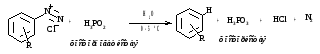
Реакция радикального характера SRN.
б) замещение формальдегидом
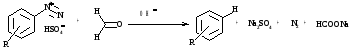
в) замещение спиртами
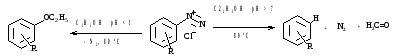
5. Реакция Зандмейера - катализатор соли Cu(I)
Температурный режим зависит от R в ароматическом кольце: Д- 5-20 , А- 60-100 .
Механизм реакции SRN
ArN2+ + Cu2X2 → ArN2∙ + CuX2
ArN2∙ → Ar∙ + N2↑
Ar∙ + CuX2 → ArX + CuX
Преимущества:
- при синтезе галогенпроизводных
хлорирование аренов дает смесь трудноразделимых о- п- изомеров.
- при синтезе бензойных кислот
окисление алкилгрупп протекает труднее, чем нитрогруппы, может затронуть другие фрагменты.
магнийорганические производные не все возможно получить.
6. Реакция Гаттермана - катализатор Cu+HCl
(на поверхности меди всегда присутствует некоторое количество Cu(+).
Аналогично р. Зандмейера.
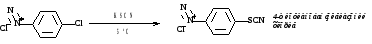
7. Образование сульфокислот
[ArN2]+Cl- + SO2 + CuCl2 + HCl → ArSO2Cl → ArSO3H
8.
Синтез биарилов по Гомбергу
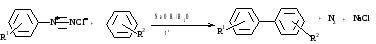
II. Реакции без выделения азота
-
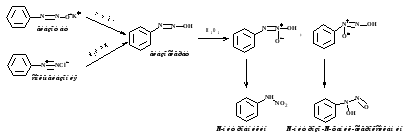
реакция азосочетания
SEаром. с сильноактивированными π-избыточными системами (ароматическими аминами, фенолами,
гетероциклическими соединениями и др.)
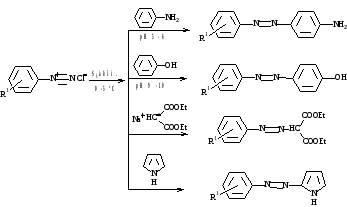
2. S NU в ароматическом кольце
Диазогруппа - акцепторным заместителем, сильнее, чем нитрогруппа, ускоряет процесс SN
для о-,п- положений. При наличии хорошо уходящей группы (Cl, NO2) и низких температурах
идет их замещение и сохранение диазогруппы.
При высоких температурах диазокатион неустойчив и замещается.
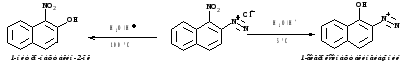
3.Восстановление (до фенилгидразинов)
а) хлоридом олова
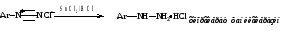
б) сернистой кислотой и ее солями
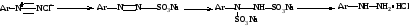
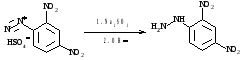
Арилгидразины применяется в химии сахаров, карбонильных соединений для получения кристаллических
производных. Наиболее часто используют 2,4-динитрофенилгидразин.
4. Окисление
Легко окисляются слабыми окислителями.
Практическая значимость
Соли диазония не применяются как биологически активные соединения из-за их неустойчивости,
но их значение в синтезе биологически активных веществ переоценить трудно.
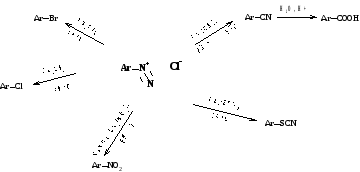
Замещение диазогруппы - наилучший практический метод введения заместителей в ароматическое ядро.
Цепочка почти универсальна: арены легко нитруются, выбор восстановителей нитросоединений широк,
почти все первичные амины дают соли диазония.
ArH → ArNO2 → ArNH2 → ArN2+ →ArX X= F, Br, Cl, I, H, NO2
OH, SH, OR, SR, SCN,
CN (COOH), SO2Cl (SO3H) и др.
При этом можно решать следующие задачи:
1. введение различных функциональных групп
2. использование амино-, нитро-групп как ориентантов, изменяющих скорость реакции, с последующим
удалением.
