
Эффект сопряжения (резонансный или мезомерный эффект)
Из данных по константам диссоциации замещенных бензойных кислот видно, что влияние заместителей не соответствует представлениям об индуктивном эффекте. Аналогичный вывод может быть получен при рассмотрении дипольных моментов дизамещенных бензолов.
Таблица 12
Значения констант диссоциации замещенных бензойных кислот

|
R |
Ка·105 |
R |
Ка·105 |
|
Н |
6,5 |
п-NO2 |
36,0 более удалена! |
|
|
10,4 ожидаемое |
м-NO2 |
35,1 |
|
м-Cl |
15,4 влияние |
п-CH3O |
3,38 (<H !) |
|
п-F |
7,22 (!) |
м-CH3O |
8,17 |
Эффект сопряжения проявляется в тех
случаях, если заместитель имеет π-связи,
р-электроны или вакантную низколежащую
орбиталь (это может быть B,Si,C![]() )
и находится при атоме углерода в состоянииsp2- илиsp-гибридизации
(C
)
и находится при атоме углерода в состоянииsp2- илиsp-гибридизации
(C![]() C,
С
C,
С![]() С,
С
С,
С![]() Саром.).
Происходит перекрывание р- или π-орбиталей
заместителя с орбиталями углеродных
связей цепи или ароматического кольца.
В результате заместитель оказывается
связанным с остатком молекулы кроме
обычной σ-связи небольшим π-электронным
облаком. В этом случае говорят, что
р-электроны или π-связи заместителясопряженыс π-связями остатка
молекулы. Таким образом, при сопряжении
связи оказываются нецелочисленными,
происходит так называемая «делокализация
связей».
Саром.).
Происходит перекрывание р- или π-орбиталей
заместителя с орбиталями углеродных
связей цепи или ароматического кольца.
В результате заместитель оказывается
связанным с остатком молекулы кроме
обычной σ-связи небольшим π-электронным
облаком. В этом случае говорят, что
р-электроны или π-связи заместителясопряженыс π-связями остатка
молекулы. Таким образом, при сопряжении
связи оказываются нецелочисленными,
происходит так называемая «делокализация
связей».
Делокализацией связей(неподеленных пар, зарядов, спинов) называется распределение одной валентной электронной пары (неподеленной пары, заряда, некомпенсированного спина) по нескольким связям (между несколькими атомами).
Делокализация приводит к дробным порядкам связей, дробным зарядам или спинам на атомах, но при этом сумма порядков связей, зарядов и дробных спинов одного атома должна быть равна его классической валентности. В рамках подхода МО-ЛКАО легко показать, что такая делокализация связей, неподеленных электронных пар, зарядов и спинов является энергетически выгодной. В этом заключается причина несоответствия реального распределения электронного облака молекулы схемам, вытекающим из концепции о целочисленности связей или из метода валентных связей.
Для химиков более удобны и привычны атомные и молекулярные модели, полученные из метода валентных связей. Поэтому можно сохранить как классические структурные формулы, так и соответствующие квантовохимические модели, используя для изображения одной молекулы несколько структурных формул, либо одну формулу со стрелками, указывающими так называемые «электронные смещения», или нецелочисленными связями и дробными зарядами. При этом истинная структура молекулы представляется сочетанием формул электронных изомеров, называемых резонансными (или предельными, или каноническими) структурами. Следует отметить, что электронные изомеры не существуют как отдельные частицы, нет никакого равновесия между ними, истинная молекула представляет собой нечто усредненное, гибридное, промежуточное между ними.
Правила обращения с классическими атомными моделями (на языке метода валентных связей) при конструировании из них моделей молекул
Введены следующие три правила резонанса (мезомерии, сопряжения):
1) Каждая из р-орбиталей перекрывается с р-орбиталями всех соседних атомов, если выполнено условие копланарности (параллельности осей симметрии р-орбиталей). Все копланарные атомы расположены в одной плоскости, которая совпадает с общей узловой поверхностью соответствующих р-орбиталей.
2) р-электрон способен к частичной компенсации своего спина с несколькими другими р-электронами, находящимися на соседних копланарных р-орбиталях, причем часть спина может при этом оставаться некомпенсированной. Частичной компенсации спинов соответствуют дробные π-связи.
3) Одна и та же пара р-электронов может одновременно образовывать несколько π-связей и наряду с этим обладать частично свойствами неподеленной пары на одной из атомных р-орбиталей.
На этих трех постулатах основано представление о резонансе, мезомерии или сопряжении π-электронных систем. Эти три термина в определенной степени перекликаются.
Термин «резонанс» пришел из квантовой механики.
«Мезомерия» – чисто химическое понятие. Мезомерия дословно переводится как «между частями». Это понятие подразумевает промежуточность реальной структуры молекулы (в распределении зарядов и связей) по сравнению с гипотетическими структурами, изображенными посредством нескольких классических структурных формул; другими словами, точное представление структуры является промежуточным между двумя или более формулами Льюиса.
Термин «сопряжение»первоначально выражал чередующееся расположение ординарных и двойных связей. Постепенно им стали обозначать все случаи резонанса или мезомерии, связанные с участием во взаимодействии-орбиталей. Так как наиболее важные приложения резонансных (мезомерных) представлений относятся к таким системам, то, как правило, в органической химии все три термина употребляют как синонимы.
Резонансное взаимодействие имеет место во всех случаях, когда электронное строение молекулы не может быть отражено только одной предельной структурой. Различные предельные структуры называются резонирующими каноническими структурами, а реальное основное состояние молекулы, изображаемое их совокупностью, является «резонансным гибридом» этих предельных структур. Выигрыш энергии (энергетическая стабилизация молекулы) по сравнению с наиболее стабильной по аддитивной оценке предельной структурой называетсяэнергией резонанса. В связи с этим и говорят о резонансной стабилизации молекул.
Рассмотрим, как изображаются аллильные частицы (катион, анион, радикал) с помощью резонансных (канонических) структур, «классических» структур с изогнутыми стрелками и структур с нецелочисленными связями:

Крайнее правое обозначение аллильного катиона наиболее близко к его реальной структуре.
Виды резонанса
1) Неполярный резонанс
Свойственен всем сопряженным системам, состоящим из углеродов в состоянии sp2- илиsp-гибридизации, если число р-электронов равно числу копланарных р-орбиталей:

См. также выше (аллильный радикал).
В итоге появляются некомпенсированные спины, происходит частичное выравнивание -связности (в соответствии с правилом 2). Вес конкретной канонической структуры тем больше, чем ниже соответствующий ей энергетический уровень, т. е. чем стабильнее структура. исходя из этого, для бутадиена вес (вклад) бирадикала мал, так как в нем отсутствует одна-связь.
2) Полярный резонанс

См. также выше (аллильный катион, аллильный анион).
Полярный резонанс приводит к перераспределению -связности, неподеленных электронных пар и зарядов (в соответствии с правилом 3).
Способ изображения полярного резонанса со стрелками позволяет обходиться одной структурной формулой наиболее стабильной предельной структуры, «исравленной» путем применения дополнительных символов.
Классификация структурных единиц в теории резонанса
1) Неполярные π-электронные системы
В пределах этих систем с одной или несколькими π-связями невозможно «внутреннее» полярное сопряжение. Простейшие системы этого типа – этилен, 1,3-бутадиен.
2) Акцепторные заместители (–R, –C, –M)
Акцепторные заместители– это такие заместители, первый атом которых имеет вакантную низко лежащую р-орбиталь:
а) либо в наиболее стабильной классической (предельной) структуре.

б) либо в одной из других менее стабильных предельных структур, причем первый атом, как правило, связан -связью с более электроотрицательным атомом; чем больше разность электроотрцательностей, тем больше –R-эффект заместителя.

Если первый атом в заместителе является элементом 3-го или следующего периодов, имеющим вакантную d-орбиталь, способную перерываться с р-орбиталями и участвовать в полярном сопряжении, то такой заместитель может проявлять –R- и +R-свойства (–SR) или только –R-свойства (SiR3).
3) Донорные заместители (+R, +C, +M)
+R-эффект проявляют все заместители, которые имеют неподеленную электронную пару на первом атоме, причем внутри второго периода +R-эффект тем больше, чем меньше заряд ядра:
7N>8O>9F
+R-эффект проявляют также заряженные атомы; их эффект также тем больше, чем меньше заряд ядра, и больше, чем эффект тех же атомов в незаряженном состоянии.
Примеры донорных заместителей:

Четыре типа полярного резонанса
–R-заместитель и неполярная π-система


2. +R-заместитель и неполярная π-система

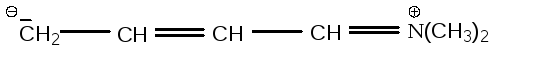
3. –R-заместитель и +R-заместитель, непосредственно связанные друг с другом σ-связью

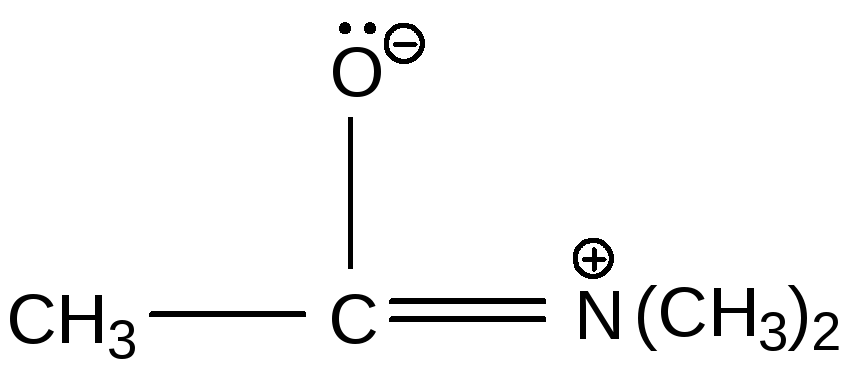
4. –R-заместитель и +R-заместитель, связанные через π-систему


Видно, что двойная связь и любая другая -электронная система (NN,CC) ведут себя либо как –R, либо как +R-группа, в зависимости от характера заместителя, с которым она сопряжена. Кроме того,-электронная система может выступать также в роли проводника полярного резонанса (сопряжения).
Лекция 6
Сопряженные и несопряженные положения
В -электронных системах различают взаимно сопряженные и несопряженные положения. Сопряженными называют такие положения, одно из которых в какой-либо из канонических структур обладает положительным зарядом и вакантной орбиталью, а второе – отрицательным зарядом и неподеленной парой. Если –Rи +R-заместители примыкают к-системе в ее сопряженных положениях, то между ними возможен резонанс, поскольку в этом случае-система выполняет роль проводника сопряжения.
Если условие сопряженности положений не выполняется, то такие два положения называются несопряженными. Полярное сопряжение между –Rи +R-заместителями, присоединенными к-системе в несопряженных положениях, невозможно.
Как правило, смещения электронов в результате сопряжения незначительны, и длины связей практически не изменены (об этом судят по величине дипольного момента). Даже при большом эффекте сопряжения заряды на крайних атомах сопряженной системы невелики:
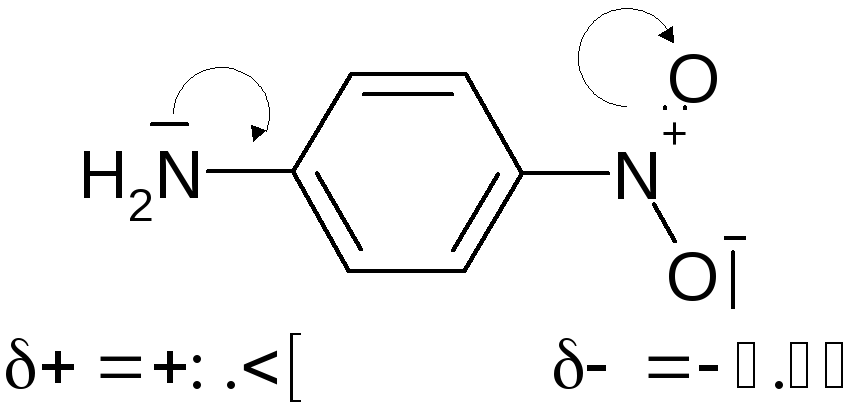
В качестве исключения выступают симметричные системы сопряженных связей с целочисленным зарядом на терминальном атоме, в которых распределение электронов по атомам и связям симметрично, например, аллильные катион и анион, карбоксилат-анион (см. выше).
Для экспериментального доказательства существования эффекта сопряжения и его относительной силы обычно сопоставляют величины рКазамещенных бензойных кислот (см. выше), анилинов или дипольные моменты, например, производных бензола и метана в газовой фазе. Например:
СH3RС6H5R
CH3–ClC6H5–Cl


-1.86 -1.69 –F+C
(знак «минус» означает, что дипольный момент направлен в сторону заметителя)
CH3–OCH3 C6H5–OCH3


-1.28 1.30 –F +C
CH3–NO2C6H5–NO2


-3.54 -4.23 –F, –C
Таким образом, заместитель при ароматическом ядре проявляет два эффекта, эффект поля (индукционный) и эффект сопряжения (резонансный), в разном сочетании в зависимости от природы заместителя:
+F, +C; –F, +C; +F, –C; –F, –C;
при этом существенное значение имеет относительная сила каждого из них.
Для оценки эффекта сопряжения можно использовать также данные ЯМР.
Методы графического изображения влияния заместителей на изменение распределения -электронного облака в молекуле (на делокализацию кратных связей)
1) С помощью изогнутых стрелок (метод электронных смещений)
Выбирают ту каноническую структуру, которая ближе соответствует истинному строению молекулы. С помощью изогнутых стрелок указывают только те смещения, которые произошли дополнительно после его введения в молекулу.
Недостаток – загромождение формул стрелками.
2) С помощью резонансных (канонических) структур
Канонические структуры различаются распределением -электронов и неподеленных электронных пар. Выписывают лишь структуры с наибольшим вкладом, особенно отражающие влияние заместителя. Наглядно показывает все положения, сопряженные с заместителем.
Недостаток – необходимо выписывать большое число структур.
3) Системы с симметричным распределением (перераспределением) электронов
См. выше (аллильные системы, карбоксилат-анион, нитрогруппа, катион нитрония).
Как и индуктивный эффект, R-эффект уменьшается с расстоянием, и если в сопряжении не участвуют вакантные орбитали или отрицательно заряженные атомы, затухает примерно через три двойные связи.
Заместитель, присоединенный к системе сопряженных -связей, существенно изменяет заряды в сопряженных положениях, вследствие чего в цепи сопряженных связей возникает альтерация заряда либо по величине, либо по знаку заряда. Тоже самое относится к заместителям, присоединенным к бензольному кольцу: происходит альтернирование заряженности атомов углерода ароматического ядра, которая зависит от природы заместителя, характера его полярного и резонансных эффектов. При этом, кроме мезомерного (резонансного) эффекта заместителя, большое значение имеет-индуктивный эффект (поляризация-связи под действием заряда на углероде, возникшего при введении заместителя).
Если между заместителем и бензольным ядром включена группа СН2, то заместитель нен может проявить эффект сопряжения и оказывает влияние на состояние бензольного ядра только вследствиеF-эффектаи -поляризационного эффекта.
Эффект заместителя зависит от природы растворителя. Иногда эта зависимость весьма существенна.

Если записать ЯМР 13С спектр этой молекулы, то химический сдвиг атома С(4) в различных растворителях будет разным: в гексане 5,7; в ТФУК (трифторуксусная кислота) 7,5 м. д. Чем больше химический сдвиг, тем в более слабом поле находится ядро, т. е. тем меньше ядро экранируется электронами. Благодаря водородной связи (ВС), означающей частичный (или даже полный) перенос протона, происходит еще большее, чем в неполярном гексане, уменьшение электронной плотности в положении С(4), т. е. увеличение, по сравнению с гексаном, –I- и –R-эффектов.


Химический сдвиг атома С(4) анизола в гексане –7,7; в ТФУК –5,7. Под воздействием водородной связи отрицательный индуктивный эффект (–I) увеличивается, а положительный резонансный эффект (+R) уменьшается. Поскольку для этого заместителя резонансный эффект превалирует, уменьшение +R-эффекта приводит к уменьшению электронной плотности на атоме С(4). В целом заместитель нагнетает электронную плотность в кольцо, особенно в сопряженные положения.
Степень проявления эффекта сопряжения (резонанса) зависит от наличия других заместителей в сопряженных положениях. Если оба заместителя имеют R-эффекты разных знаков, то эффект каждого из них усиливается, если одного знака – то ослабляется. Чем больше эффекты сопряжения заместителей, тем сильнее проявляет свой эффект каждый из них.
Так как наибольший –R-эффект проявляют атомы с вакантными орбиталями, в частности, карбокатионы, то заместители с +R-эффектом, находящиеся в сопряжении с карбокатионным центром, проявляют его в наибольшей степени и тем самым стабилизируют карбокатионы.
Рассеивание полярного сопряжения
Перекрестное сопряжение (кросс-сопряжение): в молекуле этилового эфира п-аминобензойной кислоты влияние карбонильной группы на этокси- и п-аминофенильную группу меньше по сравнению с тем действием, которое оказала бы карбонильная группа на каждую из этих групп при отсутствии другой.

Влияние стерических эффектов
Если правило 1 резонанса, т. е. условие копланарности р-облаков, нарушается, то эффект сопряжения уменьшается. Это имеет место, например, в тех случаях, когда в о-положениях ядра имеются объемные группы, и заместитель оказывается вынужденно повернут:

В данном примере метильные группы мешают выполнению условия копланарности, они как бы «выворачивают» аминогруппу из плоскости.
Эффекты сопряжения элементов третьего периода
Атомы элементов IIIпериода, стоящие правееSi, а именноP,S,Cl, могут проявлять эффекты сопряжения двух знаков:
+С за счет электронных пар, которые лежат на внешней электронной орбитали.
![]()
–С: вследствие имеющихся вакантных d-орбиталей (превалирующий только у фосфора).
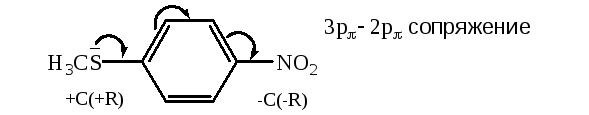

выч.=3,99 D, эксп.=4,43 D


выч.=2,24 D, эксп.=2,82 D
эксп.>выч., следовательно, эффекты взаимно усиливают друг друга (имеет место экзальтация дипольного момента). Горизонтальными стрелками указано направление дипольных моментов.
Общие правила резонанса по Марчу
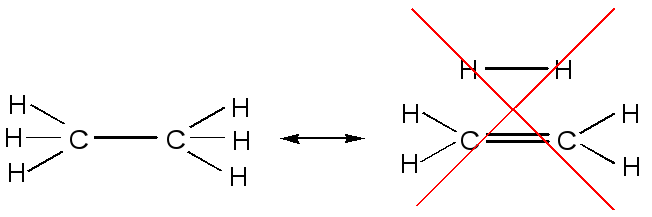
1) Все канонические структуры должны быть обязательно структурами Льюиса, то есть эти структуры должны быть составлены из атомных моделей (например, углерод не может быть пятивалентным).
2) Во всех структурах положения ядер должны быть одинаковы, т. е. можно менять только распределение электронов.
3) Все атомы, участвующие в резонансе или в сопряжении, должны лежать в одной плоскости. Атомы, участвующие в резонансе, окружены делокализованными электронами (или электронными облаками).
4) Все канонические формы должны иметь одинаковое число неспаренных электронов.
5) Энергия истинной молекулы меньше энергии любой из канонических структур; делокализация электронов является стабилизирующим фактором.
6) Вклад отдельных канонических форм в истинную структуру молекулы неодинаков; он пропорционален их стабильности; наиболее устойчивая каноническая форма дает наибольший вклад. Чем больше число эффективных канонических структур и чем ближе по величине их вклады (энергии), тем больше энергия резонанса.
а) Чем больше число ковалентных связей в структуре, тем она устойчивее.
![]()
(5 ковалентных связей С−С)
![]()
(4 ковалентные связи С−С)
б) Чем в большей степени разделены разноименные заряды, тем меньше устойчивость структуры. Структуры, несущие формальные заряды, менее устойчивы, чем незаряженные. Структуры, имеющие более двух формальных зарядов, обычно дают очень незначительный вклад в резонанс. Особенно неэффективны в этом отношении структуры с одноименными зарядами на соседних атомах.
в) Чем больше электроотрицательность атома, несущего отрицательный заряд в канонической структуре, тем устойчивее эта структура.

(вносит гораздо больший вклад)
В енолят-анионе электронная плотность сосредоточена в основном на атоме кислорода (но в кето-енольной таутомерии преобладает кето-тутомер).
Кето-енольная таутомерия:

преобладает кето-таутомер
г) Нарушение длин связей или валентных углов приводит к значительному снижению устойчивости ( стабильности) структуры.

 п-Cl
п-Cl