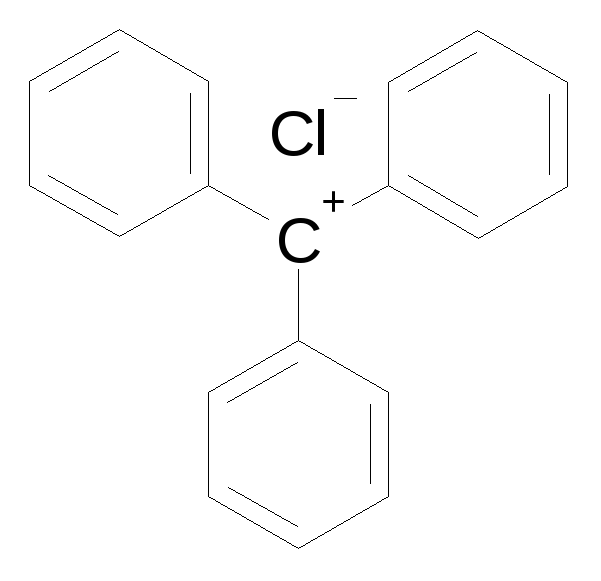
Полярность связей в органических молекулах
Полярными связями называются такие ковалентные связи, в которых центр тяжести положительных зарядов не совпадает с центром тяжести отрицательных зарядов. Следовательно, связи между различными атомами в двухатомных молекулах и между различными группами в многоатомных молекулах всегда полярны из-за различия электроотрицательностей. Бόльшая часть ковалентных связей – полярные, представляя собой нечто промежуточное между ковалентной и ионной связью.
|
A : A |
A:- B+ |
:AB |
|
Cl–Cl |
F–Cl |
|
|
H3C–CH3 |
Cl–CH3 | |
|
C6H5–C6H5 |
C6H5–CH3 |
Вследствие смещения электронной плотности связи в сторону более электроотрицательного атома в направлении этой связи возникает дипольный момент.
Дипольный момент
Таким образом, полярность связи можно оценить, исходя из ее дипольного момента. Однако измерить можно только дипольный момент молекулы, являющийся в общем случае векторной суммой моментов связей и свободных электронных пар.
мол= ē·l
где l– расстояние между центрами тяжести положительных и отрицательных зарядов молекулы.
Грубо говоря, индивидуальные моменты связей одинаковы в разных молекулах, хотя они и не всегда постоянны.
Таблица 8
Дипольные моменты связей
|
Связь |
H–C |
H–N |
C–O |
С–S |
C–N |
C–F |
C–Cl |
C–Br |
C–I |
|
, D |
0,2 |
1,4 |
1,1 |
1.56 |
0,4 |
1,83 |
2,05 |
2,04 |
1,8 |
Из сравнения дипольных моментов связей следует, что полярность связи тем больше, чем больше разность электроотрицательностей образующих связь атомов.
Исключение составляют связи C–OиC–S,C–FиC–Clиз-за сильного увеличения длины связи при переходе от элементов 2-го к элементам 3-го периода:
C–O C–S C–F C–Cl
1,1D < 1,56D 1,83D < 2,05D
Дипольные моменты кратных связей больше, чем соответствующих ординарных:
Таблица 9
Дипольные моменты кратных связей
|
Связь |
C–O |
C=O |
C–N |
CN |
|
, D |
1,1 |
2,5 |
0,4 |
3,3 |
Вывод о направлении дипольного момента можно сделать, исходя из данных по электроотрицательности атомов–компонентов связи: атом, имеющий меньшую электроотрицательность, является положительным концом диполя. Однако для сопряженных (ароматических) систем это правило соблюдается не всегда.

Значение дипольного момента в направлении линии связи можно использовать для сравнительной качественной оценки полярности связей (относительной полярности).
Дробный или частичный заряд
В органической химии часто используют понятие «частичный заряд», «дробный заряд». Частичный заряд – это доля электрона, приходящаяся на данный атом:
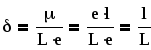
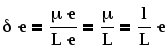
где L– межъядерное расстояние (длина ковалентной связи),l– расстояние между центрами единичных зарядов в диполе, ·e – величина самого частичного заряда.
Это соотношение носит качественный характер, поскольку не учитывает инкремент, вносимый в дипольный момент связи неподеленной парой электронов.
Индуктивный эффект
Индуктивный эффект(этот же эффект в различных учебниках называют еще электронным или полярным) – это способность заместителя передавать свое влияние по цепи ковалентно связанных атомов. При этом заместитель также испытывает на себе влияние остатка молекулы, к которому он присоединен.
Передача влияния заместителя по линии σ- или -связей приводит к изменению электронного состояния этих связей: происходит их поляризация, которая оказывается различной в зависимости от типа связи.
σ-связи. Наблюдается постепенное уменьшение изменения электронного состояния связей:
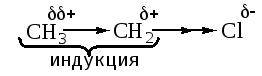
+ < +
Поляризация связи между атомами хлора и углерода вызывает индукционную (индуктивную) поляризацию соседней связи С–С; заместитель при этом проявляет –Iиндуктивный эффект. В наибольшей степениI-эффект проявляется на соседней к заместителю связи. С ростом цепи индукция быстро затухает.
-связи. I-эффект заключается в поляризации-облаков. Имеет место для изолированных-связей.
Если заместитель имеет ионные заряды или диполи, то электростатическое взаимодействие может осуществляться не только по линиям связей, но и непосредственно через пространство или молекулы растворителя. Такое влияние заместителя называют эффектом поля (F-эффект). Во многих случаях он более важен, чемI-эффект. На близком расстоянии оба эффекта трудно разделить, и чаще всего их рассматривают вместе под общим названием «полярный эффект», «электронный эффект», либо употребляют термины «индуктивный эффект», «эффект поля», подразумевая при этом одновременное действие обоих эффектов. Влияние заместителей на удаленные положения (1,4- и более) лишь в ничтожной степени передается по линии связей и в основном сводится к влиянию через пространство.
Полярный эффект заместителя является вполне определенной величиной, мера его проявления зависит от структурных факторов, от наличия и природы других заместителей в молекуле, от растворителя и др. Качественно оценка I-эффекта производится путем сравнения влияния заместителя на химические, физико-химические, (константы ионизации) или физические (дипольные моменты, ЯМР) свойства соединений по характеру и величине со стандартным заместителем – атомом водорода: сравнивается изучаемое соединениеR–X(со связью С–Х) и стандартное соединениеR–H(со связью С–Н). При этом полярность связи С–Н принимается равной нулю, т. е. не принимается во внимание ее небольшой дипольный моментC-H=0,2-0,4D.H– эталон, точка отсчета; отсюда исходит понятие о том что является донором, а что акцептором.
Если заместитель по сравнению с водородом увеличивает электронную плотность по цепи атомов (в том числе уменьшает имеющиеся в ней под влиянием других атомов положительные заряды), то он называется электронодонорным заместителем (+I-заместителем) и проявляет +I-эффект.
Если заместитель по сравнению с водородом оттягивает на себя электроны, и атомы цепи оказываются положительно заряженными (или происходит уменьшение отрицательной заряженности цепи, если таковая была в ней до введения заместителя), то он называется электроноакцепторным заместителем (–I-заместителем) и проявляет –I-эффект.
В действительности ни отдачи, ни захвата электронов не происходит, а имеется в виду просто разница в положении электронов связи, соседней к заместителю, по сравнению с водородным заместителем:
–I-группа: O2NCH2Ph
+I-группа: O¯CH2Ph
Стандарт: H–CH2–Ph
Если влияние заместителя передается только по линиям связей, то следует ожидать, что чем больше электроотрицательность заместителя. находящегося при углеродном атоме цепи, тем больше поляризация связей и тем больше –I-эффект заместителя:
Таблица 10
Индуктивные эффекты различных групп по отношению к водороду
|
+I-эффект |
–I-эффект | ||||
|
O |
<————————— Уменьшение эффекта |
NR3 |
COOH |
OR | |
|
COO |
SR2 |
F |
COR | ||
|
CR3 |
NH3 |
Cl |
SH | ||
|
CHR2 |
NO2 |
Br |
SR | ||
|
CH2R |
SO2R |
I |
OH | ||
|
CH3 |
CN |
OAr |
C≡CR | ||
|
|
SO2Ar |
COOR |
Ar | ||
|
|
|
|
CH=CR2 | ||
Полуколичественная оценка индуктивных эффектов
1) Метод дипольных моментов. Но если заместители имеют разные атомы с неподеленными парами, то этим методом пользоваться нельзя, так как
μ = μэл + μнеп
По значению μнельзя сделать вывод о знаке полярного эффекта.
2) Метод констант ионизации. Чем больше –I-эффект заместителя, тем больше он делокализует заряд в анионе, тем стабильнее анион и тем больше Ка(меньше рКа).
Таблица 11
Оценка индукционных эффектов заместителей по константам ионизации замещенных уксусных кислот
X –CH2COOH
X–CH2COO
+ H
–CH2COOH
X–CH2COO
+ H
![]()
|
X |
|
Электронный эффект |
|
CH3 |
1,34 |
+I-эффект |
|
H |
1,76 |
Стандарт |
|
CH2=CH |
4,52 |
<——————— Возрастание –I-эффекта |
|
C6H5 |
4,88 | |
|
CH3O |
29,4 | |
|
F |
259 | |
|
NC |
356 |
3) Метод спектроскопии ЯМР. Позволяет оценивать относительные значения положительного заряда в молекуле СН3Х: чем в более слабое поле сдвинут сигнал протонов метильной группы, тем более дезэкранировано ядро, т. е. тем более оттянуты с него валентные электроны. Действительно, имеется хорошая корреляция между химическим сдвигом и электроотрицательностью.
Сравнение заряженных и не заряженных заместителей
Заряженные атомы (группы) проявляют более сильный –I-эффект, чем незаряженные:
![]()
Отрицательно заряженные атомы (заместители) проявляют эффект противоположного знака по сравнению с теми же атомами (заместителями) в незаряженном состоянии:
ROH: –I
RO: +I
У отрицательно заряженного атома +I-эффект тем больше, чем меньше его электроотрицательность, т. е. чем меньше заряд ядра атома в периоде:
![]()
(С6,N7,O8)
и чем больше заряд ядра и радиус атома в группе:
![]()
Для углеводородных (алкильных) групп +I-эффект возрастает в ряду:
![]()
–I-эффект увеличивается в том же ряду, в каком увеличивается электроотрицательность гибридизованного углерода:
–I:sp3<sp2<sp
т. е. чем больше доля s-орбитали, тем больше отрицательный индуктивный эффект.
В целом влияние заместителей на состояние σ-связей обычно незначительно и обычно в формулах специально не показывается.
Лекция 5