
Лекция 15.
-
1,3-Диполярное присоединение
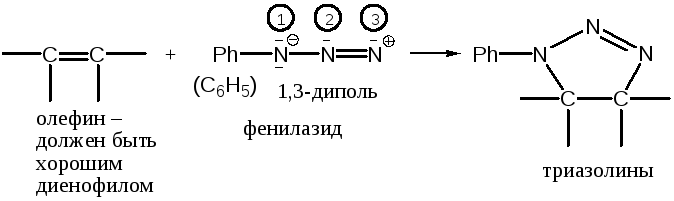
Это – один из примеров большой группы реакций [2+3]-циклоприсоединения, в результате которых при присоединении 1,3-диполей к двойным связям образуются 5-членные гетероциклические соединения.
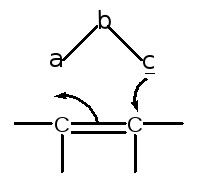
В общем случае структуру диполя можно представить так:

Поскольку соединения с секстетом электронов на внешней оболочке одного из атомов обычно нестабильны, то на самом деле система a-b-c является одной из форм резонансного гибрида, и можно нарисовать еще как минимум одну резонансную форму, например, для азидов:
![]()
Встречаются две основные группы 1,3-диполей.
-
Соединения, у которых атом, обладающий секстетом электронов в 1,3-диполярной канонической форме, содержит в этой форме двойную связь, а в другой канонической форме у этого атома находится тройная связь:

-
Соединения, у которых атом, обладающий секстетом электронов в 1,3-диполярной канонической форме, содержит в этой форме ординарную связь, а в другой канонической форме – двойную связь:

Примером являются азоксисоединения:

Механизм присоединения:
Это перициклическая реакция – одностадийное синхронное стереоселективное (в случае олефинов – стереоспецифическое) син-присоединение:
Ориентация:
Простых правил ориентации не существует. Сложную региоселективность присоединения можно объяснить с помощью метода молекулярных орбиталей (МО).
В эти реакции могут вступать и ацетиленовые углеводороды:

-
Реакции Дильса-Альдера

Эти реакции происходят достаточно быстро, с хорошим выходом, и находят широкое применение.

Z, Z' = CHO, C(O)R, COOH, COOR, C(O)Cl, C(O)Ar, CN, NO2, Ar, CH2OH, CH2NH2, CH2CN, CH2COOH, Hal.
В качестве диенофила может выступать и сам диен:

Диенофилами могут быть также ацетиленовые производные и аллены:



Особенно часто в качестве диенофила используют следующие молекулы:

В качестве диенофилов могут выступать вещества, содержащие двойные или тройные связи между гетероатомами:

Структурные особенности диенов:

Почти все сопряженные диены вступают в реакцию с подходящими диенофилами. Единственное условие – диеновые субстраты не должны быть заморожены в трансоидной конформации.
Сам бензол – очень плохой диен, однако антрацен и другие подобные ароматические соединения легко вступают в реакцию Дильса-Альдера. Антрацен может быть использован как ловушка лабильного дегидробензола.

Одна двойная связь может быть частью ароматической системы (стирол). Диеном может быть ароматический гетероцикл (фуран). В реакцию могут вступать сопряженные диены с гетероатомами. «Диен» может представлять собой и сопряженный енин.

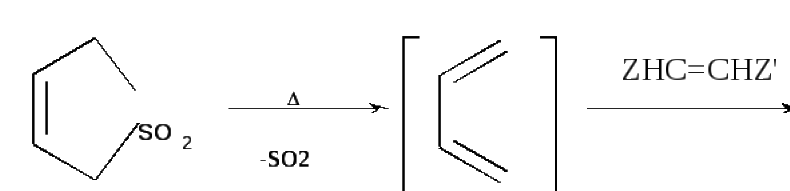
Вместо бутадиена в реакции Дильса-Альдера удобно использовать 3-сульфолен (твердое вещество) в качестве прекурсора (предшественника) бутадиена: бутадиен генерируется in situ по ретрореакции Дильса-Альдера:
Стереохимический аспект реакции Дильса-Альдера
1) По отношению к диенофилу реакция проходит стереоспецифично, как син-процесс:

2) По отношению к диену: реакции 1,4-дизамещенных диенов менее изучены, но и здесь реакция проходит как стереоспецифичное син-присоединение:

3) Диен должен быть в цисоидной конформации, т. е. либо «заморожен» (зафиксирован) в ней, либо должен иметь возможность принять ее в момент реакции. Если он заморожен в трансоидной конформации, реакция не происходит:

4) Для циклических диенов существует две возможности присоединения несимметричных диенофилов: «под кольцом» может находиться более объемистая (с бóльшим стерическим объемом) сторона диенофила (эндо-присоединение), либо менее объемная его часть (экзо-присоединение)
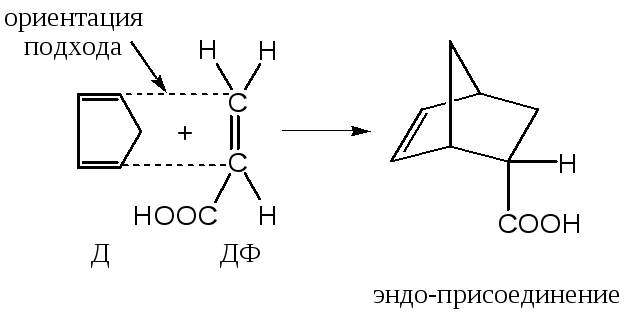
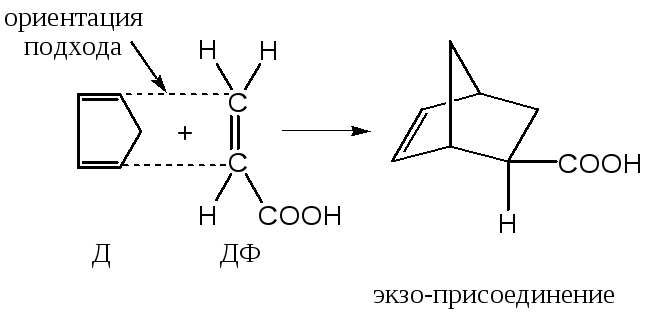
Обычно преобладает эндо-присоединение, однако в некоторых случаях образуется смесь продуктов эндо- и экзо-присоединения.
Региоселективность присоединения
При присоединении несимметричных диенов к несимметричным диенофилам возникает проблема позиционной селективности присоединения: кроме стереоизомеров возможно образование и двух позиционных изомеров:


Такая региоселективность может быть объяснена с помощью расчетов по методу МО.
Реакционная способность
Электронодонорные заместители в диене ускоряют реакцию, электроноакцепторные – замедляют.
Для диенофила справедливо обратное: электронодонорные заместители в диенофиле замедляют реакцию, электроноакцепторные – ускоряют.
-
Э/д: в Д↑, в ДФ↓
Э/а: в Д↓, в ДФ↑
Значит, можно рассматривать диен как нуклеофил, а диенофил − как электрофил.
Диены с фиксированной цисоидной конформацией реагируют быстрее, чем соединения с открытой цепью, которые приобретают эту конформацию в ходе реакции в результате вращения.
Конкурентные реакции
Конкурентными процессами могут быть полимеризация диена, диенофила или полимеризация и диена, и диенофила одновременно (в результате имеет место осмоление реакционной массы). Иногда в качестве конкурентной реакции выступает 2,2-циклоприсоединение.
Механизм реакции Дильса-Альдера
Можно представить три механизма присоединения по Дильсу-Альдеру:
1) Согласованное присоединение без образования интермедиата, то есть в одну стадию

2) Образование бирадикала с последующей рекомбинацией спинов – циклизацией:

3) Гетеролитический механизм с образованием биполярного интермедиата:

В большинстве случаев реакция идет по первому механизму с циклическим переходным состоянием.
Доказательства механизма
1) Стереоспецифичность реакции как по отношению к диену, так и по отношению к диенофилу. Бирадикал или диион, по-видимому, не способны сохранять конфигурацию из-за возможности вращения в интермедиате.
2) Скорость реакции Дильса-Альдера очень мало зависит от природы растворителя. Это исключает возможность образования диионного (биполярного) интермедиата, так как полярные растворители ускоряют реакции, в переходных состояниях которых возникают заряды.
Имеются и другие доказательства в пользу согласованного механизма, однако это не означает, что в переходном состоянии образование обеих новых -связей происходит полностью синхронно, в одинаковой степени: вполне возможно, что процесс образования связи для одной связи происходит быстрее, чем для другой.
