
Лекция_16
.docЛекция 16
-
Реакции элиминирования
Будут рассматриваться реакции –элиминирования:
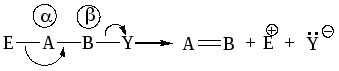
Эти реакции подразделяются на 2 типа:
-
реакции, происходящие в растворах;
-
реакции, происходящие без растворителя (главным образом, в газовой фазе – пиролитическое элиминирование).
-
Реакции, происходящие в растворах
-
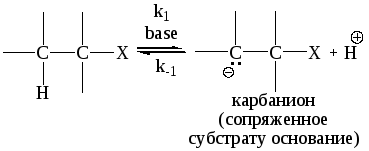
Механизм Е2 (бимолекулярное элиминирование)
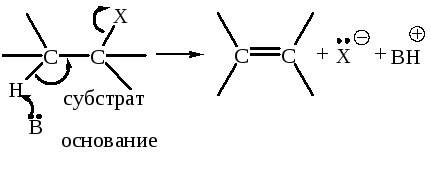
Для этих реакций характерно, что две группы отщепляются одновременно, при этом протон как бы вытягивается из субстрата основанием.
В – основание; нейтральное или отрицательно заряженное.
Х – нуклеофуг, положительно заряженный или нейтральный.
Реакция одностадийная, подчиняется кинетике второго порядка: первого по субстрату и первого по основанию. Эти реакции, как правило, всегда конкурируют с реакциями SN2:
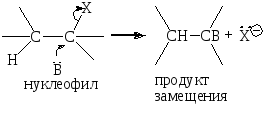
Доказательство механизма Е2:
1. Кинетика второго порядка.
2. Наблюдается кинетический изотопный эффект (КИЭ): при замене уходящего водорода на дейтерий наблюдается уменьшение скорости реакции в 6-8 раз, что согласуется с разрывом связи углерода с водородом в переходном состоянии.
Эти два признака механизма Е2 характерны и для механизма Е1сВ, речь о котором пойдет ниже.
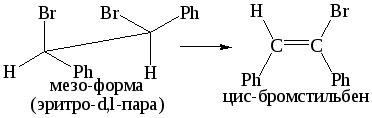
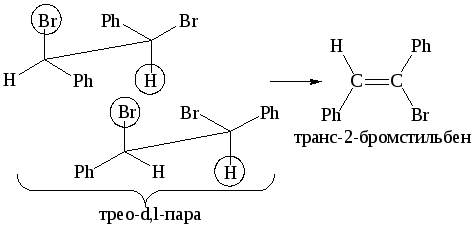
3. Стереохимия процесса – главное доказательство. Реакция Е2 стереоспецифичная: в переходном состоянии рвущиеся связи С-Н и С-Х и образующаяся связь С=С должны располагаться в одной плоскости (т. е. все пять атомов, включая основание В, должны лежать в одной плоскости), так как образование –связи требует, чтобы оси перекрывающихся р-орбиталей были параллельны. Копланарное расположение может быть достигнуто двумя способами:
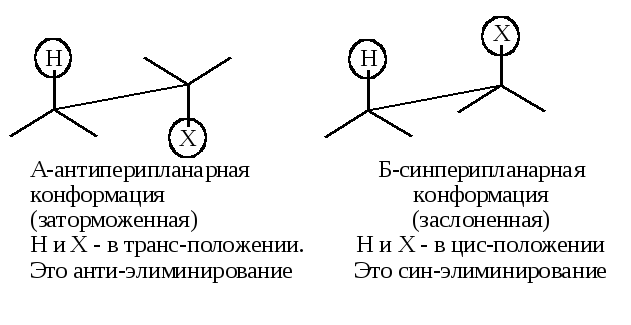
Конформация А предпочтительнее, чем конформация Б. Следовательно, анти-элиминирование существенно преобладает над син-элиминированием.
Стереоспецифичность элиминирования является одним из основных доказательств механизма Е2, а именно, при анти-элиминировании эритро-изомеры (d,l-пара или оптически активный изомер) должны давать цис-олефины, а трео-изомеры – транс-олефины:
В некоторых случаях син-элиминирование может реализовываться и даже преобладать, если: а) стерические препятствия мешают образованию анти-перипланарного переходного состояния; б) если основание В существует в виде ионных пар; в) при наличии некоторых конформационных факторов.
-
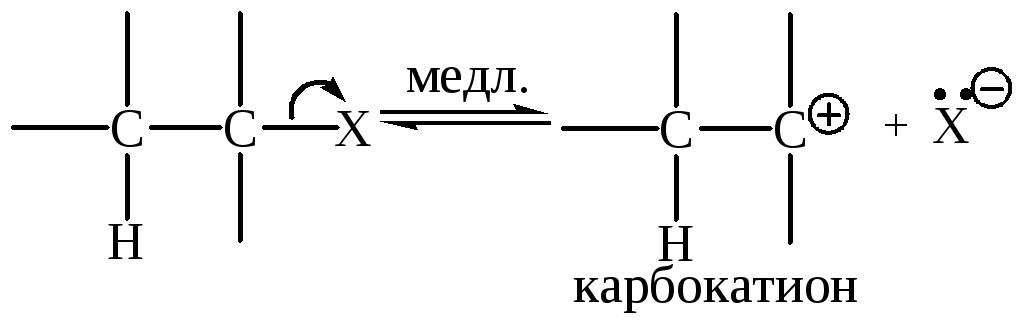
Механизм Е1 (мономолекулярное элиминирование)
Это двухстадийный процесс.
Стадия 1 – лимитирующая (медленная), аналогична 1-й стадии механизма SN1:
Стадия 2 – быстрая:
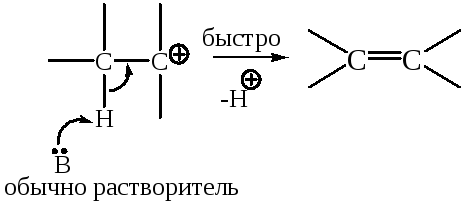
Конкурирующая реакция – SN1-замещение:

В большинстве случаев реакция следует механизму Е1 без добавления основания.
Реакции Е1 следуют кинетике первого порядка (по субстрату). Первый порядок может наблюдаться и в том случае, если в скоростьопределяющей стадии реакции участвует растворитель (псевдопервый порядок), т. е. реакция может иметь другой механизм (типа Е2) и при первом порядке по субстрату. Для доказательства именно такого (Е1) механизма процесса, т. е. для различения первого порядка от псевдопервого, применяют следующий прием: проводят реакцию в присутствии алкоголята – более мощного основания, чем сам спирт. В случае истинного первого порядка скорость реакции не должна увеличиваться.
-
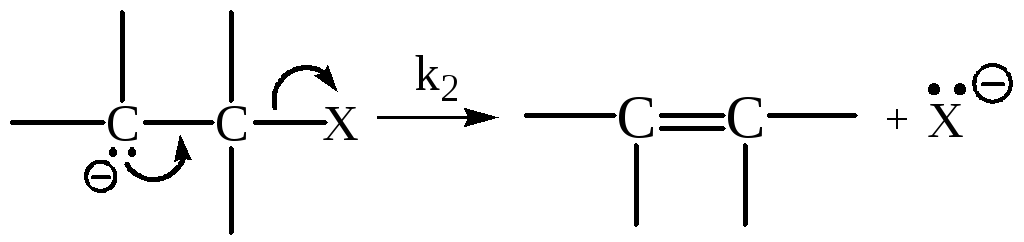
Механизм Е1сВ (карбанионный)
Это двухстадийный процесс. Вторая стадия представляет собой мономолекулярный распад сопряженного субстрату основания.
Стадия 1:
Стадия 2:
Различают 3 крайних случая этого механизма.
1) Механизм (E1cB)R − предравновесный.
Первая стадия строго обратима: k-1 » k2; k-1 » k1

Рисунок 1
2) Механизм (E1cB)I − неравновесный.
Первая стадия самая медленная и, по существу, необратима:
k-1 » k1; k2 » k-1
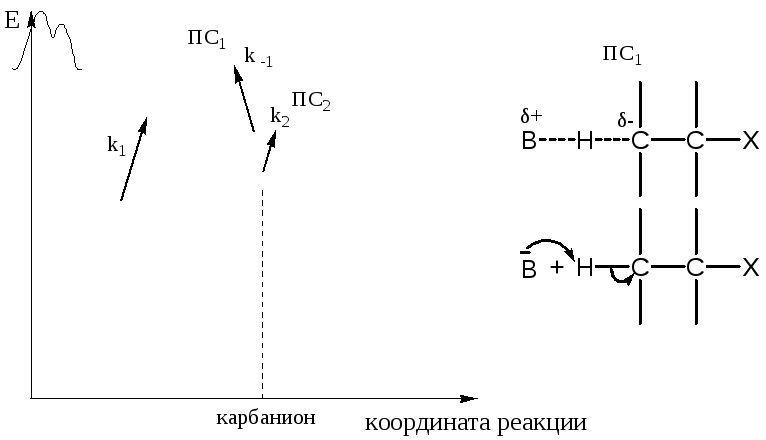
Рисунок 2
3) Механизм (Е1)анион
Первая стадия – быстрая и практически необратимая. Карбанион медленно превращается в продукт. Этот механизм характерен только для самых устойчивых карбанионов.
Можно ожидать, что по механизму Е1сВ будут реагировать субстраты, которые имеют:
а) слабый нуклеофуг;
б) кислый водород.
Механизм Е1сВ встречается довольно редко.
-
Спектр механизмов Е1 − Е2 − Е1сВ
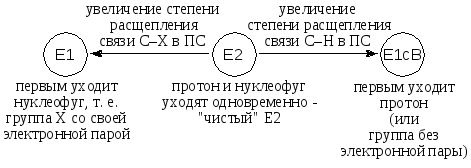
Большинство реакций Е2 находится не точно посередине спектра, а ближе к тому или иному его краю.
-
Позиционная ориентация двойной связи
1) Независимо от механизма реакции элиминирования двойная связь не может образовываться при углероде в голове моста мостиковой системы.
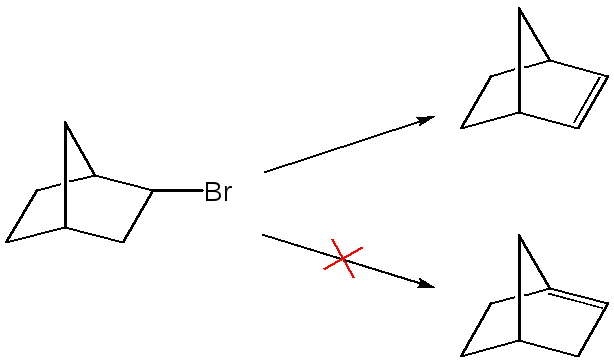
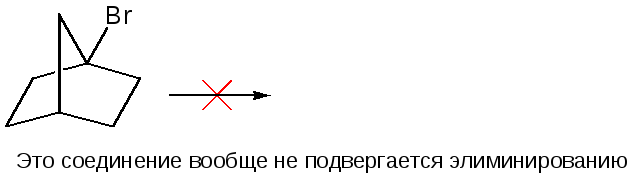
2) Независимо от механизма, если в молекуле уже имеется двойная связь С=С, С=О и др., и эта связь расположена так, что в результате элиминирования может образовываться сопряженный продукт, то обычно этот продукт и преобладает.
3) Механизм Е1
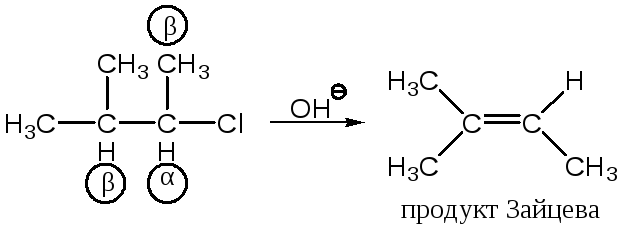
При этом механизме Х отделяется до того, как молекула делает «выбор» относительно направления образования новой связи (двойной). Поэтому это направление почти целиком определяется относительной устойчивостью двух (или трех) возможных изомерных продуктов реакции – олефинов. В таких случаях действует правило Зайцева:
|
двойная связь преимущественно образовывается у наиболее замещенного углерода, т. е. образуется олефин с максимально возможным числом алкильных групп при атомах углерода двойной связи С=С. Иначе говоря, водород отщепляется от наименее гидрогенизированного углеродного атома. |
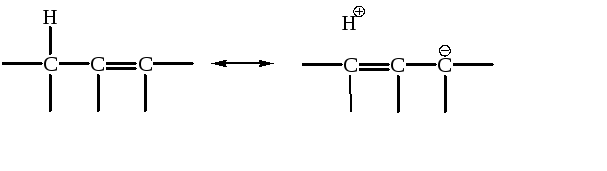
Известно, что олефины с максимально возможным числом алкильных групп при атомах углерода двойной связи С=С более стабильны. Это следует из данных по теплотам сгорания. Одним из объяснений является эффект гиперконъюгации:
Энергетическая диаграмма иллюстрирует это правило с помощью постулата Хэммонда:
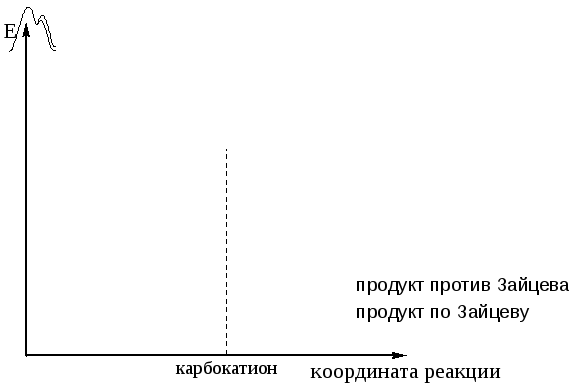
Рисунок 3
Правило Зайцева для реакций Е1 соблюдается как для нейтральных, так и для заряженных уходящих групп Х.
4) Механизм Е2:
Естественно, что если транс-водород имеется только с одной стороны по отношению к уходящей группе Х, то ориентация образующейся двойной связи предопределена (справедливо для циклических субстратов, поскольку в ациклических системах вращение вокруг ординарных связей свободное):
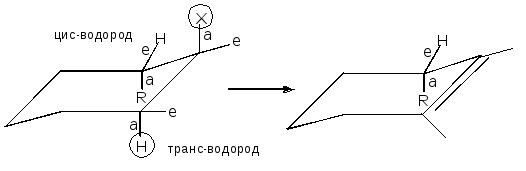
Но если при протекании реакции по механизму Е2 возможны два направления образования продуктов, то, несмотря на множество исключений:
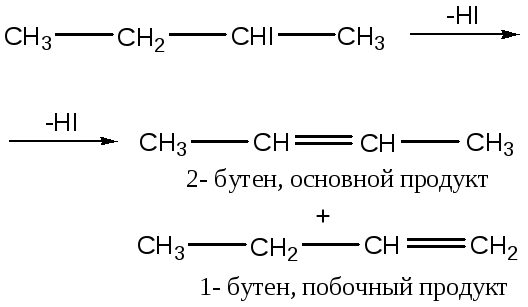
а) если Х – незаряженный нуклеофуг, т. е. уходит в виде отрицательной частицы, то соблюдается правило Зайцева, независимо от структуры субстрата:
![]()
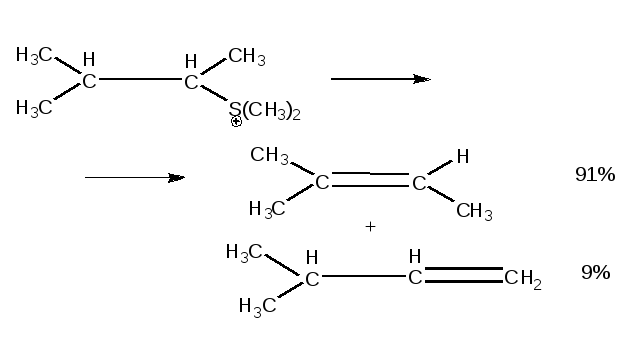
б) если Х – заряженный нуклеофуг, т. е. уходит в виде нейтральной частицы, то для ациклических субстратов соблюдается правило Гофмана, а для шестичленных циклов – правило Зайцева.
![]()
Правило Гофмана:
|
Двойная связь преимущественно образуется при наименее замещенном углероде. |
Формулировка Гофмана:
«Если в четвертичном аммониевом основании одной из алкильных групп является этил, то при разложении такого основания всегда образуется этилен».
Продукт Гофмана термодинамически менее устойчив, чем продукт Зайцева.
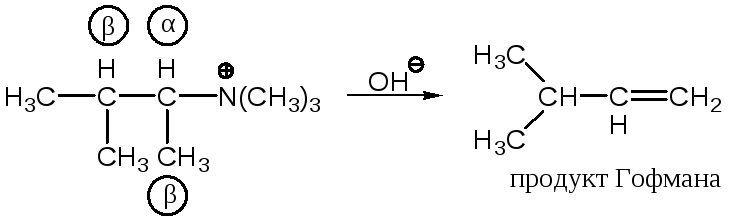
Оба эти правила (Зайцева и Гофмана) относятся к числу феноменологических правил.
-
Пространственная ориентация двойной связи
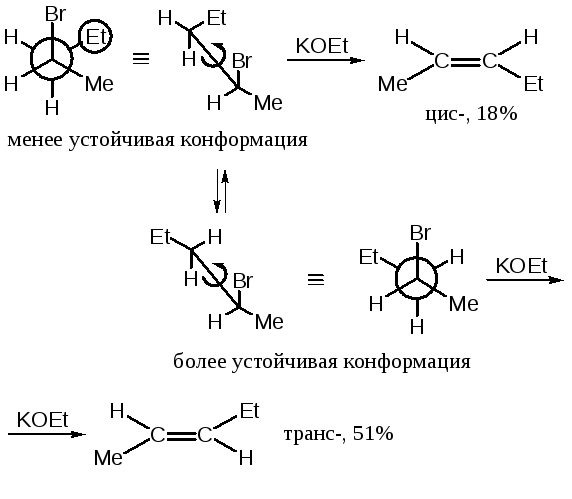
1) Анти-Е2 элиминирование
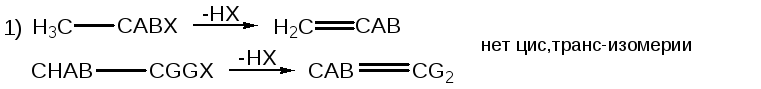
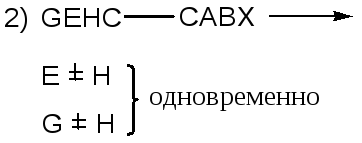
Имеет место стереоспецифичное элиминирование:

![]()
Имеет место стереоселективное, но не стереоспецифичное (нет диастереоизомерии), элиминирование:
2) Е1-элиминирование
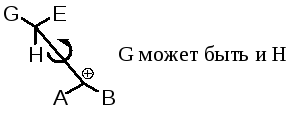
Независимо от геометрии исходного соединения, благодаря свободному вращению в карбокатионе, он принимает наиболее устойчивую конформацию с наименьшими стерическими затруднениями между G—Е и А—В. Из этой конформации и будет образовываться двойная связь (олефин). Значит, стереоспецифичность при таком элиминировании отсутствует, но оно может быть более или менее стереоселективным.
3) Е1сВ-элиминирование
Аналогичное рассмотрение позволяет сделать вывод об отсутствии стереоспецифичности при Е1сВ-элиминировании.
4) Промежуточные механизмы
В зависимости от положения в спектре механизмов наряду с продуктами Е1- или Е1сВ-элиминирования в некоторой степени образуются продукты, характерные для Е2-механизма.
