
- •ПЕРВИЧНАЯ СТРУКТУРА БЕЛКА
- •СТРУКТУРА АМИНОКИСЛОТ – МОНОМЕРНЫХ ЕДИНИЦ БЕЛКОВ
- •Классификация аминокислот по полярности бокового радикала
- •Аланин
- •Валин
- •Лейцин
- •Изолейцин
- •Метионин
- •Фенилаланин
- •Триптофан
- •Пролин -
- •Полярные
- •Глицин
- •Аспарагин
- •Глутамин
- •Серин
- •Треонин
- •Тирозин
- •Цистеин
- •Полярные
- •Аспарагиновая кислота
- •Глутаминовая кислота
- •Полярные
- •Лизин
- •Аргинин
- •Гистидин
- •Аминокислоты с алифатической боковой цепью
- •Ароматические аминокислоты
- •Аминокислоты с линейной кислородсодержащей цепью
- •Аминокислоты с серусодержащей боковой цепью
- •Кислые аминокимлоты и их производные
- •Аминокислоты с основной боковой цепью
- •Иминокислота - пролин
- •Некоторые характеристики аминокислот
- •НЕКОТОРЫЕ ФИЗИКО- ХИМИЧЕСКИЕ
- •Одинарные связи атома углерода
- •Хиральность
- •D-глицеральдегид L-глицеральдегид
- •D- и L-аминокислоты
- •Различные способы изображения энантиомеров
- •Природные аминокислоты – L-аминокислоты
- •Кислотно-основные свойства аминокислот
- •Слабая
- •Кривая титрования аланина
- •Кривая титрования лизина
- •Кривая титрования глутаминовой кислоты
- •Аминокисло
- •Спектр поглощения аминокислот
- •Пептидная связь и первичная структура белков
- •4 аминокислоты
- •Пентапептид
- •Свойства пептидной связи
- •Фрагмент полипептидной цепи
- •Карты Рамачандрана показывают «разрешенные» и « запрещенные»
- •Образование дисульфидных мостиков
- •1952 – 1956 Фредерик Сэнджер определил аминокислотную
- •Дисульфидные
- •Секвенирование полипептидов
- •Секвенирование по Сэнджеру
- •Секвенирование по Эдману
- •Масс-спектрометрия
- •Масс-спектр пептида GFYAEGSR
- •Пример схемы протеомных исследований
- •2. Масс-спектрометрия
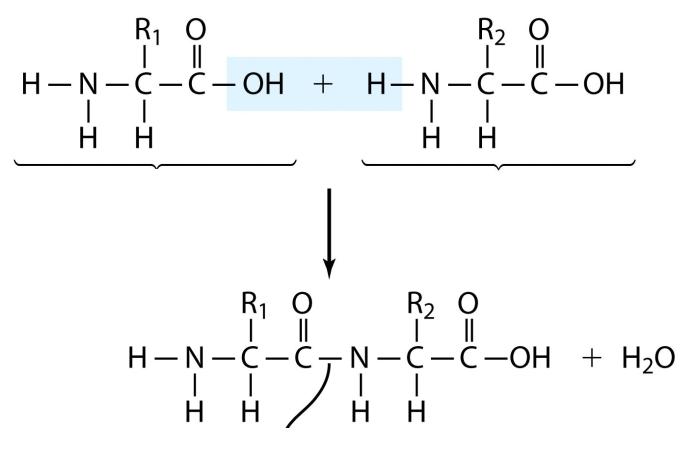
Пептидная связь и первичная структура белков
Аминокислота 1 |
|
Аминокислота 2 |
|
|
|
|
|
|
Пептидная связь
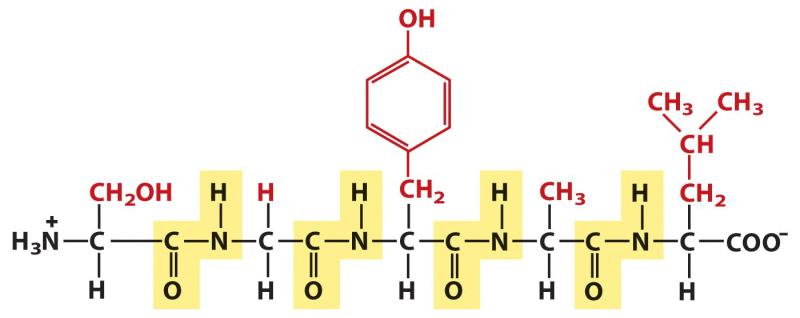
4 аминокислоты
Амино |
Карбоксиль |
группа |
ная группа |
С-конец
N-конец
Пептидные
связи
Полипептид
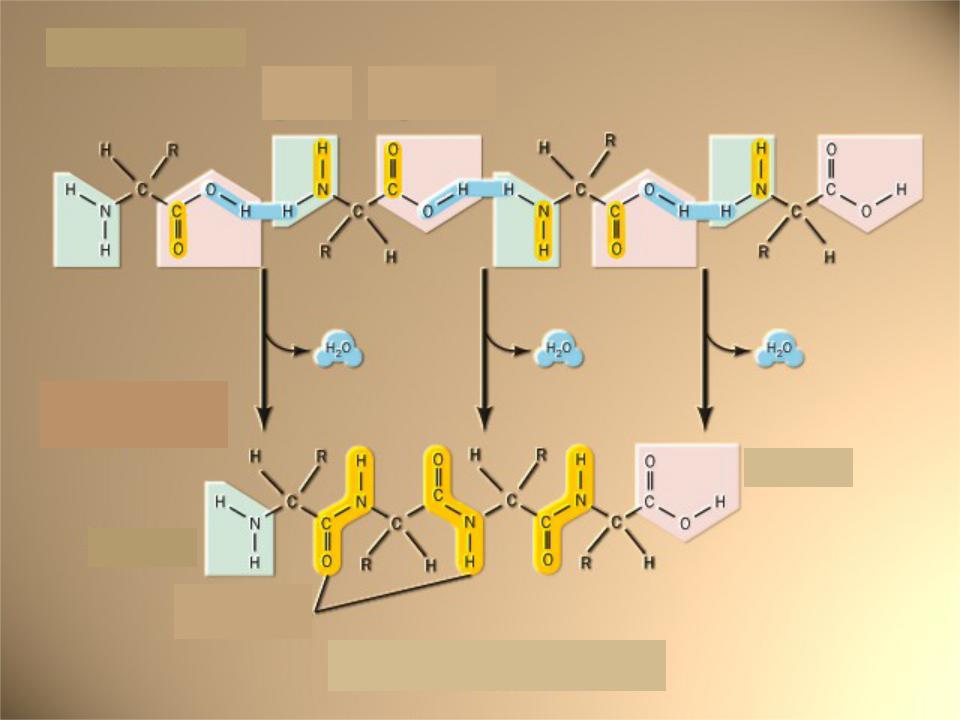
Пентапептид
SerGlyTyrAlaLeu
N-конец: аминогруппа |
С-конец: |
|
карбоксильная группа |
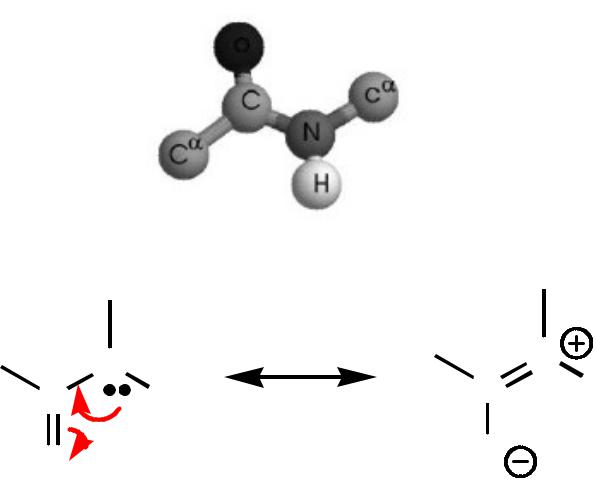
Свойства пептидной связи
О
R' C |
N R |
R' C |
N R |
O |
|
O |
|
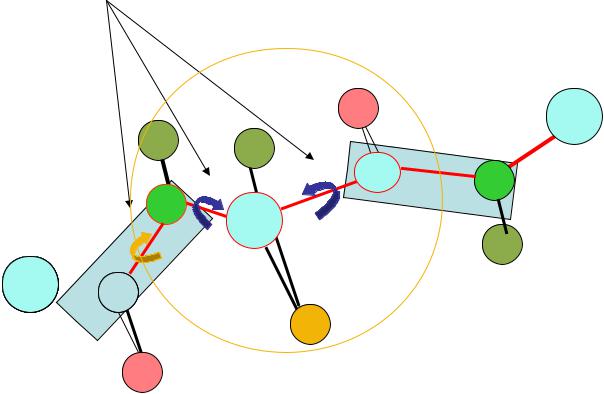
Фрагмент полипептидной цепи
Показаны углы внутреннего вращения
|
|
|
|
O |
|
Cα |
|
H |
H |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
C |
|
|
|
|
|
|
|
N |
|
|
N |
|
|
|
|
|
ω |
Cα |
ψ |
|
|
H |
|
|
φ |
|
|
|
Cα  C
C
R
O
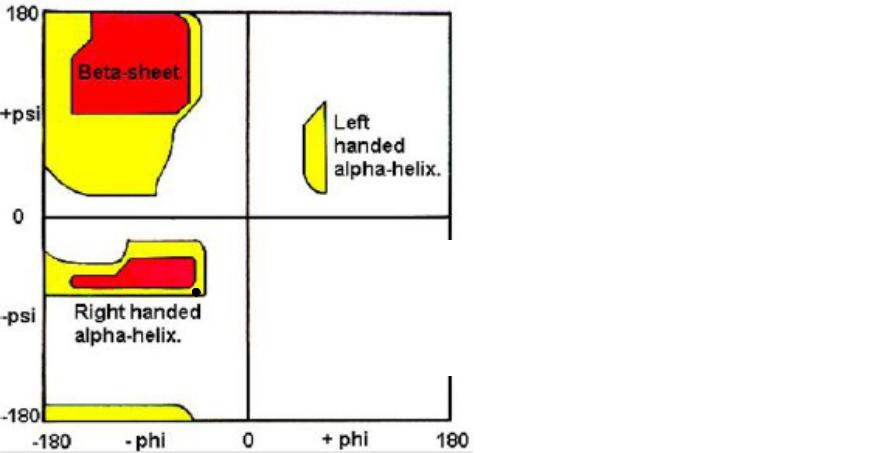
Карты Рамачандрана показывают «разрешенные» и « запрещенные»
конформации аминокислотных остатков в координатах ψ и φ
anti-parallel
parallel
 310-helix
310-helix
π-helix
Белый – запрещенные Красный – разрешенные Желтый – разрешенные, но нестабильные
•ψ угол вращения вокруг связи N - Calpha
•Ψ угол вращения вокруг связи C – Calpha
•ω угол вращения вокруг связи C – N
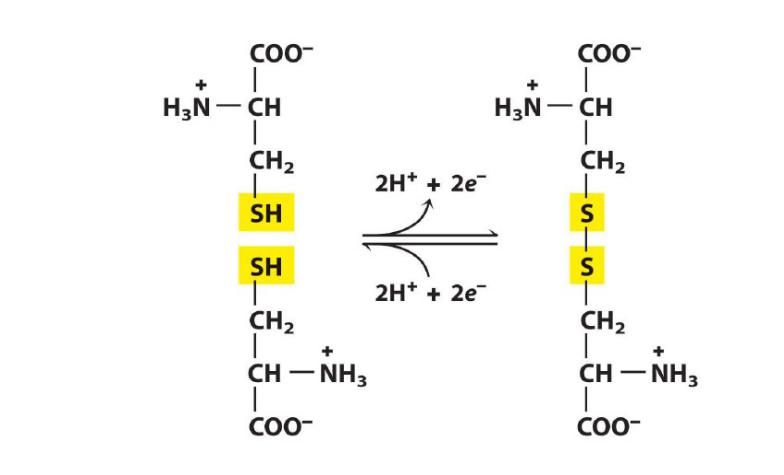
Образование дисульфидных мостиков
Цистеин
Цистин
Цистеин

1952 – 1956 Фредерик Сэнджер определил аминокислотную
последовательность пептидного гормона инсулина Нобелевская премия по химии 1958
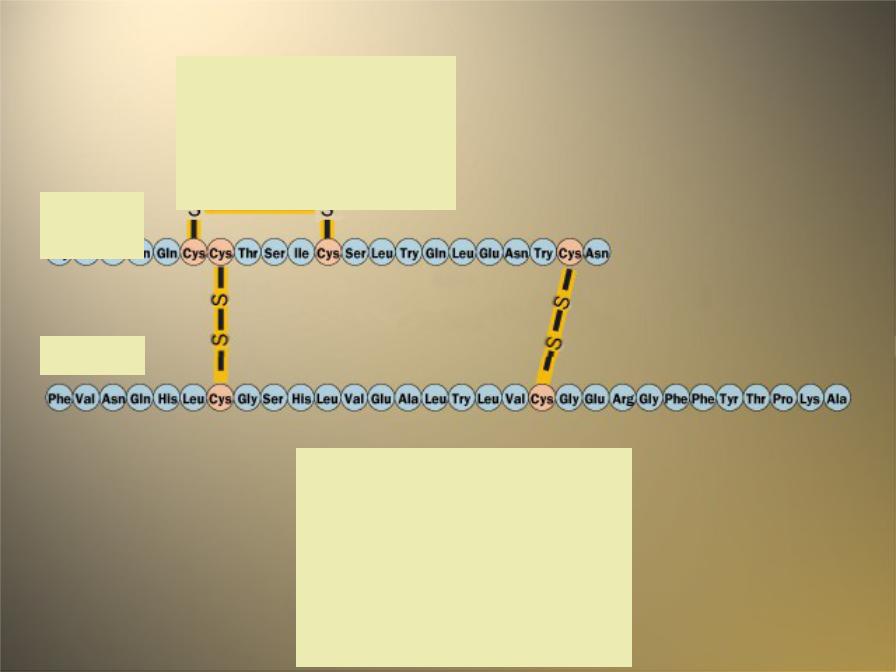
Дисульфидные
мостики
образованы
остатками
А- цистеина цепь
В-цепь
Первичная
структура инсулина быка
Секвенирование полипептидов
Основные этапы:
1) Расщепление белка на несколько фрагментов длиной, доступной для секвенирования.
2)Секвенирование каждого из полученных фрагментов.
3)Сборка полной структуры белка из установленных
структур |
его фрагментов |
1) Гидролиз ферментами: трипсин (Lys-X, Arg-X);
химотрипсин (Phe-X, Tyr-X, Trp-X)
Химический гидролиз: бромциан (Met)
2)Секвенирование по Сэнджеру; по Эдману; масс-спектрометрия
3)Метод перекрывающихся фрагментов
